- 2021-08-24 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省2021版高考化学一轮复习课时规范练23水的电离和溶液的酸碱性含解析 人教版
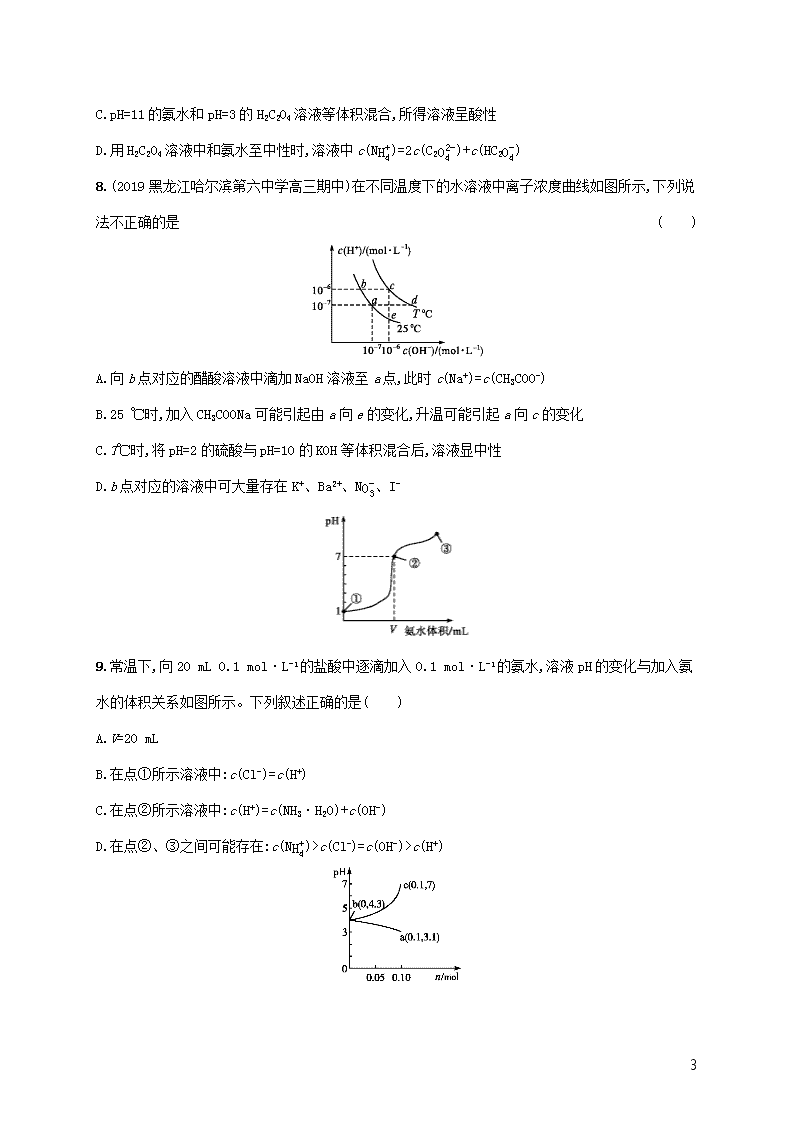
课时规范练23 水的电离和溶液的酸碱性 基础巩固 1.(2019湖北部分重点中学高三上学期起点考试)下列有关滴定操作的说法正确的是( ) A.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mL B.用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低 C.用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高 D.用未知浓度的盐酸滴定标准的KOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高 2.常温时,下列叙述正确的是( ) A.稀释pH=3的醋酸溶液,溶液中所有离子的浓度均降低 B.用标准盐酸滴定未知浓度的烧碱溶液,滴定前仰视,滴定后俯视,测得的烧碱溶液浓度偏低 C.pH均为11的NaOH和NH3·H2O溶液中,水的电离程度不相同 D.分别中和pH与体积均相同的硫酸和醋酸溶液,硫酸溶液消耗氢氧化钠的物质的量多 3.常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合(假设混合溶液的体积为二者体积之和),所得溶液的pH等于12,则原溶液的浓度为( ) A.0.01 mol·L-1 B.0.17 mol·L-1 C.0.05 mol·L-1 D.0.50 mol·L-1 4.(2019安徽合肥高三质量检测)在指定条件下,下列各组离子一定能大量共存的是( ) A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- B.滴入KSCN溶液显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- C.c(OH-)c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32- D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH4+、AlO2-、HCO3- 5.(2019广东深圳高级中学高三月考)室温下,下列说法正确的是( ) 11 A.将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3 B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大 C.将10 mL pH=3的HA溶液稀释到100 mL,若溶液的pH<4,则HA为弱酸 D.向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中c(OH-)c(NH3·H2O)增大 6.过氧化氢的水溶液适用于医用消毒、环境消毒和食品消毒。 Ⅰ.过氧化氢性质探究实验 (1)酸性条件下H2O2可将Fe2+转化成Fe3+,由此说明H2O2具有 性。 (2)已知H2O2是一种二元弱酸,其中Ka1=2.20×10-12、Ka2=1.05×10-25,则H2O2的电离方程式为 ,常温下,1 mol·L-1的H2O2溶液的pH约为 。 Ⅱ.过氧化氢含量的测定实验 某兴趣小组同学用0.100 0 mol·L-1的酸性高锰酸钾标准溶液滴定试样中过氧化氢的浓度,反应原理为2MnO4-+5H2O2+6H+2Mn2++8H2O+5O2↑。 (3)滴定达到终点的现象是 。 (4)用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表所示: 第一次 第二次 第三次 第四次 V(KMnO4溶液)/mL 17.10 18.10 18.00 17.90 计算试样中过氧化氢的浓度为 mol·L-1。 (5)若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果 (填“偏高”“偏低”或“不变”)。 能力提升 7.常温下,已知电离常数:Kb(NH3·H2O)=1.8×10-5;Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。下列说法正确的是( ) A.(NH4)2C2O4溶液中,c(NH4+)=2c(C2O42-) B.等物质的量浓度的氨水和H2C2O4溶液等体积混合,所得溶液呈碱性 11 C.pH=11的氨水和pH=3的H2C2O4溶液等体积混合,所得溶液呈酸性 D.用H2C2O4溶液中和氨水至中性时,溶液中c(NH4+)=2c(C2O42-)+c(HC2O4-) 8.(2019黑龙江哈尔滨第六中学高三期中)在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( ) A.向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) B.25 ℃时,加入CH3COONa可能引起由a向e的变化,升温可能引起a向c的变化 C.T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 D.b点对应的溶液中可大量存在K+、Ba2+、NO3-、I- 9.常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是( ) A.V=20 mL B.在点①所示溶液中:c(Cl-)=c(H+) C.在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-) D.在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+) 11 10.(2019广东肇庆教学质量评估)在25 ℃时,将1.0 L c mol·L-1CH3COOH溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是( ) A.水的电离程度:c>b>a B.a点对应的混合溶液中,c(CH3COOH)>c(Na+)>c(OH-) C.当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-) D.该温度下,醋酸的电离平衡常数Ka=10-8c 11.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示: (1)25 ℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由: 。 (2)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。 (3)95 ℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。 实验序号 Ba(OH)2溶液的体积/mL 盐酸的体积/mL 溶液的pH ① 22.00 0.00 8 ② 22.00 18.00 7 ③ 22.00 22.00 6 假设溶液混合前后的体积不变,则a= ,实验②所得溶液中由水电离产生的c(OH-)= mol·L-1。 12.现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液。试回答下列问题: (1)甲溶液的pH= 。 11 (2)丙溶液中存在的电离平衡为 (用电离平衡方程式表示)。 (3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随加水量的增加而增大的是 (填序号)。 ①n(H+) ②c(H+) ③c(CH3COOH)c(CH3COO-) ④c(OH-) (4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为 。 (5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题: ①甲溶液滴定丙溶液的曲线是 (填“图1”或“图2”)曲线。 ②a= 。 拓展深化 13.常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题: (1)该温度时NH3·H2O的电离常数K= 。 (2)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为 。 (3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是 (填字母,下同)。 A.c(H+)·c(OH-) 11 B.c(H+)c(OH-) C.c(NH4+)·c(OH-)c(NH3·H2O) D.c(NH3·H2O)·c(H+)c(NH4+) (4)根据以上滴定曲线判断下列说法正确的是 (溶液中N元素只存在NH4+和NH3·H2O两种形式)。 A.b点所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O) B.c点所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+) C.d点所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) (5)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 。 课时规范练23 水的电离和溶液的酸碱性 1.D 滴定管精确值为0.01mL,读数应保留小数点后2位,A项错误;用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,由于没有润洗,标准液浓度减小,消耗标准液体积增大,则测定结果偏高,B项错误;所用的固体KOH中混有NaOH,由于相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配的溶液的OH-浓度偏大,导致消耗标准液的体积偏小,则测定结果偏低,C项错误;用未知浓度的盐酸滴定标准的KOH溶液时,若滴定前仰视读数,滴定至终点后俯视读数,导致消耗的盐酸体积偏小,依据c(酸)=c(碱)×V(碱)V(酸)可知测定结果偏高,D项正确。 2.B 稀释pH=3的醋酸溶液,醋酸的电离程度增大,n(H+)、n(CH3COO-)增大,但c(H+)、c(CH3COO-)减小,根据KW=c(H+)·c(OH-)可知,c(OH- 11 )增大,A项错误;滴定前仰视,读数偏大,滴定后俯视,读数偏小,则读取的标准盐酸的体积偏小,导致测得的烧碱溶液浓度偏低,B项正确;pH均为11的NaOH和NH3·H2O溶液中,c(OH-)相同,故水的电离程度相同,C项错误;醋酸为弱酸,不完全电离,故分别中和pH与体积均相同的硫酸和醋酸溶液时,醋酸溶液消耗氢氧化钠的物质的量多,D项错误。 3.C 设原溶液物质的量浓度均为cmol·L-1,NaOH溶液体积为3L,HCl溶液体积为2L,则二者混合后溶液体积为5L。因为常温下二者混合反应后所得溶液pH=12,即c(H+)=10-12mol·L-1,所以c(OH-)=KWc(H+)=10-2mol·L-1,则cmol·L-1×3L-cmol·L-1×2L=10-2mol·L-1×5L,解得c=0.05,则原溶液的浓度为0.05mol·L-1。 4.B 滴加甲基橙试剂显红色的溶液呈酸性,在酸性溶液中H+、Fe2+、NO3-不能共存,A项错误;滴入KSCN溶液显血红色的溶液中含有Fe3+,Fe3+与NH4+、Mg2+、SO42-、Cl-不会发生反应,可大量共存,B项正确;c(OH-)c(H+)=1012的溶液显强碱性,NH4+、Al3+不能大量共存,Al3+和CO32-发生离子反应不能大量共存,C项错误;室温下纯水电离产生的c(H+)=1.0×10-7mol·L-1,但该溶液中由水电离的c(H+)=1.0×10-13mol·L-1<1.0×10-7mol·L-1,说明水的电离受到了抑制,则该溶液可能呈酸性也可能呈碱性。在酸性溶液中AlO2-、HCO3-不能大量存在;在碱性溶液中NH4+不能大量存在,D项错误。 5.C 混合后c(H+)=10-2+10-42mol·L-1≈0.5×10-2mol·L-1,pH=2.3,故A项错误;根据越弱越水解的原则,HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH小,故B项错误;将10mLpH=3的HA溶液稀释到100mL,如pH=4,则HA为强酸,如pH<4,加水促进弱酸的电离,则HA为弱酸,故C项正确;向0.1mol·L-1氨水中加入少量硫酸铵固体,加入少量硫酸铵固体,平衡向逆方向移动,溶液中c(OH-)c(NH3·H2O)减小,故D项错误。 6.答案:Ⅰ.(1)氧化 (2)H2O2H++HO2-、HO2-H++O22- 5.8 Ⅱ.(3)当滴入最后一滴标准溶液,锥形瓶内溶液恰好由无色变为紫色,且半分钟内溶液不褪色 (4)0.180 0 (5)偏高 解析:Ⅰ.(1)酸性条件下,H2O2可将Fe2+氧化为Fe3+,体现了过氧化氢的氧化性。(2)过氧化氢属于二元弱酸,应分步电离,其电离的方程式为H2O2H++HO2-、HO2-H++O22-;又Ka1=2.20×10-12,Ka2=1.05×10-25,Ka1≫Ka2,以第一步电离为主,则Ka1=c(H+)·c(HO2-)c(H2O2)=c2(H+)1mol·L-1=2.20×10-12mol·L-1,所以c(H+)≈1.48×10-6mol·L-1,即pH≈5.8。Ⅱ. 11 (3)滴定达到终点的现象是当滴入最后一滴标准液,锥形瓶内溶液恰好由无色变为紫色,且半分钟内溶液不褪色。(4)由于第一次数据误差过大,故应舍去;其他三组数据的平均值为18.00mL,根据反应2MnO4-+5H2O2+6H+2Mn2++8H2O+5O2↑,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol·L-1×0.018L,c(H2O2)=2.5×0.1000×0.0180.025mol·L-1=0.1800mol·L-1。(5)滴定前滴定管尖嘴处有气泡,滴定后消失,导致读取的标准液体积偏大,则测定结果偏高。 7.D Kb(NH3·H2O)与Ka2(H2C2O4)不相等,因此NH4+、C2O42-的水解程度不同,故(NH4)2C2O4溶液中c(NH4+)≠2c(C2O42-),A项错误;等物质的量浓度的氨水和H2C2O4溶液等体积混合,反应后得到NH4HC2O4溶液,由于Kb(NH3·H2O)查看更多