- 2021-08-24 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届安徽省淮北一中高二上学期第二次月考(2017
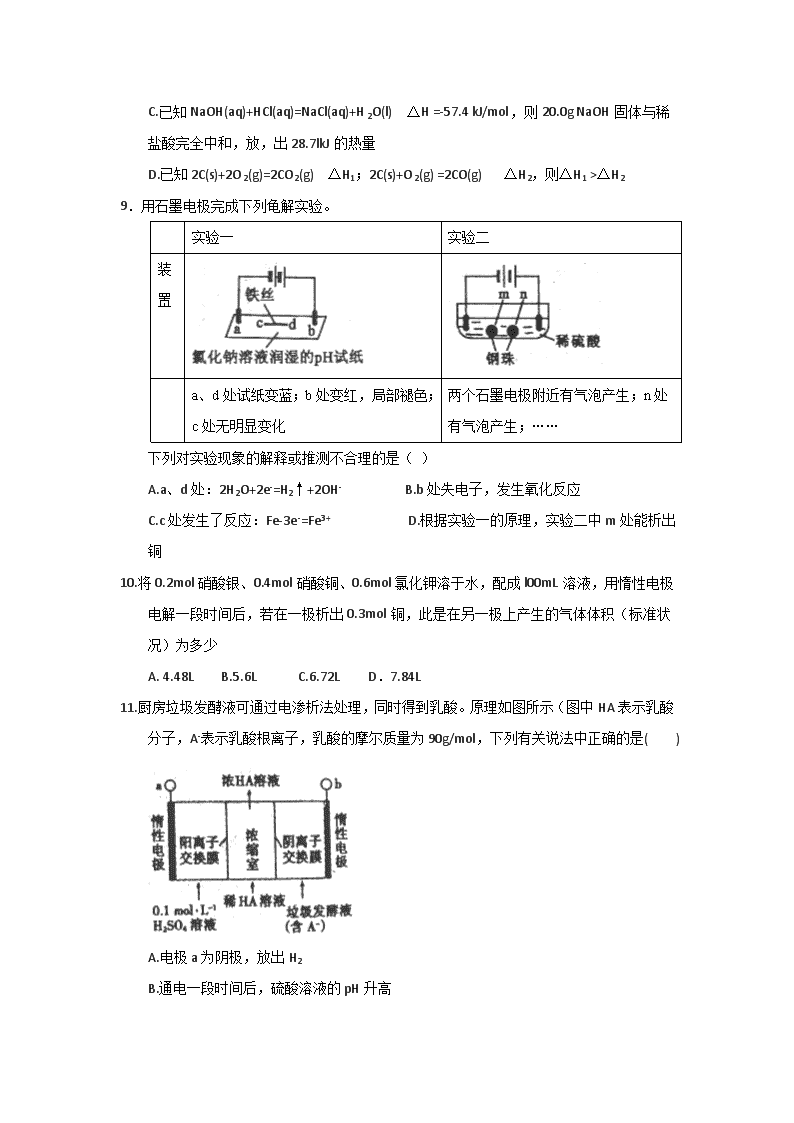
安徽省淮北市第一中学 2017-2018 学年高二上学期第二次月 考 化学 注意事项: 1、本试卷分为 I 卷(选择题)和Ⅱ卷(非选择题)两部分 2、答题前,考生务必将自己的姓名、准考证号填写在试卷相应的位置 3、全部答案写在答题卡上,写在试卷上无效 4、本试卷满分 100 分,测试时间 100 分钟 5、相对原子质量:H:1 C:12 N:14 O:16 Na:23 A1:27 S:32 C1:35.5 Fe:56 Cu:64 Ag:108 I 卷 一、,选择题(本题包括 21-J、题,每小题 2 分,共 42 分.每小题只有一个选项符合盟意) 1.化学与生产和生活密切相关,下列说法正确的是( ) A.聚乙烯塑料的老化是因为发生了加成反应 B.煤经过气化和液化等物理变化可转化为清洁燃料 C.合成纤维、人造纤维及碳纤维都属于有机高分子材料 D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 2.设 NA 为阿伏加德罗常数值。下列有关叙述正确的是( ) A. 14g 乙烯和丙烯混合气体中的氢原子数为 2NA B.27g 铝中加入 1mol/L 的 NaOH 溶液,转移电子数是 3NA C.1 molFe 溶于过量硝酸,电子转移数为 2NA D.标准状况下,44. 8LNO 与 22. 4LO2 反应后的分子数是 2NA 3.向铝土矿(含 A12O3、FeO、Fe2O3、SiO2)中加入适量硫酸溶液,分别取浸取液并向其中加 入指定物质,反应后的溶液中主要存在的一组离子正确的是( ) A.通入过量 SO2:H+、Fe2+、A13+、SO42- B.通入过量氨气:NH4+、A1O2-、OH-、SO42- C.加入过量 NaClO 溶液:Fe2+、Na+、,ClO-、SO42- D.加入过量 NaOH 溶液:Na+、A1O2-、OH-、SO42-、SiO32- 4.对中国古代著作涉及化学的叙述,下列解读错误的是 A.《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是 Ca(OH)2 B.《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐 C. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是 K2CO3 D.《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油 5.下列实验操作能达到实验目的或得出相应结论的是() 实验操作 目的或结论 A 将 Cu 片放入 FeC13 溶液中 证明 Fe 的金属性比 Cu 强 B 将点燃的镁条置于盛有 C02 的集气瓶中,瓶内壁有黑色固 体生成 镁与 CO2 发生置换反 应 C 将 SO2 通入溴水或酸性 KMnO4 溶液中 证明 SO2 有漂白性 D 向 FeCl2 溶液(含少量 FeBr2 杂质)中,加入适量氯水,再 加 CC14 萃取分液 除去 FeCl2 溶液中的 FeBr2 6.已知 (b)、 (d)、 (p)的分子式均为 C6H6,下列说法正确的是( ) A.b 的同分异构体只有 d 和 p 两种 B.b、d、p 的二氯代物均只有三种 C.b、d、p 均可与酸性高锰酸钾溶液反应 D.b、d、p 中只有 b 的所有原子处于同 一平面 7.C 和 H2 在生产、生活、科技中是重要的燃料。 ①2C(s)+O2(g)= 2CO(g) △H=-220kJ/mol ② 下列推断正确的是( ) A.C(s)的燃烧热 ll0kJ/mol B.2H2 (g) +O2 (g) =2H2O (g) △H=+480kJ/mol C.C(s) +H2O(g)==CO(g) +H2 (g) △H=-220kJ/mol D.分解 2molH2O(1),至少需要 4×462kJ 的热量 8.下列依据热化学方程式得出的结论正确的是( ) A.若 2H2(g)+O2(g) =2H2O(g) △H=-483.6 kJ/mol,则 l molH2 燃烧放出热量为 241.8 kJ/mol B.若 C(石墨,s)=C(金刚石,s) △H >0,则石墨比金刚石稳定 C.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H =-57.4 kJ/mol,则 20.0g NaOH 固体与稀 盐酸完全中和,放,出 28.7lkJ 的热量 D.已知 2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g) =2CO(g) △H2,则△H1 >△H2 9.用石墨电极完成下列龟解实验。 实验一 实验二 装 置 a、d 处试纸变蓝;b 处变红,局部褪色; c 处无明显变化 两个石墨电极附近有气泡产生;n 处 有气泡产生;…… 下列对实验现象的解释或推测不合理的是( ) A.a、d 处:2H2O+2e-=H2↑+2OH- B.b 处失电子,发生氧化反应 C.c 处发生了反应:Fe-3e-=Fe3+ D.根据实验一的原理,实验二中 m 处能析出 铜 10.将 0.2mol 硝酸银、0.4mol 硝酸铜、0.6mol 氯化钾溶于水,配成 l00mL 溶液,用惰性电极 电解一段时间后,若在一极析出 0.3mol 铜,此是在另一极上产生的气体体积(标准状 况)为多少 A. 4.48L B.5.6L C.6.72L D.7.84L 11.厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸。原理如图所示(图中 HA 表示乳酸 分子,A-表示乳酸根离子,乳酸的摩尔质量为 90g/mol,下列有关说法中正确的是( ) A.电极 a 为阴极,放出 H2 B.通电一段时间后,硫酸溶液的 pH 升高 C.A-通过阴离子交换膜从阴极进入浓缩室 D.对 400mLl0g/L 乳酸溶液通电后,当外电路通过 0.5mole-时浓度,上升为 145g.L-1(溶 液体积变化忽略不计) 12.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。 下列有关微生物电池的说法错误的是( ) A.负极反应中有 CO2 生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从正极区移向负极区 D.电池总反应为 C6H12O6+6O2=6CO2+6H2O 13.图中烧杯中盛的是天然水,铁腐蚀的速率由快到慢的顺序是( ) A. ③>②>①>⑤>④ B.⑤>②>①>③>④ C.⑤>②>③>④>① D.③>④>⑤>②> ① 14.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读下图,下列判断不正确的 是( ) A.K 闭合时,d 电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- B.当电路中转移 0.2 mol 电子时,I 中消耗的 H2SO4 为 0.2 mol C.K 闭合一段时间后,II 可单独作为原电池,d 电极为负极 D.K 闭合时,II 中 SO42-向 d 电极迁移 15.反应 CH3OH (l)+ NH3(g)=CH3NH2(g)+H2O (g)在某温度自发向右进行,若反应 H =17kJ/mol, ST-H =17kJ/mol,则下列正确的是( ) A. △H>0, △H-T△S<0 B. △H<0, △H-T△S>0 C. △H>0, △H-T△S>0 D. △H<0, △H-T△S<0 16.已知同温同压下,下列反应的焓变和平衡常数分别表示如下,有关说法正确的是( ) (1)2SO2(g)+O2(g) 2SO3(g) △Hl=-197 KJ/mol K1=a (2)2NO(g)+O2(g) 2NO2(g) △H2=-144 kJ/mol K2=b (3)NO2(g)+SO2(g) SO3(g)+NO(g) △H3=m kJ/mol K3=c A.m=26.5 c2= a/b B. m--26.5 2c=a-b C.m=-170.5 2c=a-b D. m=53 c2=a/b 17.一定条件下,CH4 与 H2O(g)~发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始 , 在恒压下, 平衡时φ(CH4)的体积分数与 Z 和 T(温度)的关系如图所示。下列说法正确的是( ) A.该反应的焓变△H<0 B.图中 Z 的大小为 b>3>a C.图中 X 点对应的平衡混合物中 D.温度不变时,图中 X 点对应的平衡在加压后φ(CH4)减小 18.在恒容密闭容器中通入 X 并发生反应:2X(g) Y(g),温度 Tl、T2 下 X 的物质的量浓度 c(x)随时间 t 变化的曲线如图所示,下列叙述正确的是( ) A.该反应进行到 M 点放出的热量大于进行到 W 点放出的热量. B.T2 下,在 0~tl 时间内, C.M 点的正反应速率 v 正大于 N 点的逆反应速率 v 逆 D.M 点时再加入一定量的 X,平衡后 X 的转化率减小 19.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)===2NH3(g) △H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( ) 容器编号 起始时各物质物质的量/mol 平衡时反应中的能量变化 N2 H2 NH3 ① 1 3 0 放出热量 a kJ ② 2 3 0 放出热量 b kJ ③ 3 6 0 放出热量 c kJ A.放出热量:a查看更多