- 2021-08-24 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年云南省玉溪市民族中学高二上学期期中考试化学试题
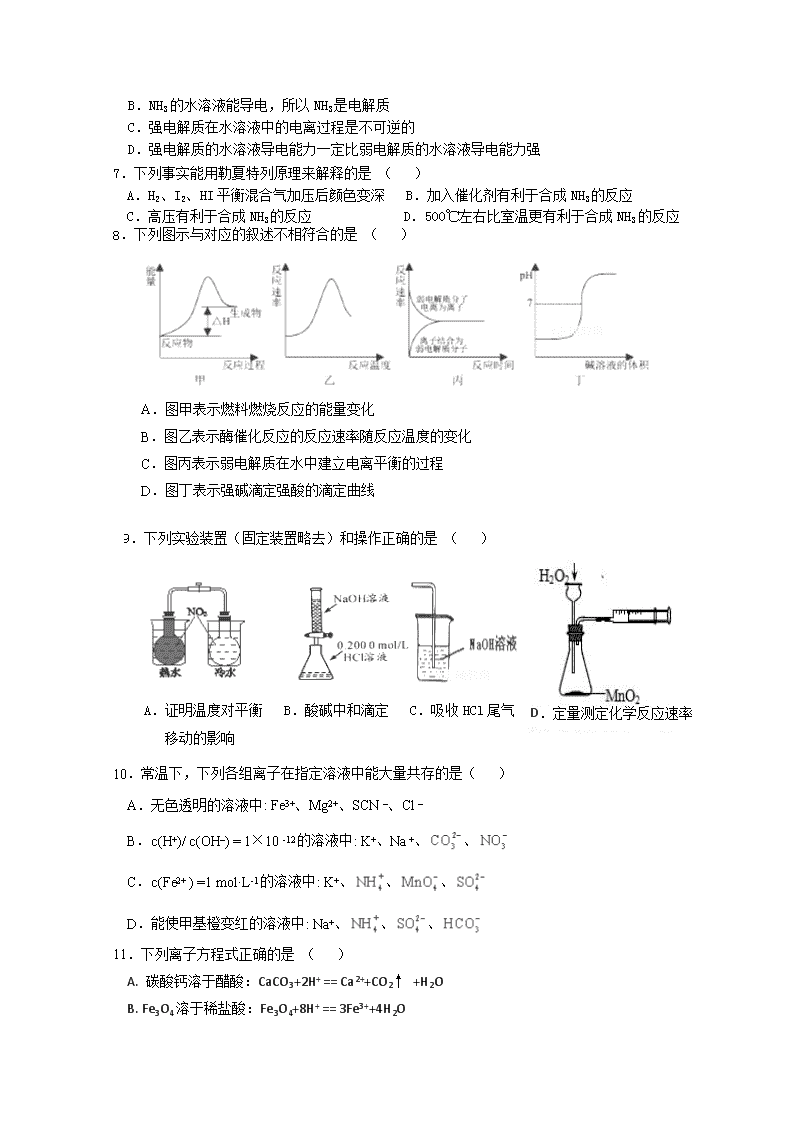
玉溪市民族中学2017—2018学年上学期期中考试 高二化学试卷 命题人: 联系电话: 审核人: 可能用到的相对原子质量: H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 Cu—64 一、选择题(本题包括25个小题,每小题2分,共50分,每小题只有1个正确答案) 1.下列既属于氧化还原反应,又属于吸热反应的是 ( ) A.碳酸钙的分解 B.灼热的炭与水蒸气的反应 C.Ba(OH)2·8H2O与NH4Cl的反应 D.铝片与稀盐酸反应 2.下列说法中正确的是( ) A.物质发生化学反应时不一定都伴随着能量变化 B.伴有能量变化的变化都是化学变化 C.放热反应不需要加热就一定能发生 D.反应热只与反应体系的始态和终态有关,而与反应的途径无关 3.在给定条件下,下列选项所示的物质间转化均能实现的是( ) 4.“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”说法中不正确的是( ) A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 B.增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子数增多,反应速率加快 D.活化分子之间的碰撞一定是有效碰撞 5.水的电离过程为H2O H++OH-,下列叙述正确的是( ) A. 升高温度,促进水的电离,c(H+)增大,PH增大 B. 加入NaOH,抑制水的电离,c(H+)和c(OH-)都减小 C. 水的离子积只适用于纯水,不适用于其他电解质水溶液 D. Kw只与温度有关 6.下列有关叙述中正确的是 ( ) A.碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质 B.NH3的水溶液能导电,所以NH3是电解质 C.强电解质在水溶液中的电离过程是不可逆的 D.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 7.下列事实能用勒夏特列原理来解释的是 ( ) A.H2、I2、HI平衡混合气加压后颜色变深 B.加入催化剂有利于合成NH3的反应 C.高压有利于合成NH3的反应 D.500℃左右比室温更有利于合成NH3的反应 8.下列图示与对应的叙述不相符合的是 ( ) A.图甲表示燃料燃烧反应的能量变化 B.图乙表示酶催化反应的反应速率随反应温度的变化 C.图丙表示弱电解质在水中建立电离平衡的过程 D.图丁表示强碱滴定强酸的滴定曲线 9.下列实验装置(固定装置略去)和操作正确的是 ( ) D.定量测定化学反应速率 A.证明温度对平衡 B.酸碱中和滴定 C.吸收HCl尾气 移动的影响 10.常温下,下列各组离子在指定溶液中能大量共存的是( ) A.无色透明的溶液中: Fe3+、Mg2+、SCN –、Cl – B.c(H+)/ c(OH–) = 1×10 -12的溶液中: K+、Na +、、 C.c(Fe2+ ) =1 mol·L-1的溶液中: K+、、、 D.能使甲基橙变红的溶液中: Na+、、、 11.下列离子方程式正确的是 ( ) A. 碳酸钙溶于醋酸:CaCO3+2H+ == Ca2++CO2↑ +H2O B. Fe3O4溶于稀盐酸:Fe3O4+8H+ == 3Fe3++4H2 O C. 用烧碱溶液吸收氯气:Cl2+2OH- == Cl-+ClO-+H2O D. 向硫酸亚铁溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+ == Fe3++2H2O 12.下列对反应热的描述中,正确的是( ) A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.3 kJ·mol-1 B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H =-2a kJ·mol-1 C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l) =2H2(g)+O2(g) △H =+571.6 kJ·mol-1 D.HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量为57.3kJ 13.氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液。电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-。据此作出判断,下列说法中不正确的是( ) A.O2在正极发生还原反应 B.反应时负极附近pH增大 C.电池总反应为2H2+O2=2H2O D.氢氧燃料电池属于环境友好电池 14.NA为阿伏加德罗常数的值,下列说法正确的是 ( ) A.常温常压下,1.4gN2和CO的混合气体含有的电子数为0.7NA B.标况下,足量Fe在2.24L氯气中燃烧,反应中转移电子的数目为0.3NA C.1L0.1 mol·L-1 醋酸溶液中含有H+离子的数目为0.1NA D.一定条件下,将2molSO2和1molO2在密闭容器中充分反应,生成SO3的分子数为2 NA 15.已知:4HCl(g)+O2(g) 2C12(g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下: 化学键 H-Cl O=O Cl-Cl H-O E/ kJ·mol-1 431 497 a 465 其中a值为( ) A.242 B.303.5 C.180.5 D.365 16.一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,t=10s时达到化学平衡状态。下列说法正确的是( ) A.该反应的化学方程式为: 2X3Y + Z B.10s时Y的平均速率为0.12 mol·L-1·min-1 C.X的转化率为66.7% D.增大压强,该反应速率一定加快 17.对于反应A2+3B22AB3 以下表示的反应速率中,速率最大的是( ) A.V(A2)=0.4 mol•L-1min-1 B.V(B2)=0.8 mol•L-1min-1 C.V(AB3)=0.6 mol•L-1min-1 D.V(A2)=0.01 mol•L-1S-1 18.某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( ) A.t1时升高了温度 B.t3时加入了催化剂 C.t4时降低了压强 D.在t3~t4时间内,X的体积分数最大 19.为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是( ) A.加入NH4HSO4固体,v(H2)不变,生成H2量不变 B.加入少量水,v(H2)减小,生成H2量减少 C.加入CH3COONa固体,v(H2)减小,生成H2量不变 D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少 20.反应:CaCl2+CO2+H2O =CaCO3↓+2HCl 在任何情况下都不能发生反应,原因是该反应( ) A.△H>0 △S>0 B.△H<0 △S<0 C.△H<0 △S>0 D.△H>0 △S< 0 21.可逆反应2NO2(g)2NO(g)+O2(g)在体积固定的密闭容器中达到平衡状态的标志是( ) ①单位时间内生成nmolO2的同时生成2nmolNO2 ②单位时间内生成nmolO2的同时生成2nmolNO ③用NO2、NO、O2表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态 A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部 22.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( ) 元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.112 0.104 0.066 主要化合价 +2 +3 +2 +6、-2 -2 A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等 23.在一定条件下在固定容积的容器中进行的可逆反应:2M(g)+N(g) Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( ) A.密度增大 B.平均相对分子质量增大 C.总分子数增大 D.平衡逆向移动 24. 已知某可逆反应:mA(g)+nB(g) pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( ) A. T1查看更多