- 2021-08-24 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届河北省承德市联校高二上学期期末考试(2018
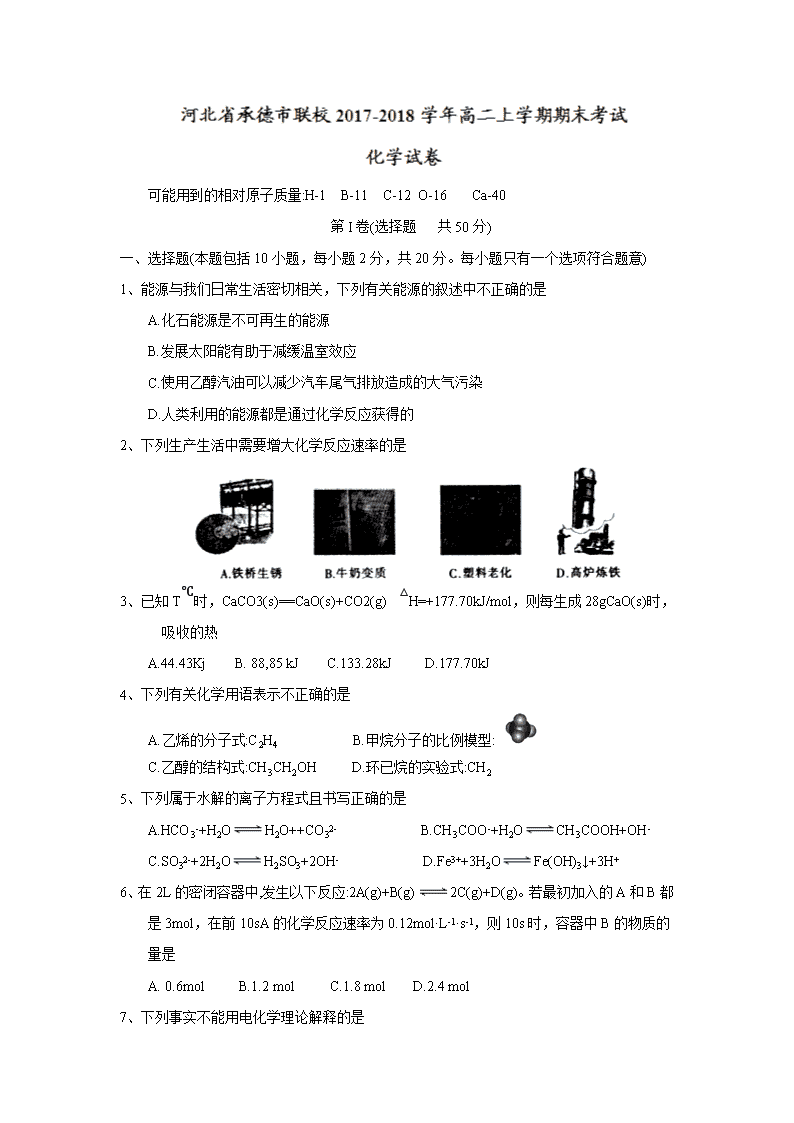
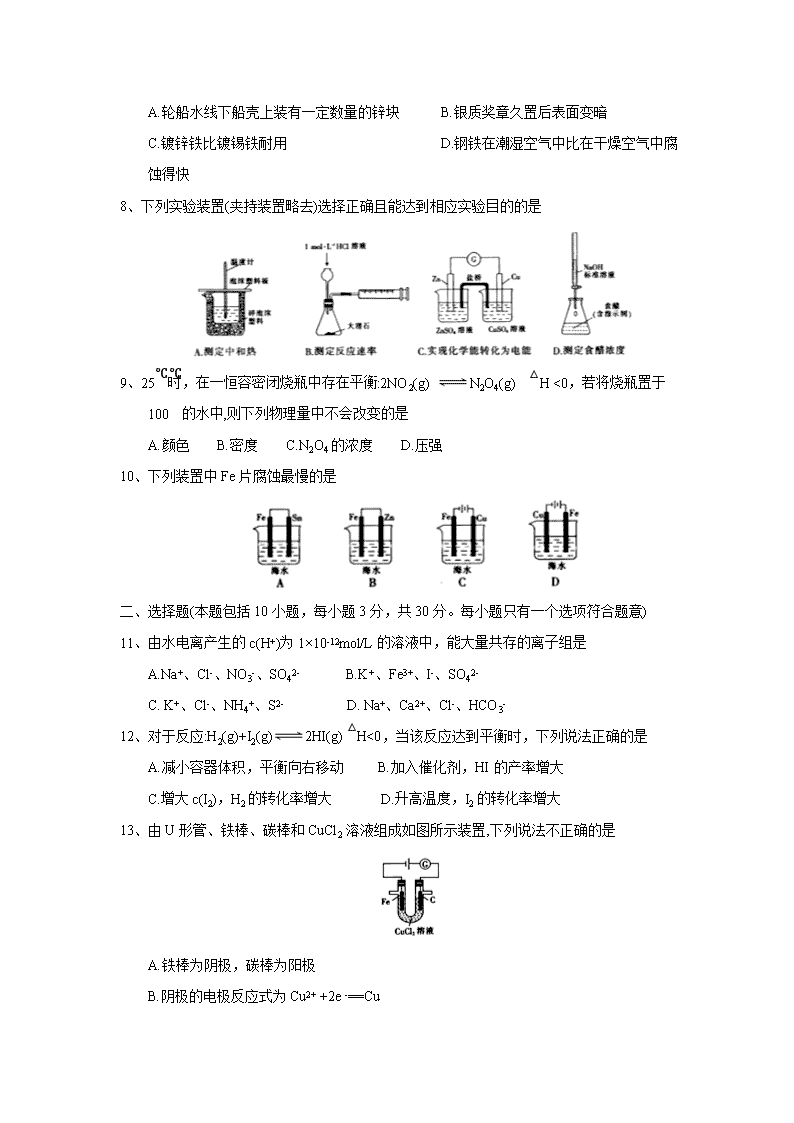
可能用到的相对原子质量:H-1 B-11 C-12 O-16 Ca-40 第I卷(选择题 共50分) 一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意) 1、能源与我们日常生活密切相关,下列有关能源的叙述中不正确的是 A.化石能源是不可再生的能源 B.发展太阳能有助于减缓温室效应 C.使用乙醇汽油可以减少汽车尾气排放造成的大气污染 D.人类利用的能源都是通过化学反应获得的 2、下列生产生活中需要增大化学反应速率的是 3、 已知T℃时,CaCO3(s)==CaO(s)+CO2(g) △H=+177.70kJ/mol,则每生成28gCaO(s)时,吸收的热 A.44.43Kj B. 88,85 kJ C.133.28kJ D.177.70kJ 4、下列有关化学用语表示不正确的是 A.乙烯的分子式:C2H4 B.甲烷分子的比例模型: C.乙醇的结构式:CH3CH2OH D.环已烷的实验式:CH2 5、下列属于水解的离子方程式且书写正确的是 A.HCO3-+H2OH2O++CO32- B.CH3COO-+H2OCH3COOH+OH- C.SO32-+2H2OH2SO3+2OH- D.Fe3++3H2OFe(OH)3↓+3H+ 6、在2L的密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化学反应速率为0.12mol·L-1·s-1,则10s时,容器中B的物质的量是 A. 0.6mol B.1.2 mol C.1.8 mol D.2.4 mol 7、下列事实不能用电化学理论解释的是 A.轮船水线下船壳上装有一定数量的锌块 B.银质奖章久置后表面变暗 C.镀锌铁比镀锡铁耐用 D.钢铁在潮湿空气中比在干燥空气中腐蚀得快 8、下列实验装置(夹持装置略去)选择正确且能达到相应实验目的的是 9、25℃时,在一恒容密闭烧瓶中存在平衡:2NO2(g) N2O4(g) △H <0,若将烧瓶置于100℃的水中,则下列物理量中不会改变的是 A.颜色 B.密度 C.N2O4的浓度 D.压强 10、下列装置中Fe片腐蚀最慢的是 二、选择题(本题包括10小题,每小题3 分,共30分。每小题只有一个选项符合题意) 11、由水电离产生的c(H+)为1×10-12mol/L的溶液中,能大量共存的离子组是 A.Na+、Cl-、NO3-、SO42- B.K+、Fe3+、I-、SO42- C. K+、Cl-、NH4+、S2- D. Na+、Ca2+、Cl-、HCO3- 12、对于反应:H2(g)+I2(g)2HI(g) △H<0,当该反应达到平衡时,下列说法正确的是 A.减小容器体积,平衡向右移动 B.加入催化剂,HI 的产率增大 C.增大c(I2),H2的转化率增大 D.升高温度,I2的转化率增大 13、由U形管、铁棒、碳棒和CuCl2 溶液组成如图所示装置,下列说法不正确的是 A.铁棒为阴极,碳棒为阳极 B.阴极的电极反应式为Cu2+ +2e -==Cu C.转移0.2mol电子时,阳极生成2.24 L气体 D.若将碳棒换成铜棒,可实现在铁棒上镀铜 14、醋酸中存在如下电离平衡:CH3COOHCH3COO-+H+,下列措施可以使c(CH3COOH)/c(H+)的值减小 的是 A.加入水 B.加入少量氢氧化钠固体 C.加入少量冰醋酸 D.加入少量醋酸钠固体 15、反应A(g)+2B(g)==C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是 A 图中虚线表示加入了催化剂 B.图中虚线表示的反应I、反应II均为放热反应 C.加入催化剂,改变了反应历程 D.该反应的焓变△H=(E2-E1) kJ/mol 16、25 ℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是 化学式 HCOOH H2CO3 HCN 电离平衡常数 K=1.8×10-4 K1=4.3×10-7 K2=5.6×10-11 K=4.9×10-10 A.H2CO3 溶液和NaCN 溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN B.HCOOH 的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)] C.Na2CO3 溶液显碱性,NaHCO3 溶液显酸性 D.酸性强弱顺序是HCOOH>HCN>H2CO3 17、乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示。下列说法中不正确的是 A.正极的电极反应式为O2+4e-+2H2O==4OH- B.电池工作时,Na+ 通过阳离子交换膜向右移动 C.转移6 mol 电子理论上消耗乙硼烷的质量为14 g D.消耗1mol B2H6时负极参与反应的n(OH-)为12 mol 18、对于反应;2NO(g)+2CO(g)2CO2(g)+N2 (g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1 时已达到平衡状态的是 19、下列实验现象与结论不一致的是 选项 实验现象 实验操作 结论 A 等体积等浓度的HA 和HB两种酸分别与足量的锌反应,用排水法收集气体 HA放出氢气的反应速率更快 酸性:HB查看更多