2017-2018学年河北省承德二中高二上学期第四次月考化学试题
2017-2018学年河北省承德二中高二上学期第四次月考化学试题
说明:
1.本试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分,考试时间90分钟,满分100分。
2.可能用到的相对原子质量:H-1,O-16,C-12,N-14,Mg-24,Na-23,S-32,K-39,Cl-35.5,Al-27,Cu-64,Fe-56,Zn-65
卷Ⅰ(选择题 60分 )
一 选择题(共30小题,每小题只有1个选项正确,每小题2分)
1.化学与生产、生活与环境密切相关。下列说法错误的是( )
A. 为了防止白色污染应回收废旧塑料并加以焚烧
B. 手机壳上贴的碳纤维膜是一种新型无机非金属材料
C. 当今雾霾天气频发是由于人类活动对自然环境的影响所造成的
D. 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜
2.下列说法正确的是( )
A. 凡是放热反应都是自发的
B. 难溶电解质的溶解平衡是一种动态平衡
C. 利用沉淀反应除杂时,可使杂质离子完全沉淀
D. pH=5的盐酸稀释1000倍后,溶液的pH增到8
3.下列溶液蒸干后,能得到溶质固体的是( )
A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NaClO
4.在相同的温度下,100 mL 0.01 mol·L-1醋酸溶液与10 mL 0.1 mol·L-1醋酸溶液相比较,下列数值中前者大于后者的是( )
A.中和时所需氢氧化钠的物质的量
B.H+的物质的量浓度
C.电离平衡常数K
D.H+的物质的量
5.下列化学用语的书写正确的是( )
A.NaH2PO4的水解:H2PO4-+H2OH3O++HPO42-
B.H2S在水中的电离: H2S2H++S2-
C.Na2SO3的水解:SO32-+H2O HSO3-+OH-
D.CH3COONa在水中的电离:CH3COONa CH3COO- + Na+
6.下列有关实验的说法正确的是( )
A. 测定中和反应反应热实验中,为了充分反应,应将NaOH溶液缓缓倒入盐酸中
B. 配制FeCl3溶液时,将FeCl3晶体溶解在较浓的盐酸中,再加蒸馏水稀释到所需浓度
C. 用盐酸滴定NaOH溶液时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛注视滴定管内液面
D. 检验Fe(NOs)2晶体是否变质时,将Fe(NO3)2样品溶于稀H2SO4后,再滴加KSCN溶液
7.可逆反应aA(g)+bB(g)cC(g)+dD(g)符合下图.则下列叙述正确的是( )
A. a+b<c+d;正反应吸热 B. a+b>c+d;正反应放热
C. a+b<c+d;正反应放热 D. a+b>c+d;正反应吸热
8.通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
工业上高纯硅可通过下列反制取:SiCl4(g) +2H2(g)= Si(g) +4HCl(g),(已知 lmol晶体Si中2molSi -Si键),该反应产生的热量为( )
A. 吸收45kJ• mo1-1 B. 放出412 kJ• mo1-1
C. 吸收 236 kJ• mo1-1 D. 放出236 kJ• mo1-1
9.不管化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1①
C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1②
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1③
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A. (Q1+Q2+Q3) kJ B. [0.5(Q1+Q2+Q3)] kJ
C. (0.5Q1-1.5Q2+0.5Q3) kJ D. (1.5Q1-0.5Q2+0.5Q3) kJ
10.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g) +4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是( )
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大
11.在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
12.已知在一定条件下,2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1 kJ;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2 kJ,则下列关系中正确的是( )
A.Q>Q1>Q2 B.Q1>Q2>Q C.Q1>Q>Q2 D.Q1=Q2>Q
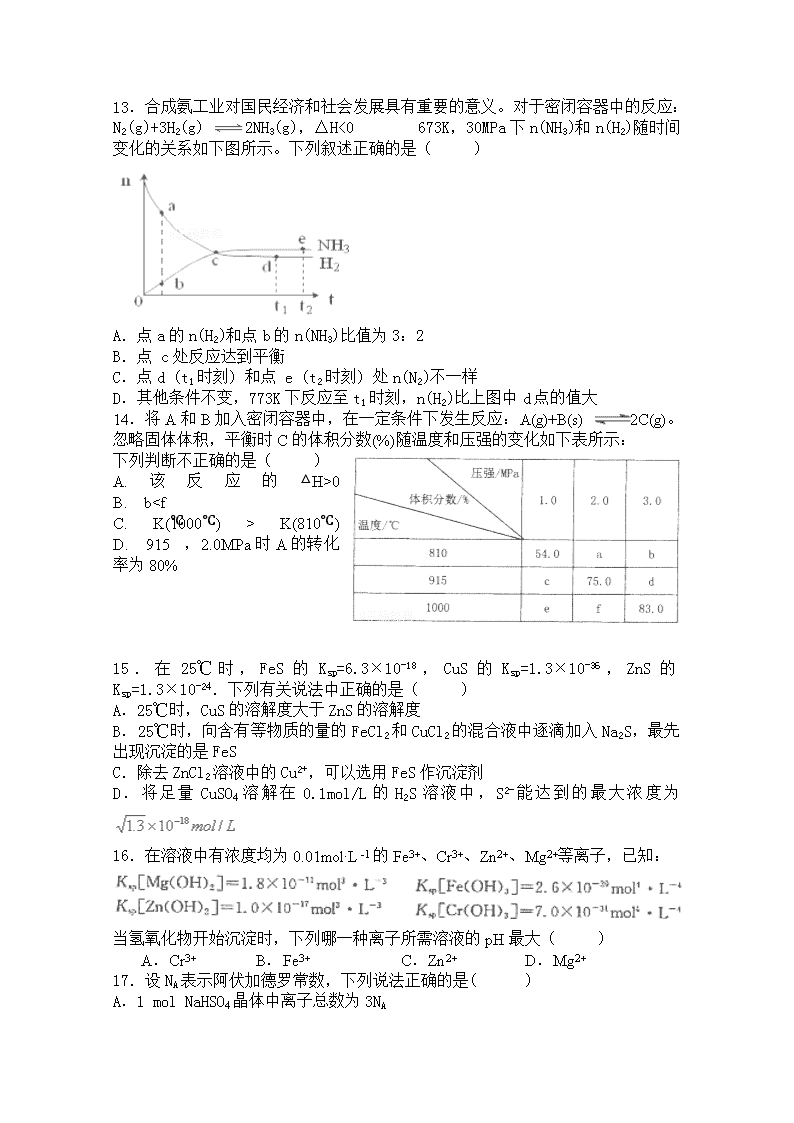
13.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),△H<0 673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
A.点a的n(H2)和点b的n(NH3)比值为3:2
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
14.将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 2C(g)。忽略固体体积,平衡时C的体积分数(%)随温度和压强的变化如下表所示:
下列判断不正确的是( )
A.该反应的△H>0 B. b
K(810℃) D. 915℃,2.0MPa时A的转化率为80%
15.在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24.下列有关说法中正确的是( )
A.25℃时,CuS的溶解度大于ZnS的溶解度
B.25℃时,向含有等物质的量的FeCl2和CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS
C.除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂
D.将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为
16.在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最大( )
A.Cr3+ B.Fe3+ C.Zn2+ D.Mg2+
17.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol NaHSO4晶体中离子总数为3NA
B.2.24 L 14CH4分子中所含中子数为0.8NA
C.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D.常温常压下,16gO2和O3混合气体含有NA个氧原子
18.下列四种溶液均为0.l00mol/L ①NH4Cl ②NH4HSO4 ③NH4Fe(SO4)2 ④NH3 • H2O,下列描述有几项正确( )
A.①②③显酸性,④显碱性
B.c(NH4+):④<①<③<②
C.溶液的pH:①<②<④
D.②溶液中:c (NH4+) +c (H+)=c (SO42-)+c (OH-)
A.1项 B.2项 C.3项 D.4项
19.下列有关沉淀溶解平衡的说法中,正确的是( )
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
20.根据下列实验操作和现象所得出的结论不正确的是( )
选项
实验操作
实验现象
结论
A
向等浓度且较稀的NaCl、KI混合
液中逐滴加入AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
B
向溶液x中滴加浓NaOH溶液,
将湿润红色石蕊试纸置于试管口
试纸变蓝
原溶液中有NH4+
C
向20%蔗糖溶液中加入少量稀
H2SO4,加热;再加入银氨溶液
未出现银镜
蔗糖未水解
D
向某溶液中先加入盐酸酸化,过滤
后加入BaCl2溶液
生成白色沉淀
溶液中一定含有SO42-
A. A B. B C. C D. D
21.下列事实解释准确的是( )
A.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。脱氧过程中铁作原电池正极,电极反应为:Fe-2 e-=Fe2+
B.酸性氢氧燃料电池的正极电极反应为:2H2O+O2+4e-=4OH-
C.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,该反应的△S>0,说明反应△H>0
D.铅蓄电池的正极反应为:PbO2+4H++2 e-=Pb2++2H2O
22.电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
23.生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是( )
A.C1极为电池负极,C2极为电池正极
B.C2极的电极反应式为O2+4H++4e-=2H2O
C.该生物燃料电池的总反应方程式为
C2H5OH+3O2=2CO2+3H2O
D.电池放电过程中电解质溶液的pH不变
24.研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO+2Ag+2NaCl=NaMnO+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl-e=AgCl
B.每生成1 mol NaMnO转移2 mol电子
C.Na不断向“水”电池的负极移动
D.AgCl是还原产物
25.常温下,用0.1000 mol/L盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,滴定曲线如图。关于滴定过程中所得溶液相关微粒的浓度关系,下列说法正确的是( )
A.a点:c(CO32-) >c(HCO3-) >c(Cl-)
B.b点:5c(Cl-)=4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
26.反应NH4HS(s) NH3+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )
①温度、容积不变时,通入SO2气体 ②移走一部分NH4HS固体
③容积不变,充入氮气 ④充入氮气,保持压强不变
A. ①② B. ①③ C. ①②③ D. ②③
27.室温下,下列溶液中粒子浓度大小关系正确的是( )
A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>①
C.0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-
)+c(H2S)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
28.工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质。
下列说法不正确的是( )
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3•H2O中混有Na2CO3•10H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
29.下列说法正确的是( )
A.△H>0的反应,常温下一定不能自发进行
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
C.常温下,在0. 1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.恒容密闭容器中进行的反应3A(g)2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
30.下图所示与对应叙述相符的是( )
A. 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图1可确定首先沉淀的是A-
B. 图2表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应
C. 一定条件下,X和Y反应生成Z,由图3推出该反应的方程式可表示为:X + 3YZ
D. 图4表示溶液中反应:I2 + I-⇌ I3- 平衡c(I3-) 随温度变化,反应速度v(正)M>v(逆)N
卷Ⅱ(非选择题 40分)
二、填空题
31.(18分,每空2分)下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
(1)A极是电源的________,一段时间后,甲中溶液颜色__________。丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明__________________。在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(3)现用丙装置给铜件镀银,则G应该是________ (填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的c(OH-)=0.1mol· L-1(此时乙溶液体积为1000mL),丙中镀件上析出银的质量为________,甲中溶液的pH________ (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是_______________。
32.(6分,每空1分) 某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A H++HA-,HA- H++A2-。已知相同浓度时的电离程度H2A>HA-,设有下列四种溶液:
A.0.01mol/L的H2A溶液;
B.0.01mol/L的NaHA溶液;
C.0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液;
D.0.02mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合液。
据此,填写下列空白(填代号)
(1)c(H+)最大的是 ,最小的是 ;
(2)c(H2A)最大的是 ,最小的是 ;
(3)c(A2-)最大的是 ,最小的是 。
33.(16分,每空2分)氟是一种卤族元素,但它与其他卤素在单质和化合物的制备与性质上存在较明显的差异。
(1)研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在423 K的温度下制备F2的化学方程式:____________________。
(2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
①已知KHF2是一种酸式盐,写出阴极上发生的电极反应式______________。
②电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是____________ 。
③已知25℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。某pH=2的氢氟酸溶液,由水电离出的c(H+)=_________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:__________________。
④已知25℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L0.2 mol/L HF溶液中加入1L0.2 mol/L CaCl2溶液,____________(填“是”、“否”) 有沉淀产生,并通过列式计算说明__________________。
(3)已知 25℃时, Ksp[Fe(OH)3]=4.0×10-38,此温度下,若实验室中配制 2.5 mol/L 100 mLFe2(SO4)3溶液,为使配制过程中不出现浑浊,则至少需要加10 mol/L的硫酸______mL(忽略加入硫酸的体积)。
2016—2017学年度下学期第四次月考答案
一. 选择题部分(60分)
ABCDC BACDC AADDC DDBDC CBDBD DDBCA
二. 非选择题部分(40分)
31.(18分,每空2分)
(1)正极逐渐变浅氢氧化铁胶粒带正电荷
(2)1:2:2:2
(3)镀层金属AgNO310.8g变大
(4)Fe+Cu2+Cu+Fe2+
32.(6分,每空1分)
(1)A D (2)C D (3)D A
33.(16分,每空2分)
(1)2K2MnF6+4SbF54KSbF6+2MnF3+F2↑
(2)①2HF2-+2e-=H2↑+4F-
②氟气和氢气能发生剧烈反应,引发爆炸
③10-12c(Na+)>c(F-)>c(OH-)>c(H+)
④是 c(H+)=c(F-)=6×l0-3mol·L-1,c(Ca2+)=0.lmol·L-1,c(F-)2·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10, 该体系有CaF2 沉淀
(3)0.25