- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省封丘县一中2018-2019学年高二第二次月考化学试卷
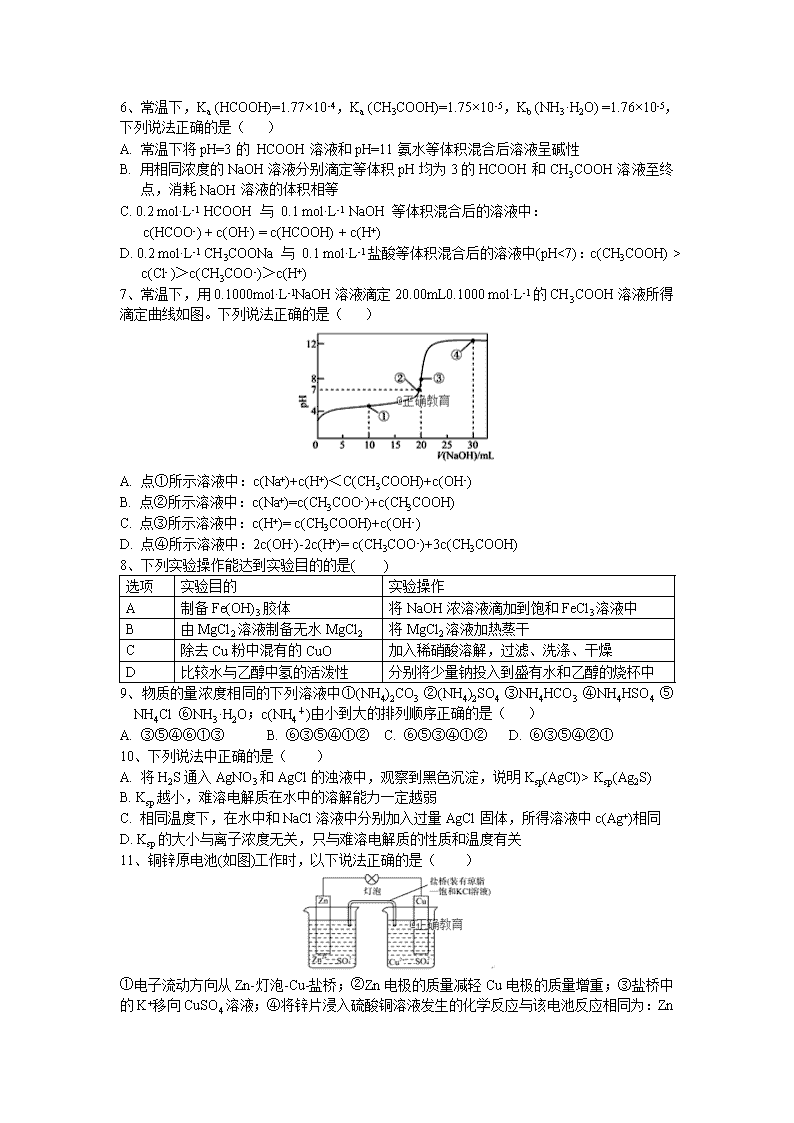
封丘一中高二月考化学试卷 考试时间:90分钟;满分:100分 命题人:李俊英 2018.10 可能用到的相对原子质量:H-1 O-16 一.选择题(每题只有一个正确答案,共48分) 1、常温下,某溶液中由水电离的c(H+)=1×10-13 mol·L-1,该溶液可能是( ) ①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液 A. ①④ B. ①② C. ②③ D. ③④ 2、下列表示碳酸氢钠水解的离子方程式正确的是( ) A. HCO3-+H+=CO2↑+H2O B. HCO3-+OH-=CO32-+H2O C. HCO3-+H2OH2CO3+OH- D. HCO3-+H2O=H3O++CO32- 3、下列事实不能说明HNO2是弱电解质的是( ) A. 常温下NaNO2溶液的pH大于7 B. 0.1 mol·L-1 HNO2溶液稀释至100倍,pH>3 C. HNO2和NaCl不能发生反应 D. 常温下pH=2的HNO2溶液与pH =12的NaOH溶液等体积混合后,溶液的pH小于7 4、常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是( ) A. a=20,b=40,且溶液呈中性处于A、B两点之间 B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH) C. 已知lg3≈0.5,则C点的pH≈5 D. A、B、C三点中,B点溶液中水的电离程度最大 5、在浓度均为0.1 mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随 lg V/V0的变化关系如右图所示。下列叙述正确的是( ) A. a、b两点的溶液中:c(X-)>c(Y-) B. 相同温度下,电离常数K(HX):d>a C. 溶液中水的的电离程度:d>c>b>a D. lgV/V0=2时,若同时微热两种液体(不考虑挥发),则c(X-) /c(Y-) 增大 6、常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( ) A. 常温下将pH=3的 HCOOH溶液和pH=11氨水等体积混合后溶液呈碱性 B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 C. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+) D. 0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COOH) > c(Cl- )>c(CH3COO-)>c(H+) 7、常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1的CH3COOH溶液所得滴定曲线如图。下列说法正确的是( ) A. 点①所示溶液中:c(Na+)+c(H+)<C(CH3COOH)+c(OH-) B. 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) C. 点③所示溶液中:c(H+)= c(CH3COOH)+c(OH-) D. 点④所示溶液中:2c(OH-)-2c(H+)= c(CH3COO-)+3c(CH3COOH) 8、下列实验操作能达到实验目的的是( ) 选项 实验目的 实验操作 A 制备Fe(OH)3胶体 将NaOH浓溶液滴加到饱和FeCl3溶液中 B 由MgCl2溶液制备无水MgCl2 将MgCl2溶液加热蒸干 C 除去Cu粉中混有的CuO 加入稀硝酸溶解,过滤、洗涤、干燥 D 比较水与乙醇中氢的活泼性 分别将少量钠投入到盛有水和乙醇的烧杯中 9、物质的量浓度相同的下列溶液中①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl ⑥NH3·H2O;c(NH4+)由小到大的排列顺序正确的是( ) A. ③⑤④⑥①③ B. ⑥③⑤④①② C. ⑥⑤③④①② D. ⑥③⑤④②① 10、下列说法中正确的是( ) A. 将H2S通入AgNO3和AgCl的浊液中,观察到黑色沉淀,说明Ksp(AgCl)> Ksp(Ag2S) B. Ksp越小,难溶电解质在水中的溶解能力一定越弱 C. 相同温度下,在水中和NaCl溶液中分别加入过量AgCl固体,所得溶液中c(Ag+)相同 D. Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 11、铜锌原电池(如图)工作时,以下说法正确的是( ) ①电子流动方向从Zn-灯泡-Cu-盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④ 将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+=Zn2++Cu;⑤Zn电极失电子发生还原反应 A.①②③ B.②④⑤ C.②③④ D.③④⑤ 12、一种碱性“二甲醚(CH3OCH3)燃料电池”具有启动快、能量密度高、效率高等优点,其电池总反应为: CH3OCH3+3O2+4OH-=2CO32-+5H2O,下列说法不正确的是( ) A. 电池正极可用多孔碳材料制成 B. 电池负极发生的反应为: CH3OCH3-12e-+3H2O=2CO32-+12H+ C. 理论上,1mol二甲醚放电量是1mol甲醇放电量的2倍 D. 电池工作时,OH-向电池负极迁移 13、在一定温度下的定容容器中,当下列哪些项不再发生变化时,表明反应A(g)+2B(g) C(g)+D(g)已达到平衡状态( ) ①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 A. ①②③④⑤⑥⑦⑧ B. ①②③④⑤⑦ C. ①③④⑤ D. ①③④⑤⑧ 14、在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( ) A. E点的v(逆)大于F点的v(正) B. 若在F点时给容器加压,达新平衡时C的浓度将增大 C. 若给容器加热,该反应的平衡常数K将增大 D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变 15、已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1 ; 2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( ) A. +350 B. +130 C. -332 D. -118 16、电解CuCl2溶液的装置如右图所示,下列分析正确的是( ) A.b电极的质量不变 B.a电极是该装置的负极 C.a电极上发生氧化反应 D.电子由b电极经溶液流向a电极 二.填空题(本题包括5个小题,共52分) 17、(8分)I.现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白: (1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。 (2)某学生的操作步骤如下: A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; B.用标准溶液润洗滴定管2~3次; C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液; D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL; E.调节液面至“0”或“0”以下刻度,记下读数; F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。 正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________。 (3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。 (4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。 A.中和滴定达终点时俯视滴定管内液面读数 B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定 C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定 D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡 II.25℃时,若体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合,恰好中和。请回答: ①若a+b=12,则Va: Vb=________。 ②若Va<Vb和a=0.5b,则a的取值范围是_________________。 18、(13分)我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题: (1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。 (2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g)WO2.9(s)+0.1H2O(g) △H1 K1 WO2.9(s)+0.18H2(g)WO2.72(s)+0.18H2O(g) △H2 K2 WO2.72(s)+0.72H2(g)WO2(s)+0.72H2O(g) △H3 K3 WO2(s)+2H2(g)W(s)+2H2O(g) △H4 K4 则该温度下,WO3(s)+3H2(g)W(s)+3H2O(g) △H=_________, K=__________。 (3)T1℃时,将一定质量WO3和8.0g H2置于2 L密闭容器中,发生反应: WO3(s)+3H2(g)W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示: ①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。 ②若在4 min时降低并维持温度为T2℃,则该反应的△H_______0,若在8 min时缩小容 器 容 积,则______1.3。(填“>”“ <”或“=”) 19、(10分)I.活性氧化锌(ZnO)粒径介于1-100 nm之间,是一种面向21世纪的新型高功能精细无机产品,表现出许多特殊的性质。某研究所以粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)为原料,采用湿化学法(NPP-法)制备纳米级活性氧化锌,生产工艺流程如图: 已知:①pH=5.4时,KMnO4的还原产物为MnO2。②该实验条件下氢氧化物沉淀的pH如下表: Fe(OH)2 Fe(OH)3 Cu(OH)2 Zn(OH)2 Mn(OH)2 开始沉淀的pH 7.5 2.2 5.2 6.4 8.6 沉淀完全的pH 9.0 3.2 6.7 8.0 10.1 根据以上信息,回答下列问题: (1)工艺过程中各步骤均用到的分离方法是_______________________________。 (2)“废渣1”的主要成分是_______________________________________。 (3)“反应器2”中两个氧化还原反应的离子方程式为_______________________。 (4) “反应器3”中加入锌粉的作用是________________________________。 (5)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______________。 II.某二元酸(H2A)在水中的电离方程式是H2A=H++HA-; HA-H++A2-。若向0.1mol·L-1的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为______ 20、(11分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: (1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是_____________________。(用离子方程式表示) (2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH等于________。 (3)已知在H2S溶液中存在下列平衡:H2SHS﹣+H+。 ①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向________移动,(填“左”或“右”)c(H+)________。(填“增大”、“减小”或“不变”) ②向H2S溶液中加入NaHS固体时,电离平衡向________移动,(填“左”或“右”)c(S2﹣)________。(填“增大”、“减小”或“不变”) (4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 .则m1________ m2。(选填“<”、“=”、“>”) (5)难溶电解质水溶液中存在溶解平衡, 某MgSO4溶液里c(Mg2+)=0.002mol·L﹣1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________。(该温度下Mg(OH)2的Ksp=2×10﹣11) (6)已知碳酸钙的Ksp=3.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10﹣4 mol·L﹣1,则生成沉淀所需CaCl2溶液最小浓度为 mol·L﹣1 21、(10分)乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值。直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。 熔融盐乙醇燃料电池 酸性乙醇燃料电池 碱性乙醇燃料电池 (1)三种乙醇燃料电池中正极反应物均为____________。 (2)碱性乙醇燃料电池中,电极a上发生的电极反应式为______________________,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是____________。 (3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_______________________,通过质子交换膜的离子是___________。 (4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极____(填“a”或“b”)移动,电极b上发生的电极反应式为_____________________。 化学参考答案 一、单项选择 1-5 ACCAD 6-10 ADDBD 11-16 CBCBBC 二、填空题 17、【答案】Ⅰ. (1) 乙 (2) B 、D 、 C 、 E 、F ; 滴入最后一滴氢氧化钠溶液后,溶液由无色变为粉红色且半分钟内不变色 (3) 20 (4) C Ⅱ. ① 1:100 ; ② <a< 18、【答案】 (1). (2). (3). ①62.5 4.6 ② > = 19、【答案】I.(1) 过滤 (2) Fe(OH)3 (3) MnO4- + 3Fe2+ + 4H+ = 3Fe3+ + MnO2↓+ 2H2O,2MnO4- +3Mn2++2H2O = 5MnO2↓+ 4H+ (4) 除去溶液中Cu2+ (5) K+、SO42- II.c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 20、【答案】(1) 碱性 ; CO32﹣+H2OHCO3﹣+OH﹣ (2) 4 (3) ①右 ; 减小 ; ② 左 ; 增大 (4) B ; < (5) 10 (6) 3.8×10-5 21、【答案】 (1) 氧气 (2) C2H5OH+16OH--12e-=2CO32-+11H2O ; 空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH (3) 3O2+12H+ +12e-=6H2O ; H+ (4) a ; O2+ 2CO2 +4e-=2CO32- 查看更多