- 2021-08-24 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年重庆市九校联盟高二上学期期中考试化学试题 解析版
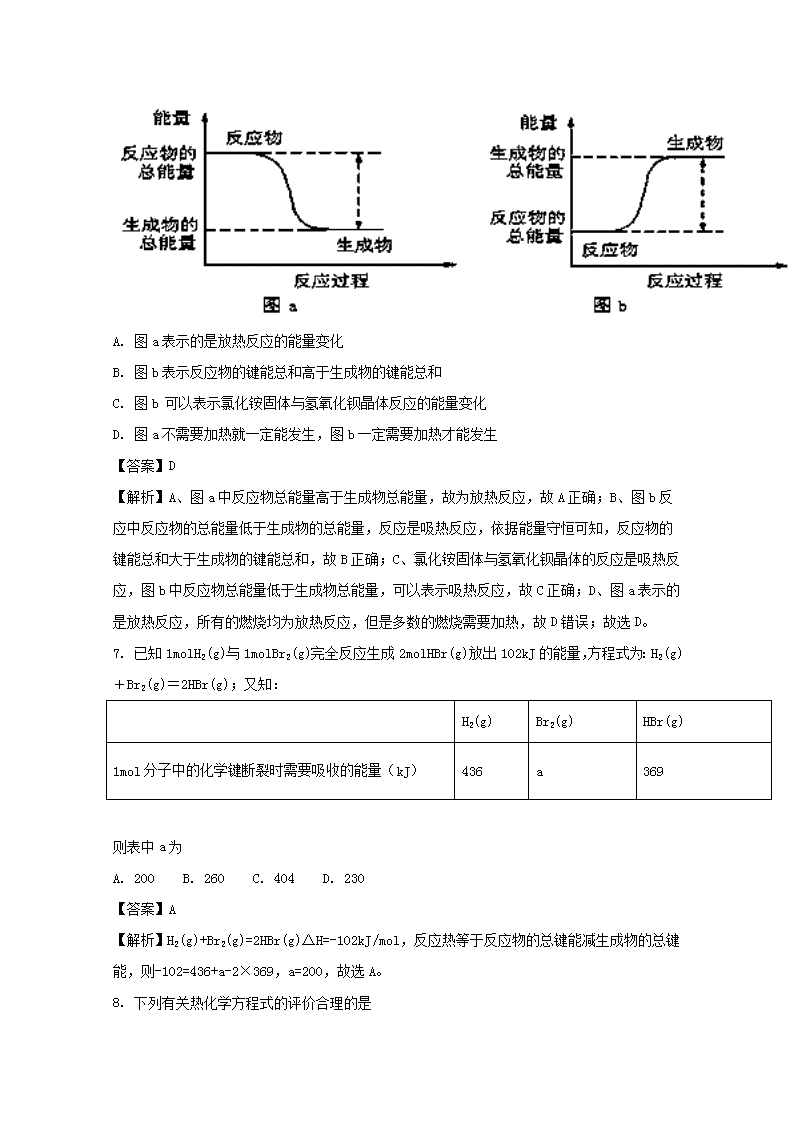
重庆市2017-2018学年高二上学期九校联盟期中考试化学试题 一、选择题(每小题只有一个答案符合题意,每小题3分) 1. 一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是 A. 浓硫酸与水 B. 熟石灰与水 C. 生石灰与水 D. 氯化钠与水 【答案】C 【解析】试题分析:两种化学物质反应,此时便可对食物进行加热,说明该反应是放热反应。A、浓硫酸与水混合放热,但浓硫酸是危险物品,不适于外出携带,A错误; B、熟石灰溶于水放热,但熟石灰的溶解度较小,放出的热量少达不到加热的目的,B错误;C、生石灰与水反应放热,且安全方便携带,C正确;D、氯化钠与水不反应,不产生热量,D错误。 考点:考查了化学反应中的能量变化及其应用的相关知识。 2. 氢气可通过下列反应制得:CO(g)+H2O(g)CO2(g)+H2(g) △H<0,为了提高氢气在平衡体系中所占的比例,可采取的措施是 A. 减小压强 B. 降低温度 C. 更换催化剂 D. 减小CO的浓度 【答案】B 【解析】试题分析:A、根据勒夏特列原理,减小压强,平衡向体积增大方向移动,但此反应方程式中气体系数之和相等,平衡不移动,故错误;B、根据勒夏特列原理,降低温度,平衡向放热反应进行,此反应正反应方向为放热反应,故正确;C、催化剂对化学平衡无影响,故错误;D、减小CO的浓度,平衡向逆反应方向移动,故错误。 考点:考查影响化学平衡移动的因素等知识。 3. 一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)2C(g),下列说法不能说明达到化学平衡状态的是 A. 气体密度不再变化 B. 混合气体的总压强不再变化; C. A、B、C的物质的量之比为1∶3∶2 D. 混合气体的平均相对分子质量不变 【答案】C 【解析】A.气体的密度= ,该反应中,气体的总质量发生变化,体积不变,故气体密度不再变化可作为判断是否达到平衡状态的依据,故A正确;B.反应前后气体的体积不等,故混合气体的总压强不再变化可作为判断是否达到化学平衡状态的依据,故B正确;C.平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故A、B、C的物质的量比为1:3:2不能作为判断是否达到平衡状态的依据,故C错误;D.平均相对分子质量=,气体的总质量发生变化,总物质的量也发生变化,故混合气体的平均相对分子质量不变可作为判断是否达到化学平衡状态的依据,故D正确;故选C。 点睛:化学反应达到化学平衡状态时,正、逆反应速率相等,且不等于0,各物质的浓度不再发生变化。注意本题中A为固体,该反应属于气体总质量和物质的量均发生变化的反应。 4. 实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2 的总量,可向盐酸中加入的物质是 A. CH3 COONa固体 B. NaOH溶液 C. (NH4)2SO4 粉末 D. K2SO4 固体 【答案】A 【解析】试题分析:A、加入醋酸钠,发生:CH3COO-+H+=CH3COOH醋酸是弱酸、盐酸是强酸,c(H+)降低,但总n(H+)不变,故正确;B、NaOH和盐酸发生中和反应,n(H+)减少,氢气的总量减小,故错误;C、硫酸铵属于强酸弱碱盐溶液显酸性,镁可以和酸性溶液反应生成H2,氢气的总量增大,故错误;D、加入硫酸钾粉末,对反应无影响,故错误。 考点:考查影响化学反应速率的因素等知识。 5. 常温下向10mL0.1mol/L氨水中缓缓加蒸馏水稀释到1L后,下列说法不正确的是 A. 电离程度增大,导电能力减弱 B. c(OH- )/c(NH3 ·H2O)增大 C. 溶液中OH- 数目减小 D. Kb (NH3 ·H2O)不变 【答案】C 【解析】A.加水稀释促进电离,所以一水合氨电离程度增大,但溶液中离子浓度减小,则导电性减弱,故A正确;B.加水时电离平衡正向移动,n(OH-)增大,n(NH3•H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则增大,故B正确;C.加水稀释促进一水合氨电离,溶液中OH-数目增多,故C错误;D.温度不变,一水合氨电离平衡常数Kb (NH3 ·H2O)=不变,故D正确;故选C。 6. 如图所示,有关化学反应和能量变化的说法不正确的是 A. 图a表示的是放热反应的能量变化 B. 图b表示反应物的键能总和高于生成物的键能总和 C. 图b 可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 D. 图a不需要加热就一定能发生,图b一定需要加热才能发生 【答案】D 【解析】A、图a中反应物总能量高于生成物总能量,故为放热反应,故A正确;B、图b反应中反应物的总能量低于生成物的总能量,反应是吸热反应,依据能量守恒可知,反应物的键能总和大于生成物的键能总和,故B正确;C、氯化铵固体与氢氧化钡晶体的反应是吸热反应,图b中反应物总能量低于生成物总能量,可以表示吸热反应,故C正确;D、图a表示的是放热反应,所有的燃烧均为放热反应,但是多数的燃烧需要加热,故D错误;故选D。 7. 已知1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)放出102kJ的能量,方程式为:H2(g)+Br2(g)=2HBr(g);又知: H2(g) Br2(g) HBr(g) 1mol分子中的化学键断裂时需要吸收的能量(kJ) 436 a 369 则表中a为 A. 200 B. 260 C. 404 D. 230 【答案】A 【解析】H2(g)+Br2(g)=2HBr(g)△H=-102kJ/mol,反应热等于反应物的总键能减生成物的总键能,则-102=436+a-2×369,a=200,故选A。 8. 下列有关热化学方程式的评价合理的是 实验事实 热化学方程式 评价 A 已知 H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合 H2SO4(aq)+Ba(OH)2(aq) =BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 正确 B 已知25 ℃、101 kPa下,120 g石墨完全燃烧放出热量3935.1kJ C(s)+O2(g) =CO2(g) ΔH=-393.51 kJ·mol-1 不正确; 同素异形体要注名称:C(石墨,s) C 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ SO3(g)+H2O(l) =H2SO4(aq) ΔH=-130.3 kJ·mol-1 不正确;因为反应热为ΔH=-260.6 kJ·mol-1 D 醋酸与稀氢氧化钠溶液混合 CH3COOH(l)+NaOH(aq) =CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 不正确;因为醋酸状态为“aq”,而不是“l” A. A B. B C. C D. D 【答案】B 【解析】A、因SO42-和Ba2+反应生成BaSO4,会伴随能量变化,所以反应热不是-114.6 kJ•mol-1,A错误;B、因C有同素异形体,而同素异形体的能量是不同的,B正确;C、因160 g SO3(2mol)气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ,则1molSO3气体与适量水恰好完全反应生成H2SO4,放出热量130.3 kJ,C错误;D、因醋酸是弱酸,电离时需要吸热,所以反应热大于-57.3k J•mol-1,D错误;答案选B。 9. 下列措施对增大反应速率明显有效的是 A. Na与水反应时增大水的用量 B. Fe与稀硫酸反应制取H2时,改用98%的硫酸 C. Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 D. KSCN与FeCl3两溶液反应时,加入适量NaCl固体 【答案】C 【解析】A、钠和水反应的速率与水的多少无关,故A错误;B、浓硫酸具有强氧化性,和铁即使反应也不产生氢气,生成二氧化硫气体,故B错误;C、将Al片改成Al粉,增大了反应物的接触面积,所以能使反应速率加快,故C正确;D. KSCN与FeCl3两溶液反应时,加入适量NaCl固体,不改变KSCN与FeCl3的浓度,反应速率不变,故D错误;故选C。 10. 下列事实能用勒夏特列原理来解释的是 A. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2OH++Cl-+HClO B. 工业上合成氨反应N2(g)+ 3H2 (g)2NH3(g) △H<0 选择500 ℃ C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)2HI(g) D. SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g)2SO3(g) 【答案】A 【解析】A、氯水中存在氯气的溶解平衡,在饱和食盐水中,氯离子抑制了氯气的溶解,所以能够用勒夏特列原理解释,故A选;B、该反应正反应为放热反应,升高温度到500℃,平衡向逆反应方向移动,反应物转化率与产物的产率降低,选择500℃,主要是考虑反应速率与催化剂的活性,不能用勒夏特列原理,故B不选;C、对于可逆反应H2(g)+I2(g)⇌2HI(g),达到平衡后,加压体系颜色变深,是因浓度变大,但平衡不移动,不能用勒夏特列原理,故C不选;D、使用催化剂可以加快反应速率,不会引起平衡的移动,不能用勒夏特列原理解释,故D不选;故选A。 点睛:注意使用勒夏特列原理的前提必须是可逆反应,明确存在的平衡及平衡移动为解答的关键。本题的易错点为B,合成氨工业中,平衡的移动造成反应物转化率或产物的产率提高,才可以用勒夏特列原理解释。 11. 已知①碳酸钙的分解CaCO3(s)=CaO(s)+CO2(g) ΔH 1 仅在高温下自发进行;②氯酸钾的分解 2KClO3 (s)=2KCl(s)+3O2(g) ΔH 2 , 在任何温度下都自发进行,下面有几组焓变数据,其中可能正确的是 A. ΔH 1 =+178.32 KJ.mol -1 ΔH 2 =-78.3 kJ·mol -1 B. ΔH 1 =-178.32 kJ.mol -1 ΔH 2 =+78.3 kJ·mol -1 C. ΔH 1 =-178.32 kJ.mol -1 ΔH 2 =-78.3 kJ·mol -1 D. ΔH 1 =+178.32 kJ.mol -1 ΔH 2 =+78.3 kJ·mol -1 【答案】A 【解析】根据碳酸钙分解CaCO3(s)═CaO(s)+CO2(g)△H1仅在高温下自发进行,又固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T•△S<0自发,所以△H1 必定大于0;而氯酸钾的分解2KClO3(s)=2KCl(s)+3O2↑(g)△H2在任何温度下都自发进行,固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T•△S<0自发,所以△H2必定小于0;故选A。 点睛:本题考查化学反应进行的方向,能够根据化学方程式准确判断出熵变,然后根据△G=△H-T•△S<0自发,结合温度判断焓变即可。 12. 某温度下,对于反应N2(g)+3H2(g)2NH3 (g)△H=-92.4kJ/mol。N2的平衡转化率α(N2)与体系总压强(P)的关系如下图所示。下列说法正确的是: A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ B. 上述反应在达到平衡后,增大压强,H2 的转化率提高 C. 平衡状态由A变到B时,平衡常数K(A) < K(B) D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 【答案】B 【解析】A、热化学方程式N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol表示1mol氮气(g)与3mol氢气(g)完全反应生成2mol氨气(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,故A错误;B、增大压强平衡向体积减小的方向移动,即向正反应移动,H2的转化率提高,故B正确;C、平衡常数只受温度影响,与压强无关,增大压强平衡常数不变,故平衡常数K(A)=K(B),故C错误;D、升高温度,正、逆反应速率都增大,逆反应速率比正反应速率增大更多,平衡向逆反应方向移动,故D错误;故选B。 13. 对于可逆反应2AB3(g) A2(g) + 3B2(g) ΔH>0,下列图像正确的是 A. A B. B C. C D. D 【答案】B ............... 14. 相同体积的c(H+) =10-2mol·L -1的盐酸溶液和醋酸溶液分别跟等质量的锌充分反应,下列说法错误的是 A. 刚开始时两种溶液中产生H2 的速率相同 B. 若有一种溶液中锌有剩余,则有剩余的是盐酸溶液 C. 若两种溶液中锌均无剩余,则两者产生等量的氢气 D. 若两种溶液中锌均有剩余,则两者产生等量的氢气 【答案】D 【解析】A.反应速率与氢离子浓度成正比,强弱酸中氢离子浓度相等,所以开始反应速率相等,故A正确;B.c(H+)相等、体积相等的强弱酸中,随着反应的进行,弱酸能电离出的氢离子的物质的量大于强酸,所以强酸中反应的锌的质量小于弱酸中锌的质量,则强酸中锌有剩余,故B正确;C.如果两种溶液中锌都无剩余,说明酸不足量,则生成氢气的量与锌的量有关,锌的质量相等则生成氢气的量相等,故C正确;D.如果两种溶液中锌均有剩余,则生成氢气的量与参加反应的氢离子的物质的量成正比,c(H+)相等、体积相等的强弱酸中,随着反应的进行,弱酸能电离出的氢离子大于强酸,所以弱酸产生的氢气多,故D错误;故选D。 点睛:本题以酸和锌的反应为载体考查了弱电解质的电离,根据弱电解质的电离特点结合物质间的反应来分析解答。本题中反应速率与氢离子浓度成正比,与酸的强弱无关,为易错点。解答本题的关键是c(H+)相等、体积相等的强弱酸中,弱酸含有的氢离子的物质的量大于强酸。 15. 在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是 x y w n(起始)/mol 2 l 0 n(平衡)/mol l 0.5 1.5 A. 该温度下,此反应的平衡常数表达式是 B. 升高温度,若w的体积分数减小,则此反应ΔH>0 C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动 D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol 【答案】D 【解析】A.根据表中数据知,随着反应的进行,x、y的物质的量减小,w的物质的量增大,则x和y是反应物而w是生成物,参加反应的△n(x)=(2-1)mol=1mol,△n(y)=(1-0.5)mol=0.5mol,△n(w)=(1.5-0)mol=1.5mol,所以x、y、w的计量数之比=1mol:0.5mol:1.5mol=2:1:3,该反应方程式为2x(g)+y(g)⇌3w(g),化学平衡常数K=,故A错误;B.升高温度,平衡向吸热反应方向移动,升高温度,w的体积分数减小,说明平衡向逆反应方向移动,所以△H<0,故B错误;C.该反应前后气体计量数之和不变,则压强不影响平衡移动,所以若增大压强,正、逆反应速率均增大,但平衡不移动,故C错误;D.反应前后气体的体积不变,则压强对平衡移动没有影响,该温度下,再向容器中通入3molw,达到平衡时等效于加入4molx、2moly,平衡状态相同,各物质的含量相同,则达到平衡时,n(x)=2mol,故D正确;故选D。 点睛:正确判断反应的化学方程式是解本题关键。易错选项是D,注意从等效平衡角度分析,该反应前后气体计量数之和不变,则压强不影响平衡移动,再向容器中通入3molw,达到平衡时等效于加入4molx、2moly。 16. 在容积一定的密闭容器中,置入一定量的一氧化氮和足量的碳发生化学反应:C(s) + 2NO(g)CO2(g) + N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是 A. 该反应的ΔH>0 B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1查看更多