2017-2018学年河北省定州中学高二(承智班)下学期第二次月考化学试题(Word版)
2017-2018学年河北省定州中学高二(承智班)下学期第二次月考化学试卷
一、单选题
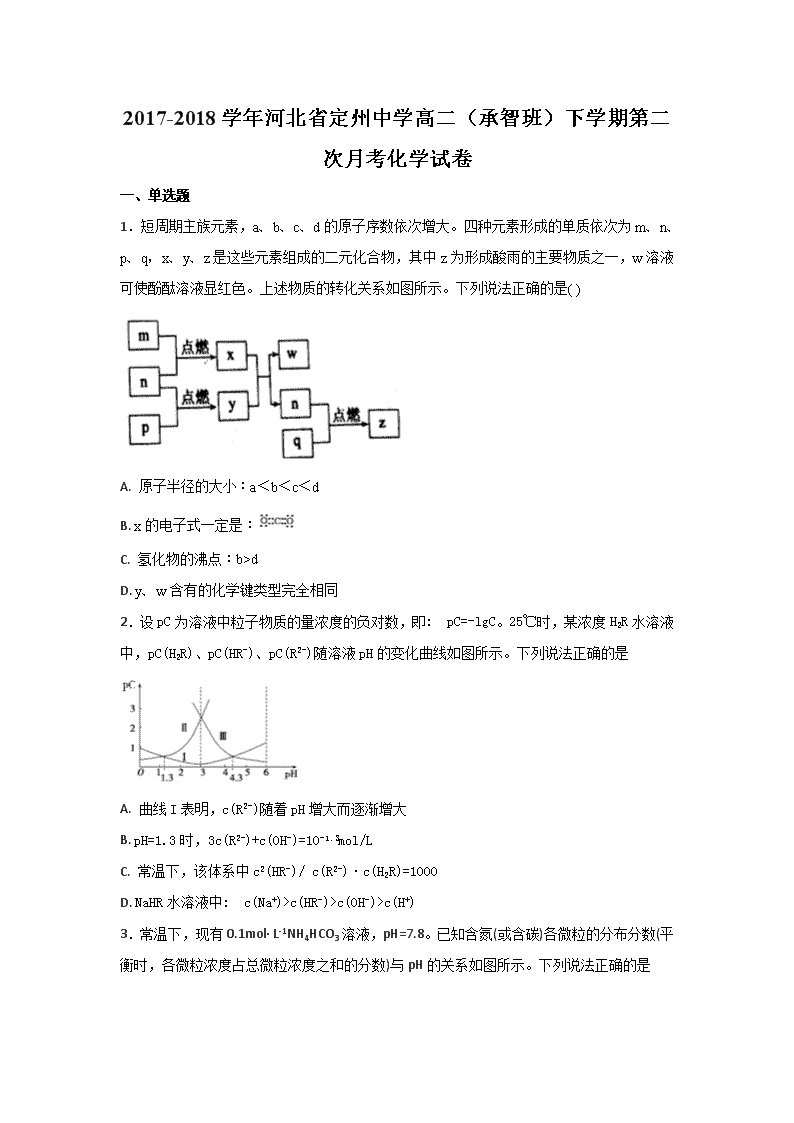
1.短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,w溶液可使酚酞溶液显红色。上述物质的转化关系如图所示。下列说法正确的是( )
A. 原子半径的大小:a<b<c<d
B. x的电子式一定是:
C. 氢化物的沸点:b>d
D. y、w含有的化学键类型完全相同
2.设pC为溶液中粒子物质的量浓度的负对数,即: pC=-lgC。25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。下列说法正确的是
A. 曲线I表明,c(R2-)随着pH增大而逐渐增大
B. pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/L
C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=1000
D. NaHR水溶液中: c(Na+)>c(HR-)>c(OH-)>c(H+)
3.常温下,现有0.1mol· L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH 的关系如图所示。下列说法正确的是
A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c( CO32-)
B. NH4HCO3溶液中存在下列关系:<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
4.用如下装置处理含KMnO4的废液,使Mn元素转化为MnO2沉淀,从而消除重金属污染,下列说法错误的是
A. MnO4-处理完全后,实验结束时左侧可能会生成沉淀
B. 右侧产生的Fe2+沉淀MnO4-的离子方程式为:7H2O+3Fe2++MnO4-=3Fe(OH)3↓+MnO2↓+5H+
C. 当电路中转移6mol e-时,可以产生87gMnO2沉淀
D. 为了增大右侧溶液的导电性可以加稀硫酸造成强酸性环境
5.下列说法错误的是
A. 在NH和[Cu(NH3)4]2+中都存在配位键
B. σ键和π键比例为7:1
C. C与O互为等电子体,1 mol O中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
6.下列物质的结构与性质与氢键无关的是
①乙醚的沸点②冰的密度比液态水小③邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低④水分子在高温下很稳定⑤氢化镁的晶格能高⑥DNA的双螺旋结构⑦尿素的熔沸点比醋酸高
A. ④⑥② B. ①④⑤ C. ②⑤⑥ D.③⑤⑦
7.化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是
(几种稀土元素的电离能(单位:KJ/mol))
元素
I1
I2
I3
I4
A.Se(钪)
633
1235
2389
7019
B.Y(铱)
616
1181
1980
5963
C.La(镧)
538
1067
1850
4819
D.Ce(铈)
527
1047
1949
3547
A. A B. B C. C D. D
8.下列实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
分离Fe2O3、Al2O3
将混合物投入足量NaOH溶液中然后依次进行过滤、洗涤、蒸发、灼烧四项操作
B
验证淀粉溶液水解生成葡萄糖
向淀粉溶液中加入稀硫酸共热,冷却后再加入新制Cu(OH)2悬浊液,加热
C
证明:Ksp(Ag2CrO4)
0; P1> P2 B. 反应速率B点高于D点
C. A、C两点的平衡常数相同 D. M、L两点中,CH3OH的体积分数相同,且p(M)= 2p(L)
12.298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是
A. Se(s)+ H2(g) = H2Se(g) ΔH=-242kJ·mol-1
B. Se(s)+ H2(g) = H2Se(g) ΔH=-20kJ·mol-1
C. Se(g)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
D. Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
13.室温下,下列各组离子在给定条件下一定能大量共存的是
A. 含有大量MnO4-的水溶液中:NH4+、Fe2+、 SO42-、H+
B. 在pH=12的溶液中:ClO-、SO32-、Na+、K+
C. c(H+)=1.0×10-13 mol·L-1溶液中:CH3COO-、K+、SO42-、Br-
D. 能与铝粉反应生成氢气的溶液中:Na+、A13+、CH3COO-、I-
14.喷普洛韦主要用于口唇或面部单纯疱疹,结构简式如图所示,下列说法不正确的是
A. 喷普洛韦的分子式为C10H15N5O3
B. 喷普洛韦能发生取代反应
C. 1mol 该有机物与足量Na反应产生22.4LH2
D. 喷普洛韦分子中所有碳原子不可能都处于同一平面
15.常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是
A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,
D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O
16.下列根据实验现象得出的实验结论正确的是
选项
实验操作
实验现象
实验结论
A
向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸
试纸变为蓝色
NO3-被还原为NH3
B
將Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液
溶液变成红色
Fe(NO3)2样品中一定含有Fe3+
C
向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液中滴入少量AgNO3溶液
产生黑色沉淀
Ksp(Ag2S) > Ksp(Ag2CO3)
D
向KI溶液中加入少量苯,然后加入FeCl3溶液
有机层呈橙红色
还原性Fe2+>I-
A. A B. B C. C D. D
17.常温下,0.1 mol·L−1 H2R溶液中H2R、HR−、R2−三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是
A. Na2R溶液中:c(Na+)=c(HR−)+2c(R2−)
B. H2RH++HR−,Ka1=1.0×10−1.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×10−3.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F−2HF+R2−
18.常温时,1 mol·L−1的HClO2和1 mol·L−1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液稀释后的体积)。下列说法正确的是
A. HClO2的电离方程式:HClO2H++
B. 当稀释至pH=3时,中和等体积的两种酸所用n(NaOH):HClO2>HMnO4
C. 当两溶液均稀释至lg=3时,溶液中c()>c()
D. 等物质的量浓度的NaMnO4和NaClO2溶液中水的电离程度相同
19.25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )
A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
20.下列指定反应的离子方程式正确的是
A. 向Ca(ClO)2溶液中通入少量CO2:2ClO−+CO2+H2O2HClO+
B. 向AgCl悬浊液中加入Na2S溶液,白色沉淀变成黑色:2AgCl+S2−Ag2S+2Cl−
C. 用强碱溶液吸收工业尾气制取硝酸:NO+NO2+2OH−2+H2O
D. 向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氢氧化钠溶液:+Fe2++3OH−NH3·H2O+Fe(OH)2↓
二、实验题
21.硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质。
实验I:探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量同体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。回答下列问题:
(1)Y的电子式为_____________________。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为__________。
实验II:探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。
己知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有_________________________。
(4)B、C装置的位置不能互换的原因是_______________________________________。
(5)D中的反应分两步进行,写出第一步反应的离子方程式_____________________。
三、推断题
22.EPR橡胶()和PC塑料( )的合成路线如下:
(1)A的名称是 ___________。
(2)C的结构简式____________。
(3)下列说法正确的是(选填字母)_______________。
A. 反应Ⅱ的原子利用率为100%
B. 反应Ⅲ为取代反应
C. 1 mol E与足量金属 Na 反应,最多可生成标准状况下22.4 L H2
D. CH3OH在合成PC塑料的过程中可以循环利用
(4)反应Ⅰ的化学方程式是_______________________________。
(5)反应Ⅳ的化学方程式是_______________________________。
(6)已知:
以D和乙酸为起始原料合成无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
参考答案
CCBDB BDDCB BDCCC ABBAB
21. NH4CuSO3 CuO、SO3、SO2、O2、H2O 互换后,SO3溶于品红溶液,BaCl2 溶液无法检出SO3 4Fe2++O2+4H+=4Fe3+ +2H2O
22. 丙烯 ACD