- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江苏省宿迁市高二上学期期末考试 化学 (Word版)
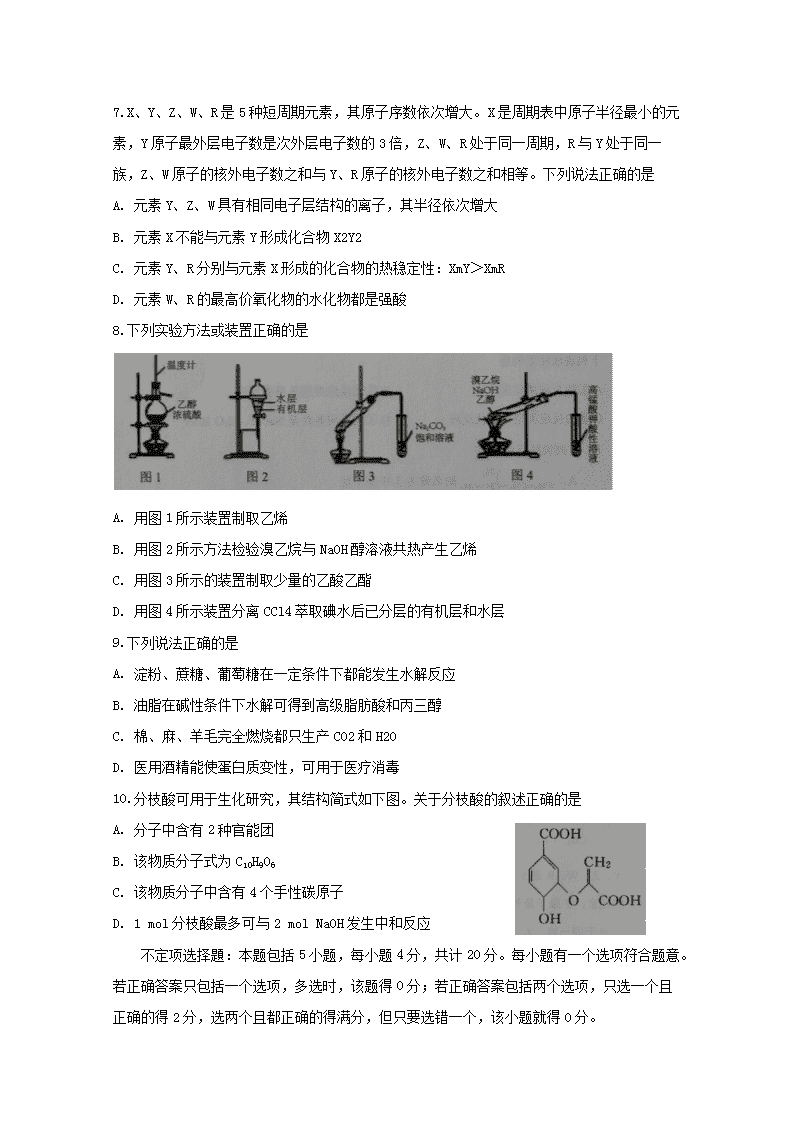
高二年级期末考试 化学 本卷满分:120分;考试时间:100分钟 本卷可能用到的相对原子质量:H-1 C-12 N-14 0-16 Na-23 S-32 Cu-64 第I卷选择题(共50分) 1.化学是你,化学是我,化学深入我们的生活,下列说法正确的是 A. 木材纤维和土豆淀粉遇碘水均显蓝色 B. 食用花生油和鸡蛋清都能发生水解反应 C. 包装用材料聚乙烯和聚氯乙烯都属于烃 D. 医用消毒酒精中乙醇的浓度为90% 2.下列有关化学用语表示正确的是 3.下列官能团名称与对应结构简式书写错误的是 4.下列有机反应类型相同的是 A. 乙烯使溴水褪色;甲苯使酸性高锰酸钾溶液褪色 B. CH4与Cl2反应;苯、浓硫酸和浓硝酸的混合物在55~60 ℃下反应 C. 由丙烯与溴制备1,2-二溴丙烷;由甲苯制TNT炸药 D. 由苯制溴苯;由氯乙烯制聚氯乙烯塑料 5.下列物质分子中所有原子一定全部共面的是 A. 乙烷 B. 甲醛 C. 乙醇 D. 乙酸 6.对下列化合物中氢原子化学环境种数判断不正确的是 7.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 A. 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 B. 元素X不能与元素Y形成化合物X2Y2 C. 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR D. 元素W、R的最高价氧化物的水化物都是强酸 8.下列实验方法或装置正确的是 A. 用图1所示装置制取乙烯 B. 用图2所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯 C. 用图3所示的装置制取少量的乙酸乙酯 D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 9.下列说法正确的是 A. 淀粉、蔗糖、葡萄糖在一定条件下都能发生水解反应 B. 油脂在碱性条件下水解可得到高级脂肪酸和丙三醇 C. 棉、麻、羊毛完全燃烧都只生产CO2和H2O D. 医用酒精能使蛋白质变性,可用于医疗消毒 10.分枝酸可用于生化研究,其结构简式如下图。关于分枝酸的叙述正确的是 A. 分子中含有2种官能团 B. 该物质分子式为C10H9O6 C. 该物质分子中含有4个手性碳原子 D. 1 mol分枝酸最多可与2 mol NaOH发生中和反应 不定项选择題:本题包括5小题,每小题4分,共计20分。每小题有一个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.由环己烷可制得1,2—环己二醇,反应过程如下: 下列说法错误的是 A. ①的反应条件是光照 B. ②的反应类型是消去反应 C. ③的反应类型是取代反应 D. ④的反应条件是NaOH、H2O加热 12.下列说法正确的是 13.化合物Y 能用于低毒性农药合成,可由X在一定条件下制得: 下列有关X、Y 的说法正确的是 A. X 分子中所有原子一定共面 B. 1mol Y最多可与5molH2发生加成反应 C. X可以与NaHCO3溶液反应 D. X→Y的反应为取代反应 14.下列有关实验操作能达到实验目的或得出相应结论的是 15.防腐剂G可经下列反应路线制得,说法正确的是 A. G可以发生取代反应,消去反应 B. 1 mol A与浓溴水反应最多消耗 1 mol Br2 C. 用FeCl3溶液可鉴别化合物D和E D. 反应AB和DE的目的是保护酚羟基不被氧化 非选择题(共70分) 16.(16分)含碳元素的物质是化学世界中最庞大的家族。回答下列问题: (1)CH4中的化学键从形成的过程来看属于___(填“σ”或“π”)键,从其极性来看属于___(填“极性”或“非极性”)键。 (2)CH4和CO2所含的三种元素电负性从小到大的顺序为___。与CH4互为等电子体的阳离子是__;与CO2互为等电子体的阴离子是__ 。 (3)在①CH2=CH2、②HC≡CH、③HCHO三种物质中,其碳原子采取sp2杂化的分子有___(填序号)。 (4)碳有多种同素异形体,其中石墨烯的结构如下左图所示: 在石墨烯晶体中,每个六元环含有___个C原 子,一种铁碳的化合物晶胞如上右图,该化合物的化学式为____。 17.对甲基苯甲醚室温下为无色液体,具有紫罗兰和依兰油的香气。可由对甲基苯酚与甲醇在浓硫酸催化作用下制取,反应装置(部分夹持仪器已略去)如图所示: 可能用的有关数据如表所示: I.合成反应:在图甲烧瓶中先加入几片碎瓷片,再依次加入10.8g 对甲基苯酚、10ml 甲醇,最后加入2ml 浓硫酸,控制反应温度60℃(水浴加热)进行反应。 II.产物提纯:① 将反应液冷却后加入足量饱和碳酸钠溶液,充分反应后转移至分液漏斗中静置分液;②将分液得到的有机层转移至图乙烧瓶中,加热蒸馏,收集产品。 根据以上信息回答下列问题: (1)对甲基苯甲醚结构简式为___; (2)仪器B的名称为_________,向烧瓶中加入几片碎瓷片的目的是__; (3)采用水浴加热的目的是______,加饱和碳酸钠溶液的作用是___; (4)蒸馏收集产品控制的馏分温度大约是___。 18.丙烯是一种重要的化工原料。现以丙烯为原料合成H 和高聚物G (1)H中含氧官能团的名称是___; (2)C→D的反应类型是_____; (3)有机物F的结构简式为_____; (4)由丙烯合成高聚物G的化学方程式为_____; 写出B→C的化学方程式:____。 19.对乙酰氨基酚因解热镇痛作用持久、刺激小、毒性小等优点,已经成为应用广泛的解热镇痛药,是绝大多数复方感冒药成分之一。其结构简式如下: (1)对乙酰氨基酚分子中含氮官能团的名称有___; (2)写出同时满足下列条件的对乙酰氨基酚的一种同分异构体的结构简式:①苯环上连有氨基,②能水解,产物之一能与 FeCl3 溶液发生显色反应,③分子中苯环上有 4 种不同化学环境的氢;___。 (3)对氨基苯酚合成对乙酰胺基的的反应如下: 该步骤中可得到一种分子式为C10H11NO3含有酯基的副产物,该副产物的结构简式为___。 (4)已知: 20.铜是人类发现最早的金属之一,铜及铜的化合物在各个领域发挥着巨大的作用。 (1)基态Cu的外围电子排布式是____。 (2)CuSO4溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液,该物质中N、O、S三种元素的第一电离能由大到小的顺序为____;[Cu(NH3)4]SO4中阴离子的空间构型是___,1mol[Cu(NH3)4]2+ 中含有σ键的数量是___。 (3)新制备的氢氧化铜可将乙醛氧化为乙酸,乙醛中碳原子的杂化轨道类型为__________;乙醛极易溶于水,其主要原因是___。 宿迁市高二年级期末试卷化学参考答案 选择题(1-10每小题3分,11-15每小题4分,共,50分) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 B C C B B A C B D D C C BD A CD 16.(16分,每空2分) (1)σ;极性, (2)H、C、O;NH4+;SCN-(或N3-等) (3)① ③; (4)2 ; FeC 17.(13分,第(3)小题后一空3分,其余每空2分) (1) (2)冷凝管;防止暴沸; (3)使反应液受热均匀(或易控制反应); 除去反应液中的硫酸(3分) (4)174℃ 18. ( 14分,每空2分,方程式4分) (1) 酯基 (2)氧化 (3) (4) 19、(15分) (1)肽键(或酰胺基) (3分) (2) 或 (4分) (3) (3分) (4) (5分) 注:每步1分,全对5分;条件错该步算错,不得分;按步得分,不实行“一步错后面全错”。 20. (12分),每空2分) (1) 3d104s1 ;(2) N>O>S ; 正四面体;16mol(或16×6.02×1023) (3) SP3 SP2,与水分子形成分子间氢键查看更多