- 2021-08-24 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
北京市东城区2020届高三下学期4月第一次模拟新高考适应考试化学试题
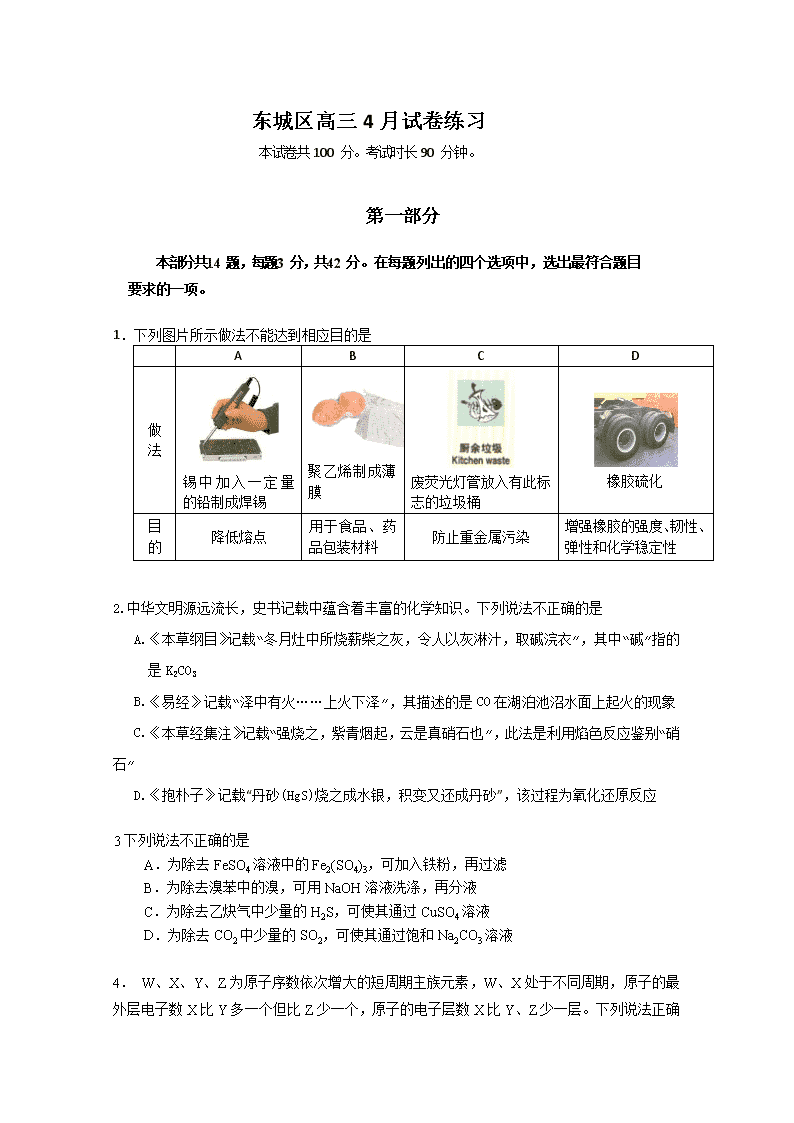
东城区高三4月试卷练习 本试卷共100 分。考试时长90 分钟。 第一部分 本部分共14 题,每题3 分,共42 分。在每题列出的四个选项中,选出最符合题目要求的一项。 1.下列图片所示做法不能达到相应目的是 A B C D 做法 锡中加入一定量的铅制成焊锡 聚乙烯制成薄膜 废荧光灯管放入有此标志的垃圾桶 橡胶硫化 目的 降低熔点 用于食品、药品包装材料 防止重金属污染 增强橡胶的强度、韧性、弹性和化学稳定性 2.中华文明源远流长,史书记载中蕴含着丰富的化学知识。下列说法不正确的是 A.《本草纲目》记载“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中“碱”指的是K2CO3 B.《易经》记载“泽中有火……上火下泽”,其描述的是CO在湖泊池沼水面上起火的现象 C.《本草经集注》记载“强烧之,紫青烟起,云是真硝石也”,此法是利用焰色反应鉴别“硝石” D.《抱朴子》记载“丹砂(HgS)烧之成水银,积变又还成丹砂”,该过程为氧化还原反应 3下列说法不正确的是 A.为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 B.为除去溴苯中的溴,可用NaOH溶液洗涤,再分液 C.为除去乙炔气中少量的H2S,可使其通过CuSO4溶液 D.为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 4. W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个,原子的电子层数X比Y、Z少一层。下列说法正确的是( ) A.原子半径的大小:Z>Y>X>W B.若X的单质为常见的非金属导体,则Y的简单离子能破坏水的电离平衡 C.元素的非金属性:Y>Z D.若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者 5.下列反应的离子方程式正确的是 A.用醋酸除去水垢:CaCO3 +2H+ = Ca2+ + CO2↑+ H2O B.向溶液中加入过量的浓氨水: C.向苯酚钠溶液中通入少量CO2: D.等体积、等浓度的稀溶液与稀溶液混合: 6、设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.22.0 g T2O中含有的中子数为10NA B.7.2 g过氧化钙(CaO2)固体中阴、阳离子总数为0.3NA C.6.2 L NO2溶于足量水中,充分反应后转移的电子数为0.2NA D.标准状况下,2.24 L NO和2.24 L O2混合充分反应后,原子总数是0.4NA 7.反应NH4Cl+NaNO2NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是 A.中子数为18的氯原子: B.N2的结构式:N=N C.Na+的结构示意图: D.H2O的电子式: 8.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是 A.相比现有工业合成氨,该方法条件温和,同时还可提供电能 B.阴极区,在氢化酶作用下发生反应H2+2MV2+2H++2MV+ C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3 D.电池工作时质子通过交换膜由负极区向正极区移动 9 如图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是 NaOH固体 干燥红石蕊试纸 湿润红石蕊试纸 浓硫酸 浓盐酸 氯化物溶液 选项 实验现象 解释 A 浓盐酸附近产生白烟 NH3与浓盐酸反应产生了NH4Cl固体 B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应 C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液 D 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 NH3是一种可溶性碱 10.下列事实不能用平衡移动原理解释的是 H2(g) I2(g) HI(g) A.开启啤酒瓶后,瓶中马上泛起大量泡沫 B.由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 C.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出 D.石灰岩受地下水长期溶蚀形成溶洞 11.在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如 图所示。下列有关说法正确的是 A.a点KW=1.0×10-14 B.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) C.25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示) D.d点水的电离程度最大 12N2(g)+3H2(g) 2NH3(g) 高温、高压 催化剂 .2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如下图所示,下列说法不正确的是 △H = −92 kJ/mol 表示N 表示H 表示催化剂表面 ① ② ③ ④ ⑤ A.升高温度不能提高一段时间内NH3的产率 B.图①→②过程吸热,图②→③过程放热 C.N2在反应过程中三键均发生断裂 D.反应过程中存在−NH−、−NH2等中间产物 13.已知:是碳酸甲乙酯的工业生产原理。下图是投料比[]分别为3︰1和1︰1、反应物的总物质的量相同时,的平衡转化率与温度的关系曲线。下列说法正确的是 A.曲线b所对应的投料比为3︰1 B.M点对应的平衡常数小于Q点 C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58 D.M点和Q点对应的平衡混合气体的总物质的量之比为2︰1 14.工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为: 已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)Cr3+(aq)+3OH—(aq) Ksp=c(Cr3+)·c3(OH—)=10-32 下列有关说法不正确的是 A.步骤①中当v正(CrO42—) = 2v逆(Cr2O72—)时,说明反应: 2CrO42—+2H+Cr2O72—+H2O 达到平衡状态 B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 C.步骤②中,若要还原1 mol Cr2O72—离子,需要12 mol (NH4)2Fe(SO4)2 D.步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+) ≤10-5 mol/L时,可视作该离子沉淀完全) 第二部分 本部分共5 题,共58 分。 15.(15分)PHB树脂可用于制作外科手术缝合线,有机物K是一种抗惊厥药物,它们的合成路线如下: 已知: ① ② ③ + H2O (1)有机物甲的结构简式为 。 (2)写出一定条件下C→D的化学方程式: 。 (3)写出E→F的化学方程式: 。 (4)A的结构简式为 。 (5)已知1 mol J最多与2 mol NaHCO3反应;K分子结构中含有一个五元环与一个六元环。写出一定条件下J→K的化学方程式: 。 (6)S是A的一种同分异构体,分子中没有环状结构,S的核磁共振氢谱有三个峰,峰面积之比为6:3:1,则S的结构简式为 (写出一种即可)。 16.(12分)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: 注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。 (1)“碱溶”时生成偏铝酸钠的离子方程式为___________________________________。 (2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_____(填“增大”、“不变”或“减小”)。 (3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_______________。 (4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为________,阴极产生的物质A的化学式为________。 (5)铝粉在1 000 ℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_________________________________________________。 17.(16分)磷精矿湿法制备磷酸的一种工艺流程如下: 已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。 溶解度:Ca5(PO4)3(OH)查看更多