- 2021-08-24 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019学年高一化学下学期期末考试试题 新版新人教版
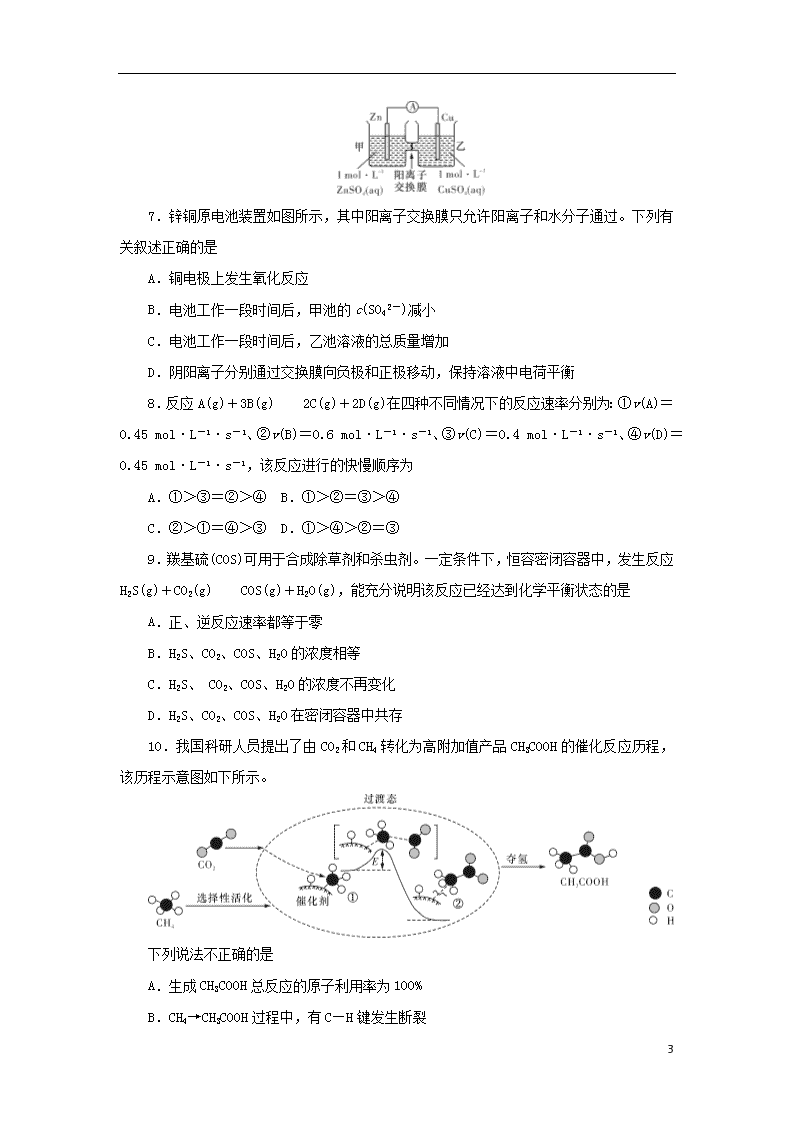
2019学年度高一第二学期期末考试 化 学 时量:60分钟(第Ⅰ卷) 30分钟(第Ⅱ卷) 满分:100分(第Ⅰ卷) 50分(第Ⅱ卷) 得分:____________ 可能用到的相对原子质量:H~1 C~12 O~16 Cu~64 Zn~65 Br~80 Ag~108 第Ⅰ卷 必考部分 一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个正确答案) 1.十九大报告指出:“坚持全民共治、源头防治,坚持实施大气污染防治行动,打赢蓝天保卫战”。下列做法需要提倡的是 A.秸秆就地焚烧,降低运输成本 B.利用廉价煤炭,大力发展火力发电 C.对燃煤进行脱硫,减少SO2对空气的污染 D.加大铅酸蓄电池、含汞锌锰等电池的生产 2.美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是 A.人们用肉眼可以清晰看到“纳米车”的运动 B.“纳米车”诞生说明人类操纵分子的技术进入了一个新阶段 C.C60是一种新型的化合物 D.C60与12C是同位素 16 3.2016年IUPAC命名117号元素为Ts(中文名“”,tin),Ts的原子核外最外层电子数是7。下列说法不正确的是 A.Ts是第七周期第ⅦA族元素 B.Ts的同位素原子具有相同的电子数 C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是117176Ts 4.Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是 X Y Q Z A.Y的原子半径比X的大 B.Q的最高价氧化物的水化物的酸性比Z的强 C.X、Y和氢3种元素形成的化合物中都只有共价键 D.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4 5.下列化学用语表达正确的是 A.Na2O2的电子式:Na+[········]2-Na+ B.Al3+的结构示意图: C.CH3COOCH3的名称:乙酸甲酯 D.用电子式表示氯化氢的形成过程:H·+···―→H+[····]- 6.下列属于吸热反应的是 A.Ba(OH)2·8H2O晶体与NH4Cl晶体反应 B.铝热反应 C.稀硫酸与烧碱反应 D.生石灰与水反应 16 7.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是 A.铜电极上发生氧化反应 B.电池工作一段时间后,甲池的c(SO42-)减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 8.反应A(g)+3B(g)2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为 A.①>③=②>④ B.①>②=③>④ C.②>①=④>③ D.①>④>②=③ 9.羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应H2S(g)+CO2(g)COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是 A.正、逆反应速率都等于零 B.H2S、CO2、COS、H2O的浓度相等 C.H2S、 CO2、COS、H2O的浓度不再变化 D.H2S、CO2、COS、H2O在密闭容器中共存 10.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。 下列说法不正确的是 A.生成CH3COOH总反应的原子利用率为100% B.CH4→CH3COOH过程中,有C—H键发生断裂 16 C.①→②放出能量并形成了C—C键 D.该催化剂可有效提高反应物的平衡转化率 11.四种常见有机物的比例模型如下图所示。下列说法正确的是 A.乙可与溴水发生取代反应而使溴水褪色 B.甲能使酸性KMnO4溶液褪色 C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键 D.丁为醋酸分子的比例模型 12.如图所示为交警在对驾驶员是否饮酒进行检测。其原理是: K2Cr2O7酸性溶液遇呼出的乙醇蒸气迅速反应。下列对乙醇的描述与此测定原理有关的是 ①乙醇沸点低 ②乙醇密度比水小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物 ⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应 A.②⑤ B.②③ C.①③ D.①④ 13.有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下图所示: 下列说法正确的是 A.若反应①的原子利用率为100%,则物质X为CO2 B.可用分液漏斗分离MMA和甲醇 C.、OO均可发生加成反应、氧化反应、取代反应 16 D.MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种 14.“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸是一种天然高分子材料。下列不属于高分子物质的是 A.纤维素 B.植物油 C.聚乙烯 D.蛋白质 15.下列对有机物的描述不正确的是 A.用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯,可以达到水果保鲜的要求 B.淀粉的特征反应是在常温下遇碘化钾溶液变蓝 C.在加热条件下葡萄糖可与新制的氢氧化铜反应,生成砖红色沉淀 D.硝酸可以使蛋白质变黄,称为蛋白质的颜色反应,常用来鉴别部分蛋白质 16.海水开发利用的部分过程如图所示。下列有关说法不正确的是 A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 B.将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2 C.在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂 D.某同学设计了如下装置制取无水MgCl2,装置A的作用是制取干燥的HCl气体 17.实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下: 已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华; 16 Ⅱ.粗碘中含有少量的Na2SO4杂质。 下列说法正确的是 A.操作①和③中的有机相从分液漏斗上端倒出 B.操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42- C.操作④为过滤 D.操作⑤可用如图所示的水浴装置进行 必考部分答题卡 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 得分 答案 二、非选择题(本题包括4小题,共49分) 18.(9分)请根据物质在生产、生活等方面的应用填空。 (1)厨房里常使用小苏打,向其水溶液中滴加酚酞溶液后,溶液呈__________(填字母代号)。 a.浅蓝色 b.浅红色 c.浅绿色 (2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,可用__________溶液(填字母代号)。 a.NaOH b.H2O2 c.KSCN (3)电解氧化铝时加入冰晶石的作用为________________。 (4)完成乙醇发生催化氧化的化学方程式:2CH3CH2OH+O2________________________________________________________________________。 (5)常见的酸性锌锰电池的负极材料为Zn,请写出负极的电极反应式:________________________________。 (6)铝热反应是工业上常用的反应之一,请写出Al与Fe3O4发生铝热反应的化学方程式:____________________________________。 19.(10分)Ⅰ.下面列出了几组物质,请将物质的合适序号填写在空格上。 16 ①金刚石和石墨 ②D和T ③12C和13C ④O2和O3 ⑤CH4和CH3CH2CH3 ⑥CH2===CHCH3和CH2===CH2 ⑦CCH3HCH2CH3CH3和CH3(CH2)3CH3 ⑧CHClHCl和CClHHCl 同系物____________;同分异构体____________。 Ⅱ.篮烷分子的键线式如右图所示,试回答: 篮烷的一氯代物的种数为________种(不考虑立体异构)。 Ⅲ.在一定温度下,体积为2 L的恒容密闭容器中,NO2和N2O4之间发生反应2NO2(g)N2O4(g),如图所示。 (1)曲线____________ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。 (2)该反应达到限度时,Y的转化率是__________,反应开始时与反应达到平衡状态时的压强之比为__________。 20.(14分)H、C、N、O、Na、S是常见的六种元素。请回答下列问题。 (1)S在元素周期表中的位置为______________。 (2)上述元素中非金属性最强的是______________(填元素符号)。 (3)下列事实能说明O的非金属性比S的非金属性强的是________(填字母代号)。 a.O2与H2S溶液反应,溶液变浑浊 b.加热条件下H2S比H2O更容易分解 c.在氧化还原反应中,1 mol O2比1 mol S得电子多 d.H2O的沸点比H2S高 (4)一定条件下,Na还原CCl4可得到金刚石与一种可溶性盐,该反应的化学方程式为________________________________。 (5)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。 16 ①已知肼的球棍模型如图1所示,试写出肼的电子式:______________。 ②目前正在研发的一种肼燃料电池的结构如图2所示,________(填“a”或“b”)电极为电池的负极。 ③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应N2H4(l)N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________。 21.(16分)实验室制备1,2-二溴乙烷的反应原理如下所示: 第一步:CH3CH2OHCH2===CH2+H2O; 第二步:乙烯与溴水反应得到1,2-二溴乙烷。 可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出): 有关数据列表如下: 乙醇 1,2-二溴乙烷 乙醚 状态 无色液体 无色液体 无色液体 密度/(g/cm3) 0.79 2.2 0.71 沸点/(℃) 78.5 132 34.6 熔点/(℃) -130 9 -116 请回答下列问题: 16 (1)写出乙烯与溴水反应的化学方程式:________________________________________________________________________。 (2)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是____________(填字母代号)。 a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成 (3)装置B的作用是__________________。 (4)在装置C中应加入____________(填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。 a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液 (5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________(填“上”或“下”)层。 (6)若产物中有少量未反应的Br2,最好用________(填字母代号)洗涤除去。 a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 (7)若产物中有少量副产物乙醚,可用__________的方法除去。 (8)判断该制备反应已经结束的最简单方法是________________________________________________________________________。 第Ⅱ卷 选考部分 一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个正确答案) 1.下列六个说法中,正确的有 ①已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为ΔH=-241.8 kJ·mol-1 ②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 ③X(g)+Y(g)Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大 ④已知: 共价键 C—C C===C C—H H—H 键能/(kJ·mol-1) 348 610 413 436 16 根据上表数据可以计算出CH3(g)+3H2(g)―→CH3(g)的焓变 ⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等 ⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热 A.1个 B.2个 C.3个 D.4个 2.已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)===2CO(g) ΔH2 2CO(g)+O2(g)===2CO2(g) ΔH3 2Cu(s)+O2(g)===2CuO(s) ΔH4 CO(g)+CuO(s)===CO2(g)+Cu(s) ΔH5 下列关于上述反应焓变的判断正确的是 A.ΔH1>0,ΔH3<0 B.ΔH2<0,ΔH4>0 C.ΔH2=ΔH1-ΔH3 D.ΔH5=ΔH4+ΔH1 3.在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为 实验编号 1 2 3 4 5 6 c(HI)/(mol·L-1) 0.100 0.200 0.150 0.100 ? 0.500 c(H2O2)/(mol·L-1) 0.100 0.100 0.150 0.200 ? 0.400 v/(mol·L-1·s-1) 0.007 60 0.015 2 0.017 1 0.015 2 0.022 8 0.152 A.0.150 mol·L-1、0.200 mol·L-1 B.0.300 mol·L-1、0.100 mol·L-1 C.0.200 mol·L-1、0.200 mol·L-1 D.0.100 mol·L-1、0.300 mol·L-1 4.苯可被臭氧分解,发生化学反应 3OHOH,二甲苯通过上述反应可能的产物为OH3COCH3a、OHOCH3b、OHOHc,若邻二甲苯(CH3CH3)进行上述反应,对其反应产物描述正确的是 16 A.产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶3 B.产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶1 C.产物为a和c,其分子个数比为a∶c=1∶2 D.产物为b和c,其分子个数比为b∶c=2∶1 5.我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下所示。 下列说法不正确的是 A.过程i发生了加成反应 B.中间产物M的结构简式为CH3CHO C.利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯 D.该合成路线理论上碳原子100%利用,最终得到的产物易分离 选考部分答题卡 题号 1 2 3 4 5 得分 答案 二、非选择题(本题包括4小题,共35分) 6.(6分)Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH溶液中加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80 ℃,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得固体样品。反应方程式为2AgNO3+4KOH+K2S2O8Ag2O2↓+2KNO3+2K2SO4+2H2O。 请回答下列问题: (1)上述制备过程中,检验洗涤是否完全的方法是__________________________。 (2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应的化学方程式:______________________________。 (3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O)2.588 g 16 ,在一定的条件下完全分解为Ag和O2,得到224.0 mL O2(标准状况下)。计算样品中Ag2O2的质量分数__________(用百分数表示,计算结果精确到小数点后1位)。 7.(11分)硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。 已知:Na2S、Na2CO3、Na2SO3、NaHCO3溶液呈碱性;NaHSO3溶液呈酸性。 (1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填字母代号)。 (2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现: ①浅黄色沉淀先逐渐增多,反应的化学方程式为________________________________________________; ②当浅黄色沉淀不再增多时,反应体系中有无色无味的气体产生,反应的化学方程式为________________________________; ③浅黄色沉淀逐渐减少(这时有Na2S2O3生成); ④继续通入过量的SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为________________________。 (3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是________________。 8.(8分)ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。 16 已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。 ②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。 金属离子 Fe3+ Al3+ ZrO2+ 开始沉淀时pH 1.9 3.3 6.2 沉淀完全时pH 3.2 5.2 8.0 (1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。 (2)“滤渣Ⅰ”的化学式为________________。 (3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。 (4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。 9.(10分)2018年俄罗斯世界杯官方比赛用球,新足球名为“Telstar 18(电视之星18)”,脱胎于1970年世界杯上经典的“电视之星 (Telstar)”。为了契合本次世界杯的环保主题,Telstar 18选用了具有较高环保性能的高科技材料——三元乙丙橡胶(EPDM)。 化合物A是合成三元乙丙橡胶的重要中间体,可由B(C5H6)和C经Diels-Alder反应制得。已知最简单的Diels-Alder反应是+,完成下列填空。 (1)写出由B和C合成A的化学方程式:________________________________________________________________________, 该反应属于________(填反应类型)。 (2)写出与 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式:________________________。 分别写出生成这两种一溴代物所需要的反应试剂和反应条件①______________; ②______________________。 (3)已知:① CH3COONa+NaOHCH4↑+Na2CO3; ②CH3COOH; 16 ③COOHCHO+BrCH3CH3CHO。 利用所给信息,写出实验室由CH3制备的合成路线。(合成路线常用的表示方式为:AB……目标产物) 16 湖南师大附中2017-2018学年度高一第二学期期末考试化学参考答案 湖南师大附中2017—2018学年度高一第二学期期末考试 化学参考答案 第Ⅰ卷 必考部分 一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个正确答案) 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 答案 C B D D C A C D C D C C C B B C D 二、非选择题(本题包括4小题,共49分) 18.(9分)(1)b(1分) (2)c(1分) (3)降低氧化铝的熔点(1分) (4)2CH3CHO+2H2O(2分) (5)Zn-2e-===Zn2+(2分) (6)8Al+3Fe3O44Al2O3+9Fe(2分) 19.(10分)Ⅰ.⑤⑥(1分) ⑦(1分) Ⅱ.4(2分) Ⅲ.(1)Y(2分) (2)60%(2分) 14∶11(2分) 20.(14分,每空2分)(1)第三周期第ⅥA族 (2)O (3)ab (4)CCl4+4Na4NaCl+C(金刚石) (5)①H··H ··H ··H ②a ③0.012 5 mol·L-1·min-1 21.(16分,每空2分)(1)CH2===CH2+Br2―→CH2BrCH2Br (2)d (3)安全瓶的作用 (4)c (5)下 (6)b (7)蒸馏 (8)溴的颜色完全褪去 第Ⅱ卷 选考部分 一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个正确答案) 题号 1 2 3 4 5 答案 A C C A C 二、非选择题(本题包括4小题,共35分) 6.(6分,每空2分)(1)取少许最后一次洗涤液的滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全 (2)Ag2O2+2Zn+4KOH+2H2O===2K2Zn(OH)4+2Ag (3)91.0% 16 7.(11分)(1)d(1分) (2)①3SO2+2Na2S===3S↓+2Na2SO3(2分) ②SO2+Na2CO3===Na2SO3+CO2(2分) ④Na2S2O3+SO2+H2O===S↓+2NaHSO3(2分) (3)2∶1(2分) Na2S溶液(2分) 8.(8分)(1)ZrSiO4+4NaOHNa2SiO3+Na2ZrO3+2H2O(2分) (2)H2SiO3 (或H4SiO4) (1分) (3)5.2~6.2(1分) ZrO2++2NH3·H2O+H2O===Zr(OH)4↓+2NH4+(2分) (4)2NH4++CaCO3Ca2++2NH3↑+CO2↑+H2O(2分) 9.(10分)(1) (2分) 加成反应(1分) (2)(2分) ①Br2/光照 (1分) ②Br2/Fe(或Br2/FeBr3)(1分)(后两空答案顺序可颠倒) (3)(3分) 16查看更多