- 2021-08-24 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高二化学下学期第四次统考试题(无答案)新版新目标
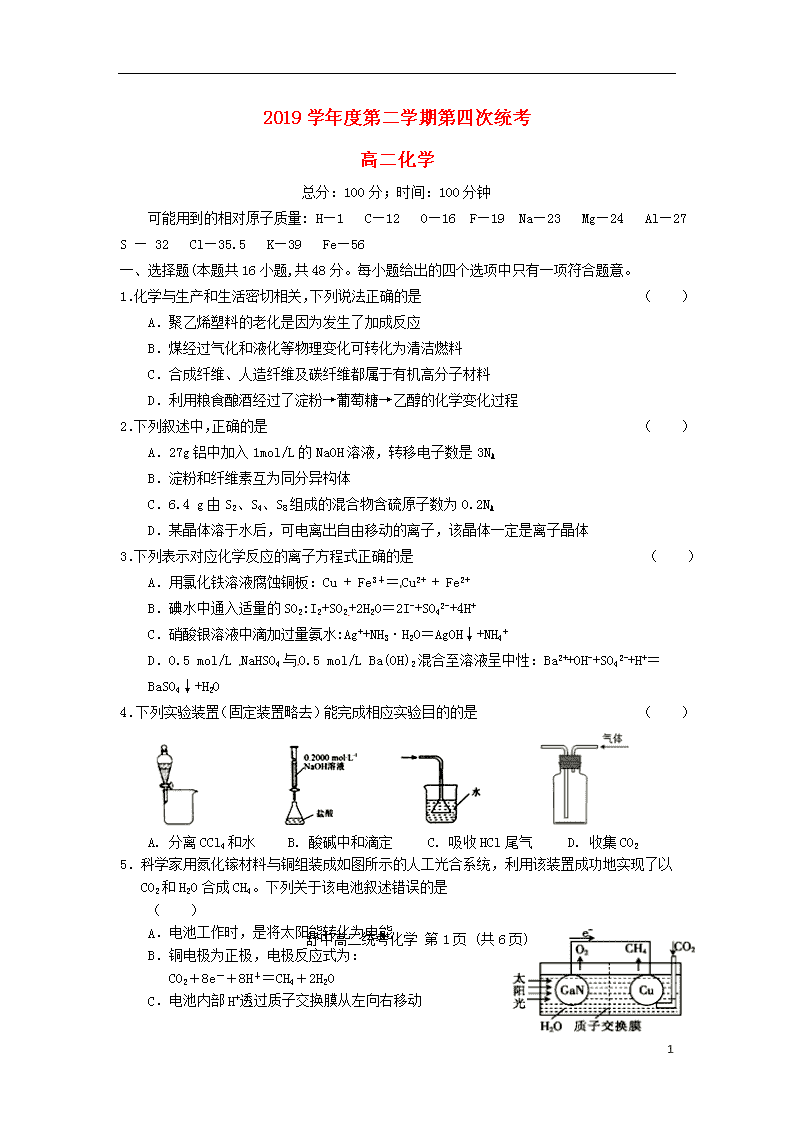
2019学年度第二学期第四次统考 高二化学 总分:100分;时间:100分钟 可能用到的相对原子质量: H—1 C—12 O—16 F—19 Na—23 Mg—24 Al—27 S — 32 Cl—35.5 K—39 Fe—56 一、选择题(本题共16小题,共48分。每小题给出的四个选项中只有一项符合题意。 1.化学与生产和生活密切相关,下列说法正确的是 ( ) A.聚乙烯塑料的老化是因为发生了加成反应 B.煤经过气化和液化等物理变化可转化为清洁燃料 C.合成纤维、人造纤维及碳纤维都属于有机高分子材料 D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 2.下列叙述中,正确的是 ( ) A.27g铝中加入1mol/L的NaOH溶液,转移电子数是3NA B.淀粉和纤维素互为同分异构体 C.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 3.下列表示对应化学反应的离子方程式正确的是 ( ) A.用氯化铁溶液腐蚀铜板:Cu + Fe3+=Cu2+ + Fe2+ B.碘水中通入适量的SO2:I2+SO2+2H2O=2I-+SO42-+4H+ C.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ D.0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+=BaSO4↓+H2O 4.下列实验装置(固定装置略去)能完成相应实验目的的是 ( ) A. 分离CCl4和水 B. 酸碱中和滴定 C. 吸收HCl尾气 D. 收集CO2 舒中高二统考化学 第1页 (共6页) 5.科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH 4。下列关于该电池叙述错误的是 ( ) A.电池工作时,是将太阳能转化为电能 B.铜电极为正极,电极反应式为: CO2+8e-+8H+=CH4+2H2O C.电池内部H+透过质子交换膜从左向右移动 6 D.为提高该人工光合系统的工作效率,可向装 置中加入少量硝酸溶液 6.在某透明碱性溶液中能大量共存的一组离子是 ( ) A. NH4+ 、SO42- 、Fe3+ 、NO3- B. Na+ 、Al3+ 、HCO3- 、NO3- C. Na+ 、Ca2+ 、NO3- 、CO32- D. K+、Ag(NH3)2+、Cl-、NO3- 7.下列有关说法不正确的是 ( ) A.SO42-的空间构型是正四面体形 B.CS2分子中各原子均达8电子稳定结构 C.CH3COOH分子中碳原子的杂化类型有sp2和sp3两种 D.H2O2分子是既含极性键又含非极性键的非极性分子 8.化学学习中常用类推方法,下列类推正确的是 ( ) A. CO2为直线形分子,SO2也为直线形分子 B. 固态CS2是分子晶体,固态SiO2也是分子晶体 C. NCl3中N原子是sp3杂化,BCl3中B原子也是sp3杂化 D. Al(OH)3能溶于NaOH溶液,Be(OH)2也能溶于NaOH溶液 9.实验室可利用反应NaNO2+NH4ClNaCl+N2↑+2H2O ΔH<0 制备N2,下列说法正确的是 ( ) A.NaNO2 为还原剂,发生还原反应 B.氧化产物和还原产物物质的量比值为1∶1 C.该反应化学能全部转化为热能 D.每生成1 mol N2转移电子的物质的量为6 mol 10.在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是 ( ) 舒中高二统考化学 第2页 (共6页) A. H2R是二元弱酸,其Ka1=1×10-2 B. NaHR在溶液中水解程度小于电离程度 C. pH<7.2的溶液中一定存在:c( Na+)>c( HR-) > c(R2- )>c(H+)>c(OH-) D. 含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 11.常温下,下列说法不正确的是 ( ) A. 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 B. 相同pH 的 CH3COONa、NaOH 和 Na2CO3三种溶液:c(NaOH)查看更多