- 2021-08-24 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年吉林省实验中学高二下学期期末考试化学试题 Word版
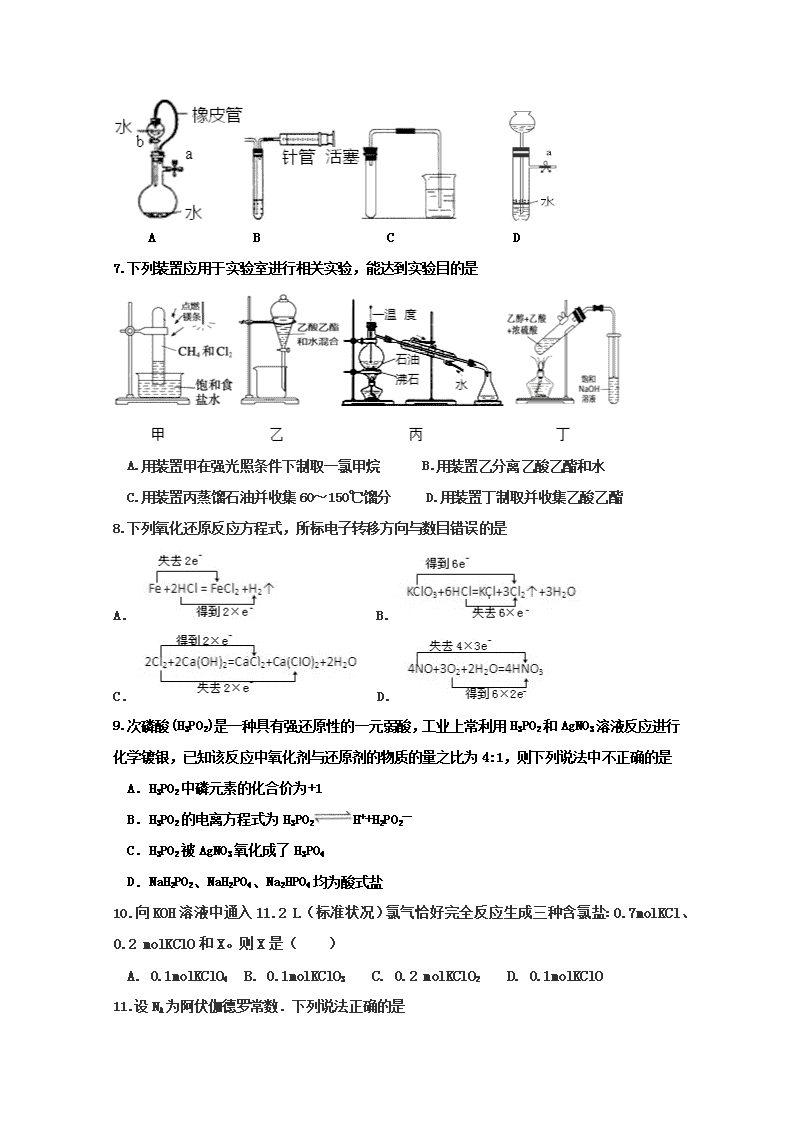
吉林省实验中学2017---2018学年度下学期 高二年级化学学科期末考试试题 可能用到的相对原子质量 C:12 O:16 Ag:108 Cl:35.5 H:1 Al:27 Na:23 N:14 Fe:56 一. 选择题(1-10题,每题2分;11-20题,每题3分,共50分) 1.下列有关概念和原理的说法正确的是 A.酸和碱反应只能生成盐和水 B.由14N和中子在宇宙射线影响下形成12C 为化学变化: 14N+1n→ 12C+ 3H C.金属主要发生吸氧腐蚀,其本质是被氧化 D.Na2O2的水溶液能导电,所以Na2O2是电解质 2.下列有关物质的分类或归类正确的一组是 ①化合物:CaCl2 NaOH HCl HD ②混合物:盐酸 漂白粉 水玻璃 水银 ③同素异形体:C60 金刚石 石墨 ④电解质:氯化铵 硫酸钡 冰醋酸 A.①② B.①③ C.②③ D.③④ 3.化学是一门实用性强的自然科学,下列说法不正确的是 A.油条的制作口诀 “一碱二矾三盐”,其中“碱”为烧碱 B.黑火药的最优配方是“一硫二硝三木炭”,其中的“硝”是硝酸钾 C.过滤操作要领是一贴二低三靠,其中“贴”是指滤纸紧贴漏斗的内壁 D.“固体药匙或纸槽,一送二竖三弹掉,块固还是镊子好,一横二放三慢竖”,前一个“固体”一般指粉末状固体 4.我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离 A.苯和水 B.乙酸乙酯和乙酸 C.食盐水和泥沙 D.硝酸钾和硫酸钠 5.下列实验基本操作或对事故的处理方法不正确的是 A.给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 B.发现实验室中有大量的可燃性气体泄漏时,应立即开窗通风 C.酒精灯内的酒精不能超过酒精灯容积的2/3 D.测试某溶液的pH时,先用水润湿pH试纸,再将待测液滴到pH试纸上 6.对下列装置,不添加其他仪器无法检查装置气密性的是 A B C D 7.下列装置应用于实验室进行相关实验,能达到实验目的是 A.用装置甲在强光照条件下制取一氯甲烷 B.用装置乙分离乙酸乙酯和水 C.用装置丙蒸馏石油并收集60~150℃馏分 D.用装置丁制取并收集乙酸乙酯 8.下列氧化还原反应方程式,所标电子转移方向与数目错误的是 A. B. C.D. 9.次磷酸(H3PO2)是一种具有强还原性的一元弱酸,工业上常利用H3PO2和AgNO3溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中不正确的是 A.H3PO2中磷元素的化合价为+1 B.H3PO2的电离方程式为H3PO2H++H2PO2— C.H3PO2被AgNO3氧化成了H3PO4[] D.NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐 10.向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐:0.7molKCl、0.2 molKClO和X。则X是( ) A. 0.1molKClO4 B. 0.1molKClO3 C. 0.2 molKClO2 D. 0.1molKClO 11.设NA为阿伏伽德罗常数.下列说法正确的是 A. 28.6g Na2CO3•10H2O晶体中CO32-数目等于0.1NA B. 标准状况下,4.48LNO和2.24LO2完全反应后,容器内气体分子数为0.2NA C. 0.1molNa和氧气在一定条件下反应生成3.5g氧化物时,失去的电子数为0.2NA D. 含有1molFeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA 12.常温下,下列各组离子在指定溶液中一定能大量共存的是 A. 常温下加水稀释时c(H+)/c(OH-)明显增大的溶液:CH3COO-、Ba2+、NO3-、Br- B. pH=1的溶液中:Na+、SiO32-、NO3-、SO42- C. 由水电离的c(OH-)=10-13 mol•L-1的溶液中:Na+、Cl-、CO32-、NO3- D. 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- 13.类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是 已知 类推 A 将Fe加入CuSO4溶液中: Fe+Cu2+=Cu+Fe2+ 将Na加入到CuSO4溶液中: 2Na+Cu2+=Cu+2Na+ B 稀硫酸与Ba(OH)2溶液反应至中性: 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O C 钠和水反应:2Na+2H2O=2Na++2OH-+H2↑ 钠和盐酸反应:2Na+2H2O=2Na++2OH-+H2↑ D 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO 14.用下面的方案进行某些离子的检验,其中方案设计严密的是 A. 检验试液中的SO42-:试液无沉淀白色沉淀 B. 检验试液中的SO32-:试液气体褪色 C. 检验试液中的I-:试液棕黄色溶液蓝色溶液 D.检验试液中的CO32-:试液白色沉淀沉淀溶解 15.已知2Fe3++2I﹣=2Fe2++I2,Br2+2Fe2+=2Br﹣+2Fe3+。往含有FeBr2、FeI2的混合液中通入一定量的氯气后,再滴加少量的KSCN溶液,溶液变为红色,则下列说法不正确的是 A.按I﹣、Fe2+、Br﹣的顺序还原性逐渐减弱 B.通入氯气后原溶液中Fe2+一定被氧化 C.原溶液中Br﹣一定被氧化 D.不能确定通入氯气后的溶液中是否还存在Fe2+ 16.水热法制备Fe3O4纳米颗粒的反应为3Fe2++ 2S2O32-+ O2+ xOH-=Fe3O4 + S4O62- + 2H2O。 下列说法正确的是 A.2molFe2+被氧化时有1molO2被还原[来源:] B.该反应中只有Fe2+是还原剂] C.每生成1molFe3O4反应转移的电子为2mol D.反应物OH﹣的化学计量数x=2 17.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下: 下列叙述正确的是 A.试剂X可以是氢氧化钠溶液,也可以是盐酸 B.反应①过滤后所得沉淀为氢氧化铁 C.图中所示转化反应都不是氧化还原反应 D.反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3 18.下列各组物质充分反应后,最终既有沉淀又有气体生成的是 ①少量Na2O2投入Ca(HCO3)2溶液中 ②过量Ba(OH)2溶液和NH4HSO4溶液混合加热 ③AlCl3溶液与NaHCO3溶液混合 ④FeCl3溶液与NaHS溶液混合 A. ②③④ B.①② C.①③④ D.①②③ 19.向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是 A.a点对应的溶液中:Na+、OH-、SO42-、NO3- B.b点对应的溶液中:K+、Al3+、MnO4-、Cl-[来源:Z_xx_k.Com] C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl- D.d点对应的溶液中:K+、Fe2+、NO3-、SO42- 20.常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mLc(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是 A. 原合金质量为0.92g B.图中V2为60nL C.整个加入盐酸过程中Na+的浓度保持不变 D.Q点m1为1.56g 二. 非选择题(共4题,共50分) 21. (10分)Ⅰ.(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________。 (2)由A、B两种双原子分子组成的混合气体8.6g,在标准状况下的体积为8.96L,已知A和B的物质的量之比为3∶1,摩尔质量之比为14∶1,则A可能是________(写出两种可能的分子式),B的分子式是_______。 (3)在标准状况下,CO和CO2的混合气体质量36g,体积为22.4L,则CO所占体积是______L,CO的质量是______g。 Ⅱ .标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸密度为1.18 g·cm-3。试计算: (1)所得盐酸的质量分数和物质的量浓度分别是 、 。 (2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。 (3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过 mL。 (4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到 g固体。 22.(14分)(1)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题: ①溶液中存在的离子是 ; ②写出溶液中加入过量的稀硫酸反应的离子方程式 ; (2)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。 ①写出CNO-在酸性条件下被NaClO氧化的离子方程式: ; ②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。 (3)酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。 ①向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,反应的化学方程式________________ 。 ②取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。 ③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式:_________________________________。 23.(14分)铝鞣剂[主要成分为Al(OH)2Cl]主要用于鞣制皮革。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂的一种工艺如图: 回答下列问题: (1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90℃而不在室温下进行的原因是 。 (2)“酸溶”时,Al2O3发生反应的离子方程式为 。 (3)“氧化”时,发生反应的离子方程式为 。 (4)“除杂”时产生废渣的主要成分为 (填化学式),对其合理的处理方法是回收后制成 。 (5)准确称取所制备的铝鞣剂mg,将其置于足量硝酸中,待样品完全溶解后,加入足量AgNO3 溶液,充分反应,过滤、洗涤、干燥得固体ng.则样品中Al(OH)2Cl的质量分数为 (用含m、n的代数式表示)。 24.(12分)胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酚为原料制备胡椒乙酸的合成路线如图所示。 回答下列问题: (1)下列关于有机物B的说法正确的是________(填字母)。 a.能与FeCl3溶液发生显色反应 b.核磁共振氢谱中只有3组峰 c.能发生银镜反应 d.能与溴水发生加成反应 (2)常用于检验C中官能团的试剂为__________,C→D的反应类型是__________。 (3)胡椒乙酸(E)中所含官能团的名称为______________。 (4)G生成F的化学方程式为____________。 (5)W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成1molCO2,已知W的苯环上只有2个取代基,则W的结构共有___________种(不含立体异构),其中核磁共振氢谱有五组峰的结构简式为____________。 吉林省实验中学2017---2018学年度下学期 高二年级化学学科期末考试试题参考答案 1 2 3 4 5 6 7 8 9 10 C D A B D A B B D B 11 12 13 14[] 15 16 17 18 19 20 A A B[来源:Z,xx,k.Com] C C A D D C D 21. (每空1分,共10分) Ⅰ.(1)XY3 (2)N2或CO或C2H4 H2 (3)11.2 14 Ⅱ.(1)36.5% 11.8 mol·L-1 (2)1mol·L-1 (3)2.6 (4)5.85 22. (每空2分,共14分) (1)Na+、Fe2+、、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O (2)2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O 80% (3)Cu+2HCl+H2O2=CuCl2+2H2O; 0.032mol 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ 23.(每空2分,共14分) 193n 287m (1) AlN +3 H2O= NH3 ↑+Al(OH)3 加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出 (2)Al2O3+6H+=2Al3++3H20 (3)2Fe2++2H++ClO﹣═2Fe3++Cl﹣+H2O (4)Fe(OH)3 铁红 (5) ×100% 24.(12分)(1)ac(2分) (2) FeCl3(1分);取代反应(1分)(3)醚键和羧基(2分) (5)3(2分);(2分)查看更多