2019-2020学年安徽省铜陵市第一中学高二上学期期中考试化学试题 (Word版)
铜陵市一中2019-2020学年度第一学期高二年级期中考试化学试题
考试时间:90分钟 满分:100分
一、单项选择题(每小题 3 分,共 48 分)
1.下列属于放热反应的是( )
A. 燃烧木炭取暖 B. C 与 CO2 共热
C. 煅烧石灰石(主要成分是 CaCO3)制生石灰(CaO) D. Ba(OH)2·8H2O 晶体与 NH4Cl 晶体反应
2.下列有关化学能与热能的说法正确的是( )
A. 铝热反应属于吸热反应 B.H2→H+H 的变化需要吸收能量
C. 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应
D. 凡经加热而发生的化学反应都是吸热反应
3.一定条件下,反应 3A(g)+3B(g)⇌ c(g)+D(g) ΔH<0 达到平衡,欲提高 B 的转化率,可采取的措施是( )
A. 升高温度 B. 增大 B 的浓度 C. 增大压强 D. 使用合适的催化剂
4.下列关于化学反应速率的说法正确的是( )
A. 化学反应速率是指一定时间内任何一种反应物物质的量的减少或生成物物质的量的增加
B. 化学反应速率为 0.8 mol·(L·s)-1 是指 1 s 时某物质的浓度为 0.8 mol·L-1
C. 根据化学反应速率的大小可以知道化学反应进行的快慢
D. 对于任何化学反应来说,反应速率越快,反应现象就越明显
5.已知 N2O4(无色) ⇌ 2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满 NO2 气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水 CaO,在(III)中加入 NH4Cl 晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是( )
H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
243
431
A. CaO 溶于水时吸收热量 B. 该反应的ΔH>0
C. NH4Cl 溶于水时放出热量
D. 烧瓶(III)中气体的压强增大
6.已知
对于反应 H2(g)+Cl2(g)=2HCl(g)的能量变化描述正确的是( )
A. 436kJ/mol 是指断开 1 molH2 中的 H-H 键需要放出 436kJ 的能量
B. 431kJ/mol 是指生成 2 mol HCl 中的 H- Cl 键需要放出 431kJ 的能量
C. 由键能数据分析,该反应属于吸热反应
D. 2mol HCl(g)的能量比 1molH2(g)和 lmolCl2(g)的总能量低
7.能说明在固定的密闭容器中进行的反应:3H2(g)+N2(g)⇌ 2NH3(g)已经达到平衡的是( )
A. c(H2):c(N2):c(NH3)=3:1:2 B. 容器内气体的密度不再改变
C. 容器内气体的平均摩尔质量不变 D. 氢气消耗的速率是氮气消耗速率的 3 倍
8.工业上制硫酸的一步重要的反应是 SO2 在 400-500℃下催化氧化反应:2SO2+O2 ⇌ 2SO3,该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
A. 使用催化剂的目的是加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3 C. 增加O2的浓度,可以提高SO2的转化率
D. 当 SO2 和 SO3 的浓度相等时,反应一定达到平衡
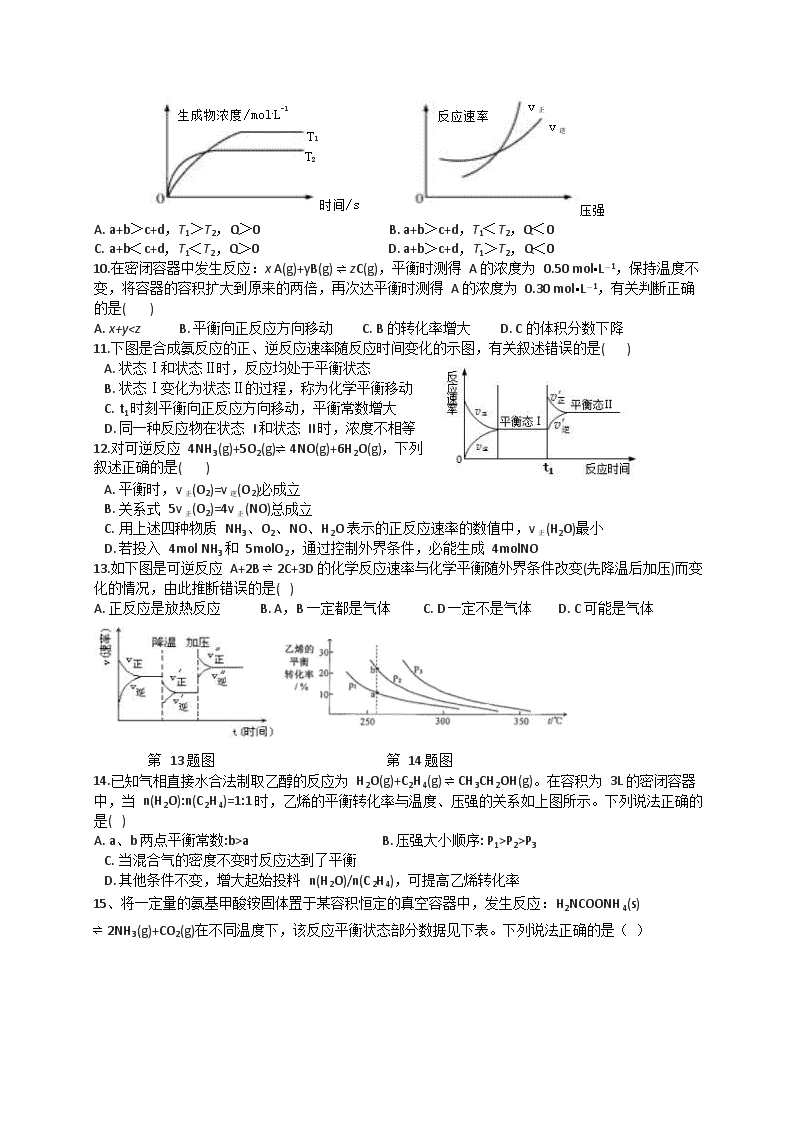
9.可逆反应 aA(g)+bB(g)⇌ cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是( )
生成物浓度/mol
·
L
-1
T
1
T
2
时间/s
反应速率
v
正
v
逆
压强
A. a+b>c+d,T1>T2,Q>0 B. a+b>c+d,T1<T2,Q<0
C. a+b<c+d,T1<T2,Q>0 D. a+b>c+d,T1>T2,Q<0
10.在密闭容器中发生反应:x A(g)+yB(g) ⇌ zC(g),平衡时测得 A 的浓度为 0.50 mol▪L-1,保持温度不变,将容器的容积扩大到原来的两倍,再次达平衡时测得 A 的浓度为 0.30 mol▪L-1,有关判断正确的是( )
A. x+y
a B. 压强大小顺序: P1>P2>P3
C. 当混合气的密度不变时反应达到了平衡
D. 其他条件不变,增大起始投料 n(H2O)/n(C2H4),可提高乙烯转化率
15、将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)
⇌ 2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见下表。下列说法正确的是( )
温度
平衡浓度/(mol·L-1)
c(NH3)
c(CO2)
T1
0.1
T2
0.1
编号
实验操作
实验现象
①
滴入 KSCN 溶液
溶液变红色
②
滴入 AgNO3 溶液
生成黄色沉淀
③
滴入 K3[Fe(CN)6]溶液
生成蓝色沉淀
④
滴入淀粉溶液
溶液变蓝色
A. 若T2>T1,则该反应的ΔH<0
B. T1、T2 时,H2NCOONH4 转化的Δn(T2) = 2Δn(T1) 第 16 题表
C. NH3 体积分数不变时,说明该反应达到平衡
D. 向容器中充入 N2,H2NCOONH4 质量增加
16.已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI 是难溶于水的黄色固体。将
0.2mol·L-1 的 KI 溶液和 0.05mol·L-1Fe2(SO4)3 溶液等体积混合后,取混合液分别完成上述实验,能说明溶液中存在化学平衡“2Fe3++2I— ⇌ 2Fe2++I2”的是( )
A. ①和② B. ②和④ C. ③和④ D. ①和③
二、非选择题(共 52 分)
17.I、为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。
试回答下列问题:(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量____(填“高”或“低”)于生成物化学键形成放出的能量。
(5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:P4(白磷,s)+5O2(g)= P4O10(s) ΔH=−2983.2 kJ·mol−1 ①
P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH=−738.5 kJ·mol−1 ②,则白磷转化为红磷的热化学方程式
为________。相同状况下,能量状态较低的是_____;白磷的稳定性比红磷______(填“高”或“低”)。
时间
n
(
Mn
2+
)
n
(
Mn
2+
)
图
1
图
2
时间
第 17 题图 第 18 题第(2)图
18.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验
室温下,试管中所加试剂及其用量/mL
室温下溶液颜色褪至无色所需时间/min
编号
0.6mol/LH2C2O4溶液
H2O
0.2mol/LKMnO4溶液
3mol/L稀硫酸
1
3.0
2.0
2.0
3.0
4.0
2
3.0
3.0
2.0
2.0
5.2
3
3.0
4.0
2.0
1.0
6.4
(1)根据上表中的实验数据,可以得到的结论是________。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号
室温下,试管中所加试剂及其用量/mL
再向试管中加入少量固体X
室温下溶液颜色褪至无色所需时间/min
0.6mol/L
H2C2O4溶液
H2O
0.2mol/L KMnO4溶液
3mol/L 稀硫酸
4
3.0
2.0
2.0
3.0
t
固体X是________。
③若该小组同学提出的假设成立,时间t________4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计________________________________________。
19.化学反应与能量变化密切相关。回答下列问题:
(1)反应物和生成物均为气态的某可逆反应,在不同条件下的反应历程分别为 A、B,如下左图所示。
①正反应的活化能为________(用图中字母表示);
②当反应达平衡后,其他条件不变,升高温度,反应物的转化率将______(填“增大”、“减小”、“不变”); ③B 历程表明此反应采用的条件为________(填标号)。
2H(g)+2X(g)
A.升高温度 B.降低温度 C.增大反应物浓度 D.使用催化剂
H2(g)+X2(g)
2HX(g)
ΔH2 ®¯ΔH3
ΔH1
(2)在如上右图的转化关系中(X 代表卤素)。ΔH2________0(填“>”、“=”或“<”);ΔH1、ΔH2 和ΔH3 三者存在的关系为________。
(3)甲醇(CH3OH)是重要的化工原料,又可作为燃料。利用合成气(主要成分为 CO、CO2 和 H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
化学键
H-H
C-O
CΞO
H-O
C-H
E/(kJ·mol-1)
436
343
1076
465
413
①CO(g)+2H2(g) ⇌ CH3OH(g) ΔH1
②CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ΔH3
已知反应①中的相关的化学键键能数据如下:
①计算ΔH1=________kJ.mol-1;
②已知ΔH3=+41.1 kJ.mol-1,则ΔH2=________kJ.mol-1。 第 20 题图
20.(1)合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g)
⇌ 2NH3(g) ΔH<0。写出该反应化学平衡常数表达式________,升高温度,该反应化学反应速率 ________,氢气的转化率________(以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在 500℃,原因是________。
(2)在 500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) 在 1 L 的密闭容器中,充入 1 mol CO2 和 3 mol H2,压强为 p0,测得 CO2(g)和 CH3OH(g)的浓度随时间变化如上图所示。
①反应进行到 4 min 时,v(正)________ (填“>”“<”或“=”)v(逆)。0~4 min,H2 的平均反应速率 v(H2)=________mol·L-1·min-1。
②下列能说明该反应已达到平衡状态的是________。
A.v 正(CH3OH)=3v 逆(H2) B.CO2、H2、CH3OH 和 H2O 浓度之比为 1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化 D.恒温恒容下,气体的密度不再变化 ③500℃、在 2 个容积都是 2L 的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
容器甲
容器乙
反应物起始投入量
1mol CO2,3mol H2
0.5mol CO2,1mol H21mol CH3OH,1mol H2O
CH3OH 的平衡浓度/mol·L-1
c1
c2
则乙容器中反应起始向________方向进行;c1________c2(填“>”“<”或“=”)。
铜陵市一中2019-2020学年度第一学期
高二年级期中考试化学试题答题卡
一、单项选择题(每小题 3 分,共 48 分)
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
16
答案
二、
非选择
题
(
共
52
分
)
17
.
(10
分
)
(
1
)
;
(
2
)
;
(
3
)
;
(
4
)
;
(
5
)
;
;
。
18.(10
分
)(1)
________
;
(2)①________;
②________________;
③________________________________________;
(3) 。
19
.
(14
分
)
(
1
)
①
;
②
;
③
(
2
)
;
;
(
3
)
①
;
②
。
2
0
.
(18
分
)
(
1
)
;
;
;
;
(
2
)
①
;
;
②
;
③
;
。
铜陵市一中2019-2020学年度第一学期高二年级期中考试化学试题参考答案
一、单项选择题(每小题 3 分,共 48 分)
题号
1
2
3
4
5
6
7
8
答案
A
B
C
C
B
D
C
D
题号
9
10
11
12
13
14
15
16
答案
B
D
C
A
B
D
B
A
二、非选择题(共 52 分)
17.(10 分)(1)放热;(2)高;(3)热能;(4)低 (每空 1 分);
(5)P4(白磷,s) =4P(红磷,s) ΔH=−29.2 kJ • mol−1;红磷;低(每空 2 分)。
18.(10 分,每空 2 分)(1)其他条件相同时,增大 H2SO4 浓度反应速率增大
(2) 生成物中的 MnSO4 为该反应的催化剂(或 Mn2+对该反应有催化作用);MnSO4;<
(3) 试管中取与实验 1(或 2、3)完全相同的试剂,放在热水中加热后混匀试剂,测褪色所需时间小于实验 1(或 2、3)中的褪色时间
19.(14 分,每空 2 分)(1)E1;增大;D
(2)>;△H1 =△H2+△H3
(3)-99;-57.9
20.(18 分,每空 2 分)(1)K= ;增大;减小;此温度下催化剂的活性较高
(2)>;0.375;C;逆反应;<。