化学卷·2019届河南省洛阳市第一高级中学高二10月月考(2017
-1
-1
-1
-1
高二月考化学试题
1.在25 ℃、101 kPa 条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热ΔH 分别为-393.5 kJ·mol 、-
285.8 kJ·mol -1、-870.3 kJ·mol-1,则 2C(s)+2H (g)+O (g) = CH COOH(l)的反应热为( )
2 2 3
A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1 C.-191 kJ·mol -1 D.+191 kJ·mol-1
2. 在25 ℃、1.01×105 Pa 下,将22 g CO 通入到750 mL 1.0 mol·L-
1
-1
的NaOH 溶液中充分反应,放出
x kJ 热量。在该条件下1 mol CO2 通入到2 L 1.0 mol·L 的NaOH 溶液中充分反应,放出y kJ 热量,
则CO2 与NaOH 反应生成NaHCO3 的热化学方程式为( ) A.
CO2(g)+NaOH(aq) = NaHCO3(aq) ΔH=-(2y-x) kJ·mol
B.CO2(g)+NaOH(aq) = NaHCO3(aq) ΔH=-(4x-y) kJ·mol
C.CO2(g)+NaOH(aq) = NaHCO3(aq) ΔH=-(2x-y) kJ·mol
-1
D.CO2(g)+NaOH(aq) = NaHCO3(aq) ΔH=-(8x-2y) kJ·mol
3.某恒定温度下,在一个2 L 的密闭容器中充入A 气体、B 气体,测得其浓度2 mol·L-1 和1 mol·L
-1;且发生如下反应:3A(g)+2B(g) ⇌ ?)+3D(?) ΔH=+a kJ· mol -1,已知“?”代表C、D
状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5∶3,则下列
说法中正确的是( )
A.保持体积不变的情况下,向该体系中充入 He 气,反应速率加快,平衡正向移动
B.此时B 的转化率为 20%
C.增大该体系压强,平衡向右移动,但化学平衡常数不变
D.增加C 的量,A、B 转化率减小,ΔH 减小
4. 将1 mol N2 和3 mol H2 充入体积可变的恒温密闭容器中,在 380 ℃下发生反应:
平衡时,体系中氨的体积分数 φ(NH3)随压强变化的情况如下表:
下列说法正确的是( )
A.10 MPa 时,H2 的转化率为75%
B.20 MPa 时,NH3 的物质的量浓度是10 MPa 时的1.5 倍
C.40 MPa 时,若容器的体积为V L,则平衡常数K=64V
3
D.30 MPa 时,若向容器中充入惰性气体,则平衡向正反应方向移动
压强/MPa
φ(NH3)
10
0.30
20
0.45
30
0.54
40
0.60
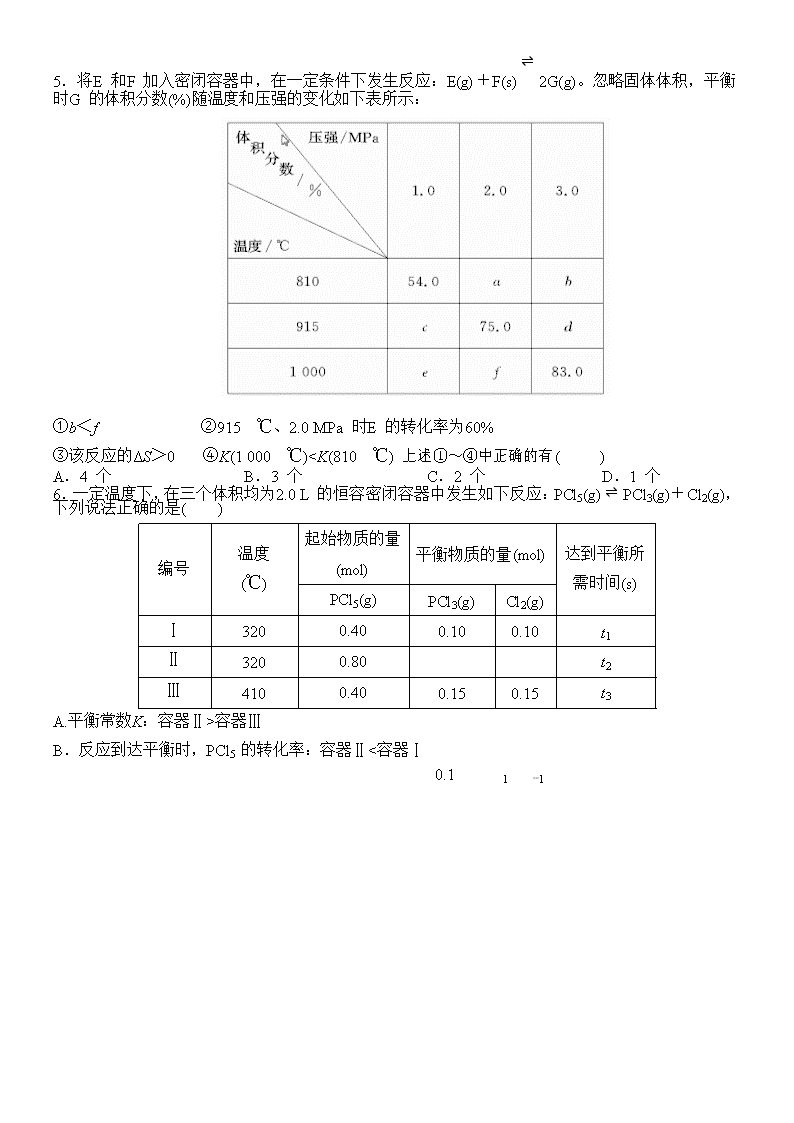
5.将E 和F 加入密闭容器中,在一定条件下发生反应:E(g)+F(s) ⇌ 2G(g)。忽略固体体积,平衡
时G 的体积分数(%)随温度和压强的变化如下表所示:
①b<f ②915 ℃、2.0 MPa 时E 的转化率为60%
③该反应的ΔS>0 ④K(1 000 ℃)
容器Ⅲ
B.反应到达平衡时,PCl5 的转化率:容器Ⅱ<容器Ⅰ
0.1 1 -1
起始物质的量
(mol)
PCl5(g)
0.40
0.80
0.40
温度
(℃)
平衡物质的量(mol) 达到平衡所
需时间(s)
编号
PCl3(g)
0.10
Cl2(g)
0.10Ⅰ
Ⅱ
Ⅲ
320
320
410
t1
t2
t30.15 0.15
甲
2
0.40
0.24
80
乙
2
0.80
0.24
α1
丙
2
0.80
0.48
α2
丁
1
0.40
0.24
α3
密闭容器体积/L
起始物
质的量
n(SO2)/ mol
n(O2)/ mol
SO2 的平衡转化率%
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)= t1
mol·L ·s
D.起始时向容器Ⅲ中充入 PCl5 0.30 mol、PCl3 0.45 mol 和Cl2 0.10 mol,则反应将正反应方向进行
7.如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入 2 mol SO2、1 mol O2,
向乙中充入4 mol SO2、2 mol O2 。甲、乙的体积都为1 L(连通管体积忽略不计)。保持相同温度和
催化剂存在的条件下,关闭活塞 K,使两容器中各自发生下述反应:2SO2(g)+O2(g) ⇌ 2SO3(g)。达
平衡时,甲的体积为0.8 L。下列说法正确的是( )
A.乙容器中SO2 的转化率小于60%
B.平衡时SO3 的体积分数:甲>乙
C.打开K 后一段时间,再次达到平衡,甲的体积为1.4 L
D.平衡后向甲中再充入2 mol SO2、1 mol O2 和3 mol SO3,平衡向正反应方向移动
8.一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入 SO2(g)和O2(g),进行反应: 2SO2+
O2 ⇌2SO3,其起始物质的量及SO2 的平衡转化率如下表所示。下列判断中正确的是( )
.甲中反应的平衡常数小于乙 B.该温度下,该反应的平衡常数K 为400
C.SO2 的平衡转化率:α1>α2=α3 D.容器中SO3 的物质的量浓度:丙=丁<甲
9 . 在温度、容积相同的3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达
到平衡时的有关数据如下(已知 N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol
误的是( )
﹣1,下列说法错
起始时各物质物质的量/mol
容器编号 达到平衡时体系能量的变化
N2
2
1.6
H2
3
1.8
NH3
0
0.8
(1)
(2)
27.78kJ
Q
A.2c1<c3 B.a+b=92.4 C.a1+a3<1 D.p3>2p2=2p1
10 .同温度下,体积均为1L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)⇌ 2NH3(g)
△H=﹣92.6kJ/mol.测得数据如表
下列叙述不正确的是( )
A.容器(1(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q 为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
容器 甲
1mol N2、3mol H2
乙
2mol NH3
丙
4mol NH3反应物投入量
NH 的平衡浓度(mol•L﹣1) c c c3 1 2 3
反应的能量变化
体系压强(Pa)
反应物转化率
放出akJ
p1
a1
吸收bkJ
p2
a2
吸收ckJ
p3
a3
11. 如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别
加入2mol X 和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)⇌aZ(g)并达到
平衡状态此时Ⅰ中X、Y、Z 的物质的量之比为1:3:2.下列判断正确的是( )
A.物质Z 的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y 中只有一种为气态
C.若X、Y 均为气态,则平衡时x 的转化率:I<Ⅱ
D.若X 为固态、Y 为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
12. 室温下,0.1 mol/L 的某二元酸H2A 溶液中,溶液中可能存
在的含A 粒子(H2A、HA 一、A2-)的物质的量分数随pH 变化的关系
如图所示,下列说法正确的是( )
A.H2A 的电离方程式:H2A H 十+HA-
B.pH=5 时,在NaHA 和Na2A 的混合溶液中:c(HA-):c(A2-)=l:100
C.等物质的量浓度NaHA 和Na2A 溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-) D.
Na2A 溶液必存在c(OH 一)=c(H+)+c(HA-)十2c(H2A),各粒子浓度均大0
13. 已知某溶液中只存在OH—、H+、Cl—、NH4
+四种离子,其离子浓度可能有如下关系:
① c(Cl—)>c(NH4
+)>c(H+)>c(OH—) ② c(Cl—)>c(NH4
+)>c(OH—)>c(H+)
③ c(NH4
+)>c(Cl—)>c(OH—)>c(H+) ④ c(NH4
+) =c(Cl—)>c(OH—)=c(H+)
下列说法正确的是( )
A.若①正确,则溶液中溶质一定为NH4Cl
B.若③正确,则溶液中c(NH3·H2O) + c(NH4
+)>c(Cl—)
C.若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH—)
D.溶质不同时,上述四种关系式均可能成立
14. 25℃时,向盛有 50mL pH=2 的 HA 溶液的绝热容器中加入 pH=13
的 NaOH 溶液,加入NaOH 溶液的体积(V)与所得混合溶液的温度(T)
的关系如图所示。下列叙述正确的是( )
A. HA 溶液的物质的量浓度为0.0l mol/L
B. b→c 的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b 的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA 的电离平衡常数K 约为1.43×10-2
15.向0.1 mol·L -1 的NH HCO 溶液中逐渐加入0.1 mol·L-1 NaOH 溶液时,含氮、含碳粒子的分
布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图像,下列不正确的是( )
A.开始阶段,HCO-反而略有增加,可能是因为NH HCO 溶液中存在H CO 发生的主要反应是
3 4 3 2 3
- -
H2CO3+OH =HCO3 +H2O
B.当pH 大于8.7 以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C.pH=9.5 时,溶液中c(HCO-)>c(HN ·H O)>c(NH+)>c(CO2-)
3 3 2 4 3
D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH = (NH4)2CO3+Na2CO3
16.室温时,盐酸和硫酸的混合溶液 20 mL,向混合物中逐滴加入0.05 mol·L-1 Ba(OH) 溶液时,生
成的BaSO4 和溶液pH 的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是( )
A.图中A 点溶液的pH=1
B.生成沉淀的最大质量为2.33 g
C.原混合溶液中盐酸物质的量浓度为 0.1 mol·L-1
D.当V=10 mL 时,发生反应的离子方程式为Ba2++SO2-=BaSO ↓
4 4
17.室温下,甲、乙两烧杯均盛有 5mL pH=3 的某一元酸溶液,向乙烧杯中加水稀释至 pH=4.关于
甲、乙烧杯中溶液的描述正确的是( )
A.溶液的体积10V 甲≥V 乙
B.水电离出的OH﹣浓度:10c(OH﹣) ≤c(OH﹣)
甲 乙
C.若分别用等浓度的NaOH 溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11 的NaOH 溶液反应,所得溶液的pH:甲≤乙
18.已知弱酸的电离平衡常数如下表:
下列选项正确的是( )
A.常温下,等浓度、等体积的 NaHCO3 溶液pH 小于 溶液pH
B.常温下,等浓度、等体积的 Na2CO3 溶液和 溶液中所含离子总数前者小于后者
C. +2NaHCO3→ +2H2O+2CO2↑
D.水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是能形成分子内氢键
19. 25℃时在10mL 0.1mol•L﹣1Na CO 溶液中逐滴加入0.1mol•L﹣1HCl 溶液20mL,溶液中部分含碳
2 3
微粒的物质的量随溶液pH 的变化如图所示.下列说法不正确的是( )
A.HCl 溶液滴加一半时,溶液pH>7
B.当溶液的pH=8 时,溶液中NaHCO3 的物质的量浓度为0.1mol•L﹣1
C.0.1 mol•L﹣1Na2CO3 溶液中c(Na+)+c(H+)=c(OH﹣)+2c(CO3
2﹣)+c(HCO3
﹣) D.
在M 点:c(Na+)>c(CO3
2﹣)=c(HCO3
﹣)>c(OH﹣)>c(H+)
20.在某温度时,将n mol·L -1 氨水滴入10 mL 1.0 mol·L -1
盐酸中,溶液pH 和温度随加入氨水体积变化曲线如图所
示,下列有关说法正确的是( )
A.a 点Kw=1.0×10-14
B.水的电离程度:b>c>a>d
C.b 点:c(NH+)>c(Cl-)>c(H+)>c(OH-)
D.25 ℃时NH Cl 水解常数为(n-1)×10-
7
mol·L -1
弱酸 H2CO3 水杨酸(
Ka1=1.3×10-3
Ka2=1.1×10-13
)
Ka1=4.3×10-7
Ka2=5.6×10-11
电离平衡常数(25℃)
二、填空题(本题共 5 道小题 20 空,每空 2 分,共 40
分)
21.(14 分)现有浓度均为0.1 mol·L-1 的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。 (2)
将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(3)已知T ℃,KW=1×10-13,在T ℃时将pH=11 的NaOH 溶液a L 与pH=1 的硫酸b L 混合(忽略
混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b= 。
(4)25 ℃时,有pH=x 的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取a L 该
盐酸与b L 该氢氧化钠 溶液反应,恰好完全中和,求:
①若x+y=14,则a/b= (填数据);
②若x+y=13,则a/b= (填数据);
③若x+y>14,则a/b= (填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH(x、y)的关系式为
(填表达式)。
22.(16 分)Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产有着重要作用。
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g) ⇌ 2NH3(g)
其化学平衡常数K 与温度t 的关系如下表,根据下表完成下列问题:
①比较K1、K2 的大小:K1 K2(填“>”、“=”或“<”
②判断该反应达到化学平衡状态的依据是 (填序号。 A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆) C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,
溶液呈酸性,水解 原理与NH4Cl 类似。①写出盐酸肼第一步水解反应的离子
方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号。
A.c(Cl-)>c(N H 2+)>c(H+)>c(OH-);
2 6
B.c(Cl-)>c([N H ·H O+])> c(H+)>c(OH-);
C.c(N2H6
2+)+ c([N2H5·H2O+])+c(H+)= c(Cl)+c(OH );
D.c(N2H6
2+)> c(Cl
)>c(H )>c(OH );
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知 Pb4+具有很强的氧化性。
水中铅的存在形态
主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小、Pb(OH)3
分数α 随溶液pH 变化的关系如下图所示:
-、Pb(OH)
2-,各形态的物质的量的
1
0.8 1 3
t/K
K/(mol·L -1)2
298
4.1×106
398 498
K K1 2
-
α0.6
0.4
图中:1 表示Pb2+,
2 表示Pb(OH)+,
3 表示Pb(OH)2,
、0.2 2 4 5
0
4 6 8 10 12 14
pH
4 表示Pb(OH)3 ,
5 表示Pb(OH)4
2
(2)向Pb(NO3)2 溶液滴加盐酸,溶液中c(Pb2+)/c(NO3
-)没有变大,反而变小并有沉淀生成,则生
成的沉淀可能为 。
(3)向Pb(NO3)2 溶液中滴加NaOH 溶液,溶液也变浑浊,在pH 约为 时生成沉淀最多, 继续滴加NaOH 溶液,混合体系又逐渐变澄清。pH = 13 时,混合体系中发生的主要反应的离子方 程式为: 。
23.(10 分)磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ 随pH 的变化
曲线如下图:
(1)在Na3PO4 溶液中,c(Na
)/c(PO4 ) 3(填“>”、“=”或“<”);向Na3PO4 溶液中滴入稀盐酸后,
pH 从10 降低到5 的过程中发生的主要反应的离子方程式为 (2)从图中推断NaH2PO4 溶液中各种微粒浓度大小关系正确的是 。(填选项字母) A.c(Na+)>c(H PO-)>c(H+)>c(HPO2-)>c(H PO )
2 4 4 3 4
B.c(Na+)>c(H PO-)>c(OH-)>c(H PO )>c(HPO2-)
2 4 3 4 4
C.c(H+)+c(Na+)=c(OH-)+c(H PO-)+2c(HPO2-)+3c(PO3-)+c(H PO )
2 4 4
D.c(Na+)=c(H PO-)+c(HPO2-)+c(PO3-)+c(H PO )
(3)假设25 ℃条件下测得0.1 mol·L-1 的Na PO
溶液的pH=12,近似计算出Na PO
的第一步水解
3 4 3 4
的水解常数Kh= 。
(4)某温度时,在25 mL 0.1 mol·L-1 NaOH 溶液中逐滴加入0.2 mol·L-1 CH COOH
溶液,曲线如下图
所示,有关粒子浓度关系的比较正确的是 。
A.在A、B 间任一点溶液中一定都有
c(Na+)>c(CH COO-)>c(OH-)>c(H+)
B.在B 点,a>12.5,且有c(Na+)=c(CH COO-)=c(OH-)=c(H+)
C.在C 点:c(CH3COO
)>c(Na
-
)>c(OH
)>c(H )D.在D 点:c(CH3COO
)+c(CH3COOH)=2c(Na )
高二月考化学试题答案
一、选择题(每题 2 分)
1.A 2.B 3.C 4.C 5.B 6.B 7.C 8.B 9.D 10.B
11.B 12.B 13.B 14.C 15.D 16.A 17.D 18.D 19.B
20.D
二、填空题(每空 2 分)
21(14 分)
(1)④②③① (2) c(Na+)=c(Cl-)>c(OH-)>c(NH+4 )>c(H
+)
(3) 101∶9 (4) ① 1 ② 0.1 ③ 10x+y-14 ④ x+y
=14+lga
b
22(16 分)
Ⅰ.(1)① > ② AC
(2)① N2H62++H2O [N2H5·H2O]+ + H+ ② A
Ⅱ.⑴ < ⑵PbCl2 ⑶10 Pb(OH)3— + OH— = Pb(OH)42—
23(10 分)
(1)> HPO2-4 +H+===H2PO-4
(2)AD (3)1.1×10-3 (4)D