- 2021-08-24 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省上高县第二中学2020届高三上学期月考化学试题
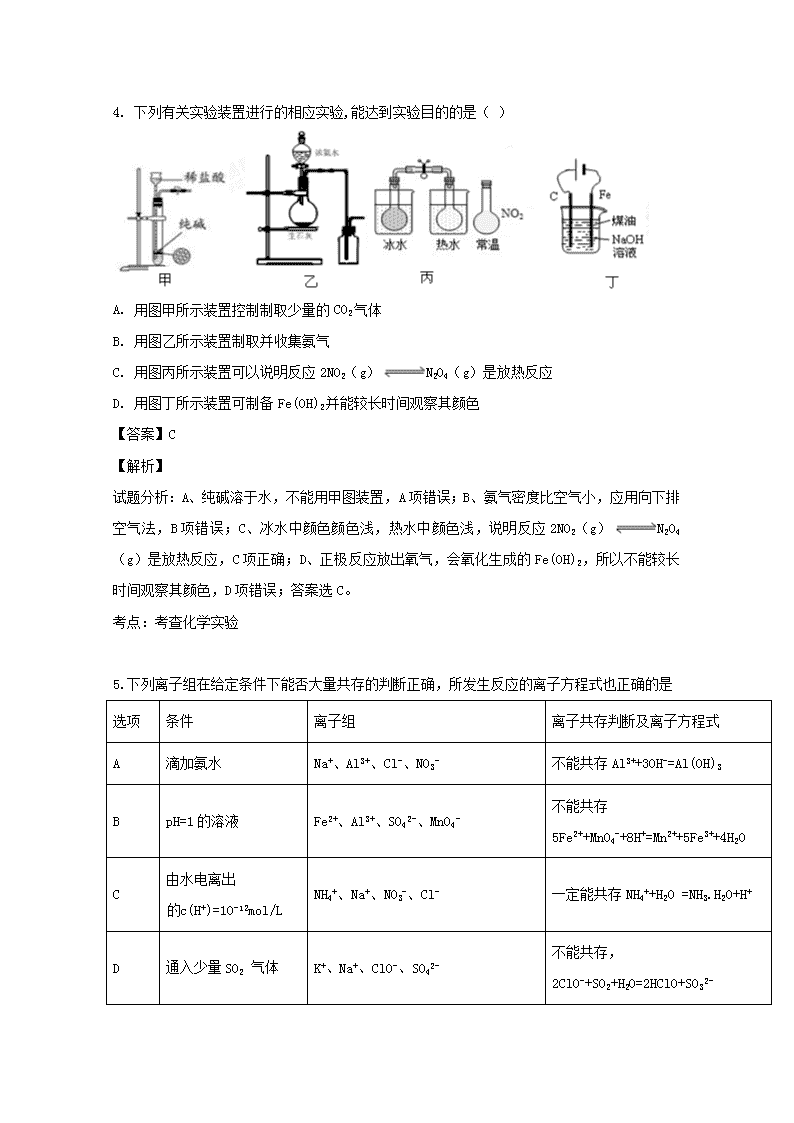
江西省上高县第二中学2020届高三上学期第二次月考 化学试题 1.《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之牢盆,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是 A. 加热 B. 结晶 C. 蒸发 D. 过滤 【答案】D 【解析】 灶燃薪是加热,多者十二三眼,少者七八眼,共煎此盘是蒸发结晶,因此没有过滤,故D正确。 2.设NA为阿伏加德罗常数,下列叙述正确的是 ①常温下64 g S4和S8混合物中含有原子数为2NA ②2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA ③1.0L1.0mol/LCH3COOH溶液中,CH3COOH分子数为NA ④8.8g乙酸乙酯中含共用电子对数为1.4NA ⑤足量铁在1mol氯气中加热反应,铁失去的电子数为3NA ⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA ⑦标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA ⑧lmolC15H32分子中含碳碳键数目14NA A. ①③⑤⑦ B. ①②④⑧ C. ②③⑥⑧ D. ①②⑥⑧ 【答案】B 【解析】 【详解】①S原子相对原子质量是32,所以常温下64 g S4和S8混合物中含有原子物质的量n(S)==2mol,所以含有S原子数为2NA,①正确; ②乙烯和聚乙烯最简式是CH2,其式量为14,2.8g乙烯和2.8g聚乙烯中含最简式的物质的量为n==0.2mol,所以其中含有碳原子数均为0.2NA,②正确; ③CH3COOH是弱电解质,在溶液中会发生部分电离,所以1.0L1.0mol/LCH3 COOH溶液中,含有的CH3COOH分子数小于NA,③错误; ④乙酸乙酯结构简式为CH3COOCH2CH3,一个分子中含有共用电子对数目为14个,8.8g乙酸乙酯的物质的量是0.1mol,则其中含共用电子对数为1.4NA,④正确; ⑤Fe与Cl2反应产生FeCl3,由于足量铁在1mol氯气中加热反应,Cl2不足,以Cl2为标准计算电子转移数目,所以铁失去的电子数为2NA,⑤错误; ⑥17g甲基(-14CH3)的物质的量是1mol,由于一个甲基中含有8个中子,所以常温常压下,17g甲基(-14CH3)所含的中子数为8NA,⑥错误; ⑦在标准状况下氯仿呈液态,不能使用气体摩尔体积计算,⑦错误; ⑧C15H32属于烷烃,1个该物质分子中含有14个C-C键,则lmolC15H32分子中含碳碳键数目为14NA,⑧正确; 可见叙述正确是①②④⑧,故合理选项是B。 3.能正确表示下列反应的离子方程式是 A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4↓+AlO2-+2H2O C. 硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2 +2H2O=2I2 +4OH- D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O 【答案】D 【解析】 【详解】A.次氯酸具有氧化性,HSO3-具有还原性,次氯酸能将亚硫酸氢根离子氧化为SO42-,,根据电子守恒、电荷守恒、原子守恒,可得:ClO-+SO2+H2O=SO42-+Cl-+2H+,A错误; B.NH4Al(SO4)2溶液与Ba(OH)2以物质的量之比1:2混合,反应的离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O,B错误; C.酸性条件下不可能产生OH-,硫酸酸化的淀粉KI溶液在空气中变成蓝色的离子反应为:4I-+O2+4H+=2I2+2H2O,C错误; D.氧化铁可溶于氢碘酸,Fe3+具有氧化性,能氧化I-为I2,反应的离子方程式为:Fe2O3+6H+ +2I-=2Fe2++I2 +3H2O,D正确; 答案选D。 4. 下列有关实验装置进行的相应实验,能达到实验目的的是( ) A. 用图甲所示装置控制制取少量的CO2气体 B. 用图乙所示装置制取并收集氨气 C. 用图丙所示装置可以说明反应2NO2(g)N2O4(g)是放热反应 D. 用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 【答案】C 【解析】 试题分析:A、纯碱溶于水,不能用甲图装置,A项错误;B、氨气密度比空气小,应用向下排空气法,B项错误;C、冰水中颜色颜色浅,热水中颜色浅,说明反应2NO2(g)N2O4(g)是放热反应,C项正确;D、正极反应放出氧气,会氧化生成的Fe(OH)2,所以不能较长时间观察其颜色,D项错误;答案选C。 考点:考查化学实验 5.下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是 选项 条件 离子组 离子共存判断及离子方程式 A 滴加氨水 Na+、Al3+、Cl-、NO3- 不能共存Al3++3OH-=Al(OH)3 B pH=1的溶液 Fe2+、Al3+、SO42-、MnO4- 不能共存5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O C 由水电离出c(H+)=10-12mol/L NH4+、Na+、NO3-、Cl- 一定能共存NH4++H2O =NH3.H2O+H+ D 通入少量SO2 气体 K+、Na+、ClO-、SO42- 不能共存,2ClO-+SO2+H2O=2HClO+SO32- A. A B. B C. C D. D 【答案】B 【解析】 A、NH3·H2O是弱碱,不能拆写成离子,应是Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故错误;B、pH=1,说明溶液显酸性,MnO4-能够把Fe2+氧化成Fe3+,不能大量共存,其离子反应方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,故正确;C、水电离出c(H+)=10-12mol·L-1<10-7mol·L-1,因此溶质对水的电离起到抑制作用,此溶质可能是酸,也可能是碱,NH4+与OH-反应生成NH3·H2O,因此不能大量共存,故错误;D、HClO具有强氧化性,能把SO2氧化成SO42-,故错误。 6.某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是 A. 气体A是NO2 B. X溶液中肯定存在Fe2+、Al3+、NH4+、SO42- C. 溶液E和气体F不能发生化学反应 D. X溶液中不能确定的离子是Al3+和Cl- 【答案】D 【解析】 【分析】 根据图中的各步实验操作分析各步的反应及产物,进而分析解答。 【详解】强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH 溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子; H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;不能确定是否含有的离子是Cl-和Al3+,以此解答; A.根据上述分析知A可以氧化为D,气体A是NO,故A错误; B. X溶液中肯定存在Fe2+、NH4+、SO42-,不一定有Al3+,故B错误; C. 溶液E为硝酸,气体F为氨气,可以发生化学反应,故C错误; D. 根据上述分析,X溶液中不能确定的离子是Al3+和Cl-,故D正确; 故选D。 7.100mL 1mol·L-1的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)( ) 生成CaCO3 溶液中HCO3- H2 转移的电子 A 0.1NA 0.1NA B 112L 0.1NA C 10g 0.05NA D 10g 0.1NA A. A B. B C. C D. D 【答案】C 【解析】 试题分析:A.反应中Na是还原剂,化合价由0价升高为+1价,反应的Na为0.1mol,故转移电子为0.1NA,溶液中HCO3-发生水解、电离,溶液中HCO3-的物质的量小于0.1mol,溶液中HCO3-小于0.1NA,故A错误;B.由A分析可知转移电子为0.1NA,生成氢气为0.05mol,该条件下,气体摩尔体积不一定是22.4L/mol,占有的体积不一定是22.4L,故B错误;C.生成碳酸钙为0.1mol,其质量=0.1mol×100g/mol=10g,生成氢气为0.05mol,氢气分子数目为0.05NA ,故C正确;D.生成碳酸钙为0.1mol,其质量=0.1mol×100g/mol=10g,由A分析可知,溶液中HCO3-小于0.1NA,故D错误;故选C。 【考点定位】考查常用化学计量的有关计算、根据方程式的计算、电解质的电离、盐类水解等。 【名师点晴】准确理解常见化学计量之间的转化关系,灵活运用公式进行计算是解题关键;具体分析:2.3gNa的物质的量为0.1mol,与水反应生成氢氧化钠与氢气,生成氢氧化钠为0.1mol、氢气为0.05mol,100mL1mol•L-1的Ca(HCO3)2溶液中Ca(HCO3)2的为0.1mol,氢氧化钠与Ca(HCO3)2为1:1,发生反应Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2O,生成0.1molCaCO3,0.1molNaHCO3,溶液中HCO3-发生水解、电离,溶液中HCO3-的物质的量小于0.1mol,N=nNA计算判断;特别注意22.4L/mol是标准状况下的气体摩尔体积,要注意使用条件。 8.食盐、蔗糖、醋酸、“84消毒液”、明矾等是居民日常生活中经常使用的物质,下列有关说法或表示正确的是 A. 食盐中阴离子的结构示意图为: B. 蔗糖和醋酸都是弱电解质 C. “84消毒液”中有效成分NaClO的电子式为: D. 明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒 【答案】C 【解析】 试题分析:A、Cl‾最外层电子数为8,错误;B、蔗糖为非电解质,错误;C、“84消毒液”中有效成分为NaClO,Cl与O之间形成一个共价键,Na+与ClO‾之间形成离子键,正确;D、明矾溶液水解可制得Al(OH)3胶体,可用于吸附悬浮性杂质,不能用于杀菌消毒,错误。 考点:本题考查化学用语、电解质、物质的用途。 9.在一定温度下,向饱和氢氧化钠溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列关于溶液的说法正确的是( ) A. 溶液中有晶体析出,Na+数目变小 B. 有氧气放出,Na+数目增加 C. Na+数目变小,溶质的质量不变 D. 溶液中Na+数目不变,溶质的物质的量浓度不变 【答案】A 【解析】 过氧化钠和水发生:2Na+2H2O=4NaOH+O2↑,消耗水,饱和的烧碱溶液中有NaOH析出,溶液中Na+数目减少,但反应后仍为饱和溶液,溶液的pH不变,溶液中c(Na+)不变;A.有晶体析出,Na+数目减少,故A正确;B.有氧气放出,Na+数目减少,故B错误;C.Na+数目减少,溶质的质量减小,故C错误;D.溶液中Na+数目减少,溶质的物质的量浓度不变,故D错误;故答案为A。 点睛:明确反应原理和饱和溶液的性质特征是解题关键,饱和溶液的性质,溶剂减小,溶液中要析出晶体,但溶液的浓度不变,而过氧化钠和水反应生成氢氧化钠和氢气,消耗水,饱和的烧碱溶液中有NaOH析出,有氧气放出,得到的溶液仍然是饱和氢氧化钠溶液,据此回答判断。 10.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是 A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2 C. 步骤③用 CuCO3代替CuO也可调节溶液的pH D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 【答案】B 【解析】 【详解】A、样品中含有CuO、FeO、Fe2O3,跟硫酸反应生成Cu2+、Fe2+、Fe3+,H2O2具有强氧化性,能把Fe2+氧化成Fe3+,离子反应方程式为2Fe2++H2O+2H+=2Fe3++2H2O,故说法正确; B、不能用硝酸和氯水代替H2O2,防止引入NO3-和Cl-等杂质,同时也防止产生污染,故说法错误; C、CuCO3不溶于水,可以调节pH,不引入新杂质,故说法正确; D、沿玻璃棒向原过滤器中加入蒸馏水,没过沉淀,待水流完后,重复上述操作2~3次,故说法正确。 故选B。 【点睛】注意哪些物质是杂质,流程的目的是什么,即需要制取什么物质,化学工艺流程中注意信息的利用,如本题pH=5时Fe3+完全沉淀,也就是说需要把Fe2+氧化成Fe3+,然后调节pH到5,加入的物质不能引入新杂质,同时加入的物质容易除去。 11.工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( ) (注:铝土矿中含有A12O3、SiO2、Fe2O3) A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石 B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2 D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物 【答案】C 【解析】 A、根据铝土矿的成分,先加入盐酸,发生Al2O3+6H+=2Al3++3H2O和Fe2O3+6H+=2Fe3++3H2O,然后过滤,向滤液中加入过量的NaOH溶液,发生Al3++4OH-=AlO2-+H2O和Fe3++3OH-=Fe(OH)3↓,过滤,向滤液中通入足量的CO2,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,氢氧化铝受热分解成氧化铝,然后加入冰晶石,电解熔融状态氧化铝得到金属铝,因此需要用到的物质为NaOH、盐酸、CO2、冰晶石,故A错误;B、石英的成分是SiO2,属于氧化物,且不与盐酸反应,故B错误;C、制取粗硅的反应是:2C+SiO22CO+Si,C的化合价升高,即C为还原剂,SiO2中Si的化合价降低,即SiO2 作氧化剂,氧化剂与还原剂物质的量之比为1:2,故C正确;D、CuFeS2中S的化合价为-2价,转化成SO2,S的化合价升高,O的化合价降低,即SO2为既氧化产物又是还原产物,故D错误。 12.X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去)。下列说法不正确的是 A. 若W是单质铁,则Z溶液可能是FeCl2溶液 B. 若W是氢氧化钠,则X与Z可反应生成Y C. 若X是金属镁,则W可能是强氧化性的单质 D. 若X是金属Na,则Z可以是Na2O2 【答案】C 【解析】 A项,W为Fe,若X为Cl2,则Y为FeCl3,Z为FeCl2,Z溶液可能是FeCl2溶液,正确;B项,W为NaOH,若X为H2S,则Y为NaHS,Z为Na2S,H2S可与Na2S反应生成NaHS,正确;C项,X为Mg,若W为强氧化性单质,由于Mg没有可变化合价,Mg与W化合成的生成物Y不可能进一步被W氧化,错误;D项,X是Na,若W为O2,则Y为Na2O,Z为Na2O2,正确;答案选C。 点睛:本题考查物质之间的转化,可用举例法代入验证,也可根据物质的类别和性质分析。 13.下列物质均为a g,将它们在氧气中完全燃烧的产物全部通入到足量的过氧化钠固体中,则过氧化钠固体增重为a g的是( ) ①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH A. ①②⑥ B. ③④⑤ C. ①②④⑤ D. ②③⑤ 【答案】C 【解析】 H2、CO发生的化学方程式为:2H2+O2 2H2O,2Na2O2+2H2O=4NaOH+O2↑;2CO+O2 2CO2 ,2Na2O2+2CO2=2Na2 CO3+O2,由反应方程式可知,过氧化钠增加的质量即为H2、CO的质量。因此只要是CO或H2或它们的气体或化学组成符合(CO)m·(H2)n,则过氧化钠固体增重质量等于原物质的质量,则①②符合,而④HCHO可以改写成CO·H2,⑤CH3COOH可以改写成(CO)2·(H2)2,⑥HCOOH可以改写成CO2·H2 ,故④⑤符合,⑥不符合,①②④⑤符合;故选C。 14.M(NO3)2热分解化学方程式为:2M(NO3)22MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是 ( ) A. 64g/mol B. 24g/mol C. 65g/mol D. 40g/mol 【答案】B 【解析】 【分析】 根据n=计算混合气体的物质的量,根据方程式化学计量数关系计算出29.6g M(NO3)2的物质的量,根据M=计算出摩尔质量,进而根据质量守恒定律计算M的摩尔质量。 【详解】试题分析:生成气体的物质的量为0.5mol,氧气为气体总量的1/5,氧气的物质的量为0.1mol,设M(NO3)2的物质的量为xmol 2M(NO3)22MO+4NO2↑+O2↑ 2 1 x 0.1 解得x=0.2mol,M(NO3)2的摩尔质量为=148g/mol,M=(148-62×2) g/mol =24g/mol。选项B正确。 【点睛】本题考查了摩尔质量的计算,题目难度不大,要求熟练掌握物质的量与气体摩尔体积、摩尔质量之间的转化关系。 15.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( ) A. 10mol B. 11mol C. 12mol D. 13mol 【答案】B 【解析】 由2Cu(IO3)2+24KI+12H2SO4==2CuI↓+13I2+12K2SO4+12H2O可知,Cu(IO3)2中,Cu元素的化合价由+2价降低为+1价,I元素的化合价由+5价降低为0,则Cu(IO3)2为氧化剂,所以1mol 氧化剂在反应中得到的电子为1mol×(2-1)+2mol×(5-0)=11mol,答案选B。 点睛:本题考查氧化还原反应中转移电子数目的计算,明确反应中元素的化合价变化是解答本题的关键。注意CuI中Cu为+1价为解答的易错点。 16.将17.9g由Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为25.4g。若HNO3的还原产物仅为NO,则生成NO的标准状况下的体积为( ) A. 2.24L B. 4.48L C. 6.72L D. 8.96L 【答案】C 【解析】 【详解】加入足量的氢氧化钠中发生的反应为2 Al + 2 NaOH + 2 H2O =2NaAlO2+ 3 H2↑生成的氢气为3.36 L,即0.15 mol,所以含有铝0.1 mol,而0.1mol铝则变为+3价,所以转移0.3 mol电子,Fe被氧化为+3价,Cu被氧化为+2。假设Fe、Cu的物质的量分别是x、y 。质量和:2.7 + 56x + 64y =" 17.9" ; 沉淀量:107x + 98y = 25.4;解得x="0.1" mol,y="0.15" molAl、Fe、Cu的物质的量分别是0.1 mol、0.1 mol、0.15 mol所以转移电子数总的为0.9 mol;氮原子从硝酸中的+5价还原为+2价,共转移0.9 mol电子,则生成NO为0.3 mol,则V(NO)=6.72L。故答案选C。 17.FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性 Ⅰ.实验室制备FeBr2 实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。 实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。 请回答: (1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。 (2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________. Ⅱ.探究FeBr2的还原性 (1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。 (2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设: 假设1:Br- 被Cl2氧化成Br2溶解在溶液中; 假设2:Fe2+ 被Cl2氧化成Fe3+。 设计实验证明假设2是正确的_______________________________ (3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明:_____________; (4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。 【答案】 (1). 浓H2SO4的洗气瓶 (2). NaOH溶液 (3). 将Br2蒸气带入反应管中 (4). 100 mL容量瓶 (5). 向黄色溶液中加入少量KSCN溶液,若溶液变血红色,则证明假设2正确 (6). Fe2++Br2=2Fe3++2Br- (7). 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl- 【解析】 【分析】 I. (1)装置B用于除去CO2中的HCl气体;装置D作用是干燥CO2气体,根据Br2的性质选择合适的尾气处理试剂; (2)通入CO2,可以将容器中的空气赶净;将Br2蒸气带入反应器D中; II.(1)根据选择仪器的标准和配制一定体积、一定物质的量浓度的溶液的步骤选择合适的仪器; (2)Fe2+被Cl2氧化成Fe3+ ,可向该溶液中加入KSCN溶液来检验是否含有Fe3+; (3)根据还原剂的还原性大于还原产物,只要在含有Fe2+的溶液中滴加溴水即可; (4) 40mL0.1mol/LFeBr2溶液中溶质的物质的量是0.004mol ,通入3×10-3molC12,二者的物质的量比为4:3反应,结合还原性Fe2+>Br-,由氧化还原反应的先后规律和电子守恒可知:亚铁离子全部被氧化,溴离子只有四分子之一被氧化。 【详解】I. ( 1 )装置B用于除去CO2中的HCl杂质气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气;装置D作用是干燥CO2,可以用盛有浓H2SO4的洗气瓶干燥;Br2会导致大气污染,可根据Br2与NaOH溶液作用产生可溶性的物质的性质,用NaOH溶液作尾气吸收试剂。 (2)反应过程中要不断地通入CO2,其主要作用是:①反应前将容器中的空气赶净,避免空气中的氧气干扰实验;②反应过程中要不断通入CO2,还可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应; II.(1)配制一定体积、一定物质的量浓度的溶液需要的仪器有天平、药匙、烧杯、玻璃棒、一定规格的容量瓶、 胶头滴管,实验室没有90mL容量瓶,根据选择仪器的标准“大而近”的原则,要使用100mL的容量瓶; (2)取适量黄色溶液,向其中加入少量KSCN溶液,若溶液变血红色,可证明溶液中含有Fe3+离子,从而证明假设2正确; (3)利用还原剂的还原性大于还原产物,则可在含有Fe2+的溶液中滴加溴水,会发生离子反应Br2+2Fe2+=2Fe3++2Br-,即可证明还原性Fe2+>Br-; (4)40mL0.1mol/LFeBr2溶液中溶质的物质的量是0.004mol ,通入3×10-3molC12,二者的物质的量比为4:3反应,结合还原性Fe2+>Br-,由氧化还原反应的先后规律和电子守恒可知,亚铁离子全部被氧化,溴离子只有四分子之一被氧化 ,发生反应的离子方程式为4Fe2+ +2Br-+3Cl2=4Fe3++Br2+6Cl-。 【点睛】本题考查了制取溴化亚铁方案设计、离子的检验方法、物质反应先后顺序及离子方程式书写的知识,II中(4)注意反应物用量对反应的影响,是解答本题的易错点。 18.磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上时就会造成人畜中毒,请回答: (1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式___________。 (2)实验室用硫酸铜溶液吸收PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4 ,当吸收2.2molPH3转移电子______mol (3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1,写出相应的化学方程式______。 (4)氧硫化碳水解及部分应用流程如下(部分产物已略去):COSH2SNa2SM溶液+H2 ①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______. ②已知M溶液中硫元素的主要存在形式为S2O32﹣,则反应Ⅲ中生成S2O32﹣的离子方程式为________. ③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol),由图象分析可知,a点时M溶液中除S2O32—外,还有____(填含硫微粒的离子符号)。 【答案】 (1). PH4I+NaOHPH3↑+NaI+H2O (2). 4.8 (3). KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑ (4). 第三周期第VA族 (5). 2S2﹣+5H2OS2O32﹣+4H2↑+2OH﹣ (6). SO42﹣ 【解析】 【分析】 可结合NH4Cl与NaOH加热反应制取NH3,用PH4I与NaOH反应制取PH3; (2)根据氧化还原反应规律分析判断; (3)根据题干确定生成物,然后结合原子守恒及物质的物质的量关系书写反应方程式; (4)①根据物质含有的元素种类,结合元素周期律分析判断; ②依据题干信息:S2-与H2O反应产生S2O32-和H2,结合电荷守恒及原子守恒书写反应式; ③根据反应III在不同温度下反应时间与H2产量关系分析判断。 【详解】(1)用PH4I与NaOH加热发生反应产生NaI、H2O、PH3,反应方程式为PH4I+NaOHPH3↑+NaI+H2O; (2)在反应24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4中,Cu元素的化合价由反应前CuSO4中的+2价变为反应后中Cu3P的+1价,化合价降低,因此CuSO4为氧化剂;每24mol CuSO4发生反应,同时会消耗11molPH3,转移24mol电子,则吸收2.2molPH3转移电子的物质的量为mol=4.8mol; (3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐KHSO4、NH4HSO4,生成物的物质的量之比为1∶1∶1,反应方程式为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑; (4)①组成氧硫化碳和磷化氢的原子为O、S、P、H,由于原子核外电子层数越多,原子半径越大;当原子核外电子层数相同时,原子序数越大,原子半径越小,所以这四种元素中,原子半径最大的元素为P,其在周期表中的位置位于第三周期第VA族; ②S2-与H2O反应产生S2O32-和H2,根据电荷守恒、原子守恒、电子守恒,可得反应方程式为:2S2﹣+5H2OS2O32﹣+4H2↑+2OH﹣; ③反应III中,a点360℃时,随着时间推移,氢气的物质的量不变,Na2S初始含量为3mmol,若只发生反应2S2﹣+5H2OS2O32﹣+4H2↑+2OH﹣,生成氢气的物质的量为3mmol×=6mmol,图示为9mmol,说明M溶液中除含有S2O32﹣外,还含有SO42-,反应方程式为:S2﹣+4H2O=SO42-+4H2↑。 19.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下: 已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下: 阳离子 Fe2+ Mg2+ Al3+ Cr3+ 沉淀完全时的pH 3.2 11.1 5.4(>8溶解) 9(>9溶解) (1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。 (2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。 (3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。 (4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。 (5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。 【答案】 (1). 54.3 (2). 500mL容量瓶、胶头滴管 (3). 2Cr3++3H2O2+H2O=Cr2O72-+8H+ (4). Fe(OH)3、 Al(OH)3 (5). Na+、 SO42-、 CrO42- (6). Mg2+、 Ca2+ (7). 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH- 【解析】 【分析】 (1)实验室用18.4 mol/L的浓硫酸配制480mL2mol/L的硫酸,需用500mL容量瓶,根据稀释前后硫酸物质的量不变,列式计算需量取浓硫酸的体积;定容时用容量瓶和胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,根据得失电子守恒配平方程式;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、 Al3+、 Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀;(4)钠离子交换树脂的反应原理为: Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,分析利用钠离子交换树脂可除去滤液II中的金属阳离子;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4。 【详解】(1)实验室用18.4 mol/L的浓硫酸配制480mL2mol/L的硫酸,需用500mL容量瓶;设需量取浓硫酸的体积为vmL,根据稀释前后硫酸物质的量不变,18.4 mol/L =500mL 2mol/L,v=54.3mL;配制时 除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有500mL容量瓶、胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,反应离子方程式是2Cr3++3H2O2+H2O=Cr2O72-+8H+ ;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、 Al3+、 Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀,所以过滤II操作得到的滤渣主要为Fe(OH)3、 Al(OH)3;根据元素守恒,滤液II中含有的离子主要有Na+、 SO42-、 CrO42-;(4)钠离子交换树脂的反应原理为: Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,利用钠离子交换树脂可除去滤液II中的金属阳离子有Mg2+、 Ca2+;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4,反应离子方程式是2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-。 20.异丁酸-3-苯丙酯()是一种香料,下图是这种香料的一种合成路线: 已知以下信息: ①有机物E的摩尔质量为88 g·mol-1,其核磁共振氢谱表明含有3种不同环境的氢原子。 ②有机物F是苯甲醇的同系物。 ③R—CH==CH2R—CH2CH2OH。 请回答下列问题: (1)异丁酸-3-苯丙酯分子式为________________。 (2)A分子中的官能团名称为________________。 (3)C的结构简式为________________。 (4)一定条件下,1 mol D与2 mol H2能够完全反应生成F,D能够发生银镜反应,因此D生成F的反应类型为________________。 (5)E、F反应生成异丁酸-3-苯丙酯的化学方程式为________________________。 (6)已知有机化合物甲符合下列条件: ①与F是同分异构体;②苯环上有3个支链;③核磁共振氢谱显示其含有5种不同环境的氢原子,且不同环境的氢原子个数比为6∶2∶2∶1∶1;④与FeCl3溶液不能发生显色反应。 写出符合上述条件有机物甲的结构简式:_____________________________。 【答案】 (1). C13H18O2 (2). 碳碳双键 (3). (4). 加成反应(或还原反应) (5). ++H2O (6). 或 【解析】 【分析】 根据图中转化关系,可以推断E为羧酸,结合其摩尔质量为88 g/mol,可知其分子式为C4H8O2,又知E的核磁共振氢谱中有三种不同环境的氢原子,则E的结构简式为,从而可逆推A为,B为,C为;由“有机物F是苯甲醇的同系物”和“1 mol D与2 mol H能够完全反应生成F,D能够发生银镜反应”可知D为,F为。 【详解】(1)异丁酸-3-苯丙酯的结构简式为,分子式为C13H18O2,故答案为:C13H18O2; (2)A的结构简式为,分子中的官能团为碳碳双键,故答案为:碳碳双键; (3)根据图中转化关系可知, 发生催化氧化反应生成,则C为,故答案为:; (4)一定条件下,1 mol与2 mol H2发生加成反应,完全反应生成,故答案为:加成反应(或还原反应); (5)与在浓硫酸作用下,共热发生酯化反应生成异丁酸-3-苯丙酯和水,反应的化学方程式为+ +H2O,故答案为:++H2O; (6)由与FeCl3溶液不能发生显色反应可知F的同分异构体属于芳香醇,苯环上有3个支链,说明苯环上连有2个甲基和一个—CH2OH,由核磁共振氢谱显示其含有5种不同环境的氢原子,且不同环境的氢原子个数比为6∶2∶2∶1∶1可知同分异构体的结构简式为或,故答案为:或。 【点睛】本题考查有机合成与推断,明确各类有机物的基本反应类型和相互转化关系,熟悉烃的各种衍生物间的转化关系,结合新信息进行分析、联想、对照、迁移应用、参照反应条件推出结论是解答关键,本题的难点是同分异构体的书写,特别是有限制条件的同分异构体的书写。 查看更多