江西省鄱阳县第一中学2019-2020学年高二上学期检测化学试卷
化 学 试 卷
考试时间:90分钟 满分:100分
可能用到的相对原子质量:Li-7
一、选择题(16小题,每小题3分,共48分)
1.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
蔗糖
BaSO4
酒精
H2O
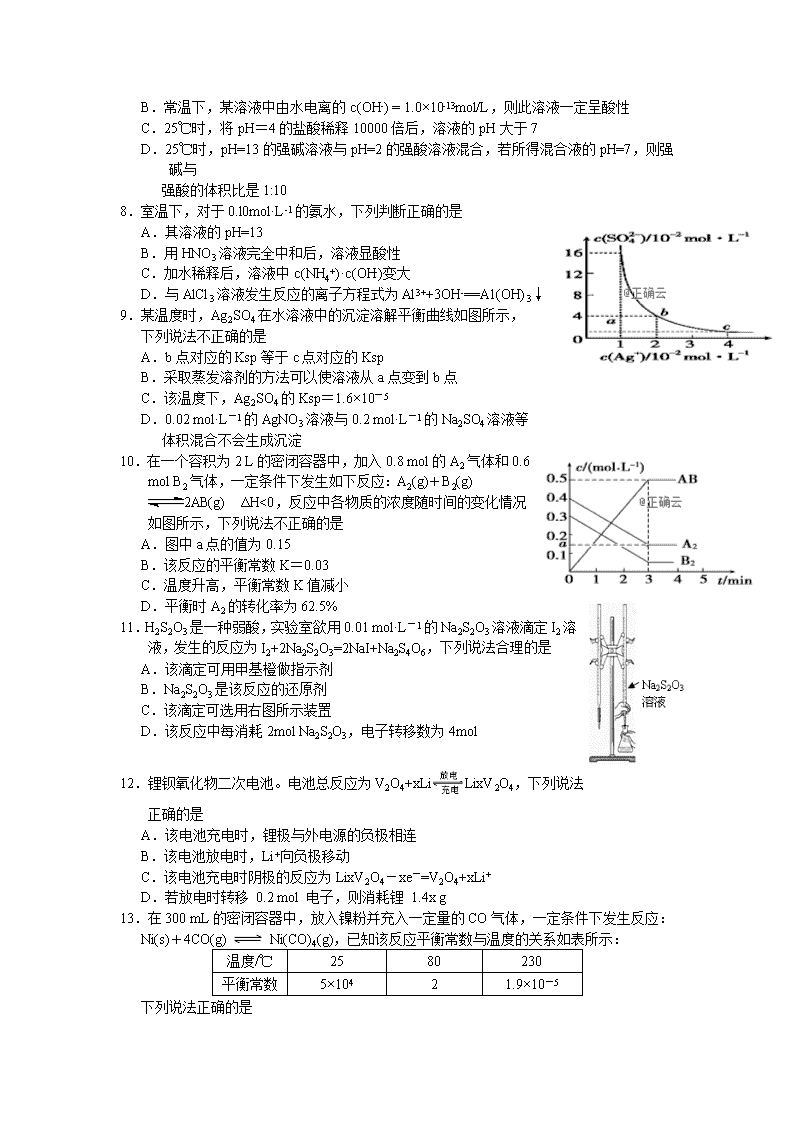
2.已知化学反应A2 (g)+B2 (g)=2AB (g)的能量变化如图所示,
下列叙述正确的是
A.该反应每生成2分子AB吸收(a-b)kJ能量
B.该反应中反应物的总能量高于生成物的总能量
C.该反应的反应热ΔH=+(a-b) kJ·mol-1
D.断裂1molA-A键和1molB-B键,放出akJ能量
3.研究电化学腐蚀及防护的装置如图所示。下列有关说法错误
的是
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH-
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H++2e-=H2↑
4.下列说法中有明显错误的是
A.加入适宜的催化剂,使分子能量增加,从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率
B.活化分子之间发生的碰撞不一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,
因而反应速率增大
5.下列事实不能用勒夏特列原理来解释的是
A.用排饱和食盐水的方法收集氯气
B.合成氨工业选择高温
C.开启啤酒瓶后,瓶中马上泛起大量泡沫
D.在Fe3++3SCN-Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
6.已知水的电离方程式:H2O H+ + OH-,下列叙述中正确的是
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
7.下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>10b
B.常温下,某溶液中由水电离的c(OH-) = 1.0×10-13mol/L,则此溶液一定呈酸性
C.25℃时,将pH=4的盐酸稀释10000倍后,溶液的pH大于7
D.25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与
强酸的体积比是1:10
8.室温下,对于0.l0mol·L-1的氨水,下列判断正确的是
A.其溶液的pH=13
B.用HNO3溶液完全中和后,溶液显酸性
C.加水稀释后,溶液中c(NH4+)·c(OH-)变大
D.与AlCl3溶液发生反应的离子方程式为Al3++3OH-==A1(OH)3↓
9.某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,
下列说法不正确的是
A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的Ksp=1.6×10-5
D.0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等
体积混合不会生成沉淀
10.在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
11.H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
A.该滴定可用甲基橙做指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定可选用右图所示装置
D.该反应中每消耗2mol Na2S2O3,电子转移数为4mol
12.锂钡氧化物二次电池。电池总反应为V2O4+xLiLixV2O4,下列说法正确的是
A.该电池充电时,锂极与外电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D.若放电时转移 0.2 mol 电子,则消耗锂 1.4x g
13.在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
下列说法正确的是
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25 ℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为0.5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
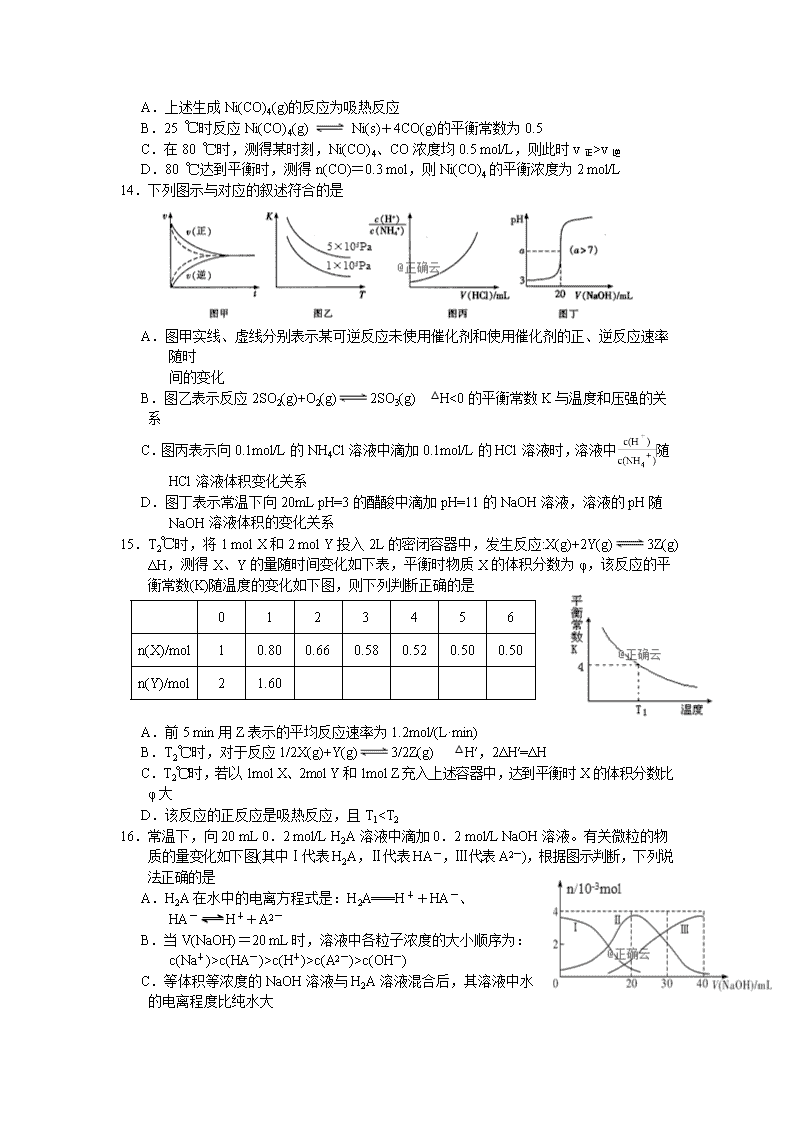
14.下列图示与对应的叙述符合的是
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时
间的变化
B.图乙表示反应2SO2(g)+O2(g)2SO3(g) △H<0的平衡常数K与温度和压强的关系
C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中随HCl溶液体积变化关系
D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
15.T2℃时,将1 mol X和2 mol Y投入2L的密闭容器中,发生反应:X(g)+2Y(g)3Z(g) ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
0
1
2
3
4
5
6
n(X)/mol
1
0.80
0.66
0.58
0.52
0.50
0.50
n(Y)/mol
2
1.60
A.前5 min用Z表示的平均反应速率为1.2mol/(L·min)
B.T2℃时,对于反应1/2X(g)+Y(g)3/2Z(g) △H′,2ΔH′=ΔH
C.T2℃时,若以1mol X、2mol Y和1mol Z充入上述容器中,达到平衡时X的体积分数比φ大
D.该反应的正反应是吸热反应,且T1
c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
二、非选择题(共52分)
17.(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;溶液中的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol·L-1;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为________________。
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=__________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气____________。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为___________________________。
18.I.在一定条件下aA+bBcC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向逆反应方向移动,则a、b、c、d关系是_______。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是_______(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率_______(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是_______反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡正向移动,则a、b、c、d关系是_______。
Ⅱ.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)。
(1)在一定温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol·L-1。该反应的平衡常数K=_______。
(2)若在一体积可变的容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向_______(填“正”、“逆”)反应方向进行。
(3)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器
反应物投入的量
反应物的
转化率
CH3OH的
浓度(mol/l)
能量变化(Q1、Q2、Q3均大于0)
1
2molCO和4molH2
a1%
c1
放出Q1kJ热量
2
2molCH3OH
a2%
c2
吸收Q2KJ热量
3
4molCO和8molH2
a3%
c3
放出Q3KJ热量
则下列关系正确的是_______。
A. c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成2molCH3OH,则放出(Q1+Q2)kJ热量
19.氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:N2(g)+3H2O(l)2NH3(g)+3/2O2(g) △H= a kJ • mol-1。为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K
303
313
323
n(NH3)/(l0-2mol)
4.8
5.9
6.0
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)2NH3(g) △H=-92.4 kJ • mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积
C.降低温度 D.增加NH3的物质的量
③20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是________
____,35min达到第二次平衡,则两次平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
20.Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去。已知:①常温下,Cr3+完全沉淀(c≤1.0×10−5 mol· L−1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-②Cr2O72-还原产物为Cr3+。
请回答下列问题:
(1)写出Cr(OH)3溶于NaOH的离子方程式______________________。
(2)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(3)常温下,向50 mL 0.005 mol·L−1的Cr2(SO4)3溶液中加入0.24 mol·L−1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(4)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L−1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L−1。
(5)利用图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电
源的______极,Na2CrO4生成Na2Cr2O7的离子方程式_______________________。若左
侧电极产生标况下2.24L的气体,则通过交换膜的钠离子的数目为______________。
高二化学参考答案
1-16 CCDAB CDBBB BADCB B
17.(16分,除注明外每空2分)
(1)逆(1分) 不变(1分)
(2)中 碱
(3)①H2A===2H++A2- ②3 ③C ④c()>c(A2-)>c(H+)>c(OH-)
18.(11分)
I.(每空1分)(1)a+b<c+d (2)固体或液体 (3)增大 (4)放热 (5)a+b<c+d
II.(每空2分)(1)0.25 (2)正 (3)ADE
19.(10分,除注明外每空2分)
(1)>(1分) >(1分)
(2)①0.005 mol • L-1• min-1 ②AB ③移走 0.1 molNH3 =
20.(15分,除注明外每空2分)
(1)Cr(OH)3+OH-=CrO2-+2H2O
(2)1.0×10−32
(3)13
(4)①酸式(1分) 润洗(1分) ②5cd/6b
(5)正(1分) 2CrO4-+2H+=Cr2O72-+H2O 0.2NA(1.204×1023)