- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高中化学 第三章 自然界中的元素 第1节 碳的多样性学案 鲁科版必修1
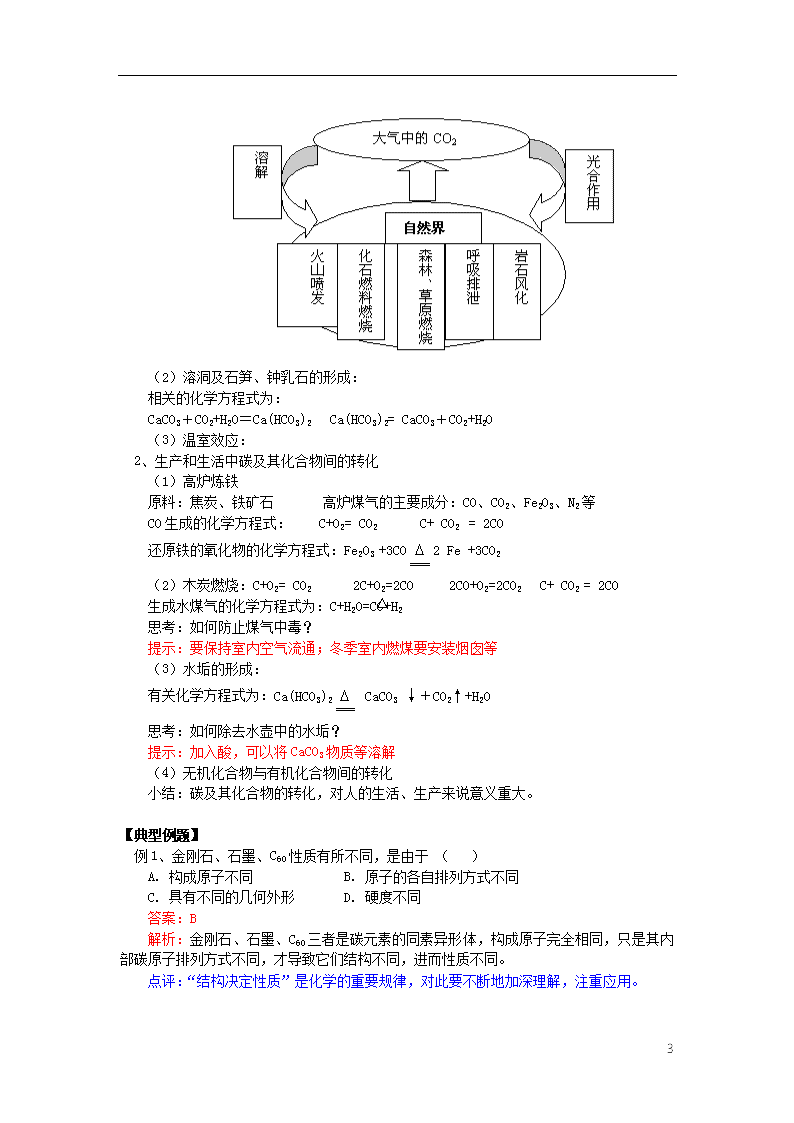
第3章 第1节 碳的多样性 【本讲教育信息】 一. 教学内容: 第3章 第1节 碳的多样性 二. 教学目的 1、了解同素异形体的概念,知道碳的三种同素异形体和其物理性质的差异及其原因; 2、知道含碳化合物种类及其分类,认识碳酸钠和碳酸氢钠的性质并体会其差异; 3、据生产、生活实例,了解碳单质、一氧化碳、二氧化碳、碳酸盐、碳酸氢盐之间的转化,能解释水垢的形成与消除、木炭燃烧的现象、工业上炼铁的原理等。 三. 教学重点、难点 碳元素之间的转化,碳酸钠和碳酸氢钠的性质 四. 知识分析 碳在自然界中的存在: 游离态和化合态, 化石燃料是指:煤、石油、天然气。 (一)多种多样的碳单质 1、金刚石: (1)性质及应用:硬度极高、无色透明的晶体。可用于做装饰品、切割玻璃及大理石等。 (2)结构:每个碳原子都与相邻的四个碳原子以较强的相互作用直接连接,形成正四面体结构。 2、石墨: (1)性质及应用:深灰色、质软、不透明、易导电的片状固体。常用于做电极、铅笔芯等。 (2)结构:碳原子呈层状排列,每一层上的碳原子以较强的相互作用形成平面六边形结构,层与层作用较弱,可以相对滑动。 3、C60分子: (1)性质及应用:灰黑色的固体。在材料科学、超导体等方面有广泛的用途。 (2)结构:由60个碳原子构成的形似足球的分子,碳原子位于球的表面,呈正六边形和正五边形排列,球内是空的。 4、碳纳米管及其他碳单质:碳纳米管——管状单质。 同素异形体定义:由同种元素组成的性质不同的单质。 思考: ① 同素异形体的成因是什么? ②你所知道的其他元素的同素异形体还有哪些? (解答:① 原子的排列方式不同,结构不同。 ② O2与O3 、 红磷和白磷等) 小结: 1、判断同素异形体的要素:(1)必须由同一元素组成(2)必须是单质(3)必须结构不同 2、不同的同素异形体,物理性质不同,化学性质相似 (二)广泛存在的含碳化合物 1、分类:有机物和无机物 4 2、常见的碳酸盐及其成分 大理石方解石CaCO3 白云石CaMgCO3 菱锌矿ZnCO3 菱镁矿MgCO3 菱铁矿FeCO3 3、重要的两种盐——Na2CO3(碳酸盐)和NaHCO3(碳酸氢盐) (1)主要的物理性质和应用: 化学式 学名 俗名 状态 颜色 溶解度比较 应用 NaHCO3 碳酸氢钠 小苏打 细小晶体 白色 较小 做发酵粉、胃药 Na2CO3 碳酸钠 苏打、纯碱 粉末 白色 较大 制玻璃、造纸 Na2CO3•10H2O 十水合碳酸钠 结晶碳酸钠 晶体 无色 最大 同Na2CO3 (2)主要的化学性质 a 碳酸钠的化学性质 ①与酸 Na2CO3+HCl Na2CO3+CO2+H2O Na2CO3+CH3COOH CO32- +2H+=CO2↑+H2O; CO32-+CO2+H2O=2HCO3- CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- ②与碱 Na2CO3+Ca(OH)2 Na2CO3+Ba(OH)2 CO32-+Ca2+=CaCO3↓ ; CO32-+Ba2+=BaCO3↓ ③与盐 Na2CO3+ CaCl2 Na2CO3+BaCI2 CO32-+Ca2+=CaCO3↓ ; CO32-+Ba2+=BaCO3↓ b 碳酸氢钠的性质 ①与酸NaHCO3 +HCI—— HCO3- +H+=CO2↑+H2O ②与碱NaHCO3+NaOH—— HCO3-+OH-= CO32-+H2O ③受热易分解 NaHCO3—— 2NaHCO3 Na2CO3+ CO2↑+H2O c Na2CO3 与Na2CO3•10H2O之间的转化 Na2CO3溶液结晶生成Na2CO3•10H2O ,Na2CO3•10H2O风化失水变为Na2CO3 。 Na2CO3 与Na2CO3•10H2O在水溶液里的溶质都是Na2CO3。 思考:①如何区分Na2CO3与 NaHCO3两种粉末?请用三种以上的方法。 ② 向饱和Na2CO3溶液中通入过量的CO2气体,有什么现象? ③ 现有50mL1mol•L-1的NaOH溶液和足量的CO2气体,简述制取纯Na2CO3溶液的方法。 简答:①加热法;配成溶液加BaCl2溶液法;配成溶液滴加盐酸法等 ② 溶液变浑浊 ③ 将50mL碱液平分为两等份,向一份中通入过量的CO2,充分反应后,将所得溶液与另一份碱液混和,充分搅拌即可。) 小结: Na2CO3和NaHCO3的相互转化 (三)碳及其化合物间的转化 1、自然界中碳及其化合物间的转化 (1)碳的循环图: 4 (2)溶洞及石笋、钟乳石的形成: 相关的化学方程式为: CaCO3+CO2+H2O=Ca(HCO3)2 Ca(HCO3)2= CaCO3+CO2+H2O (3)温室效应: 2、生产和生活中碳及其化合物间的转化 (1)高炉炼铁 原料:焦炭、铁矿石 高炉煤气的主要成分:CO、CO2、Fe2O3、N2等 CO生成的化学方程式: C+O2= CO2 C+ CO2 = 2CO 还原铁的氧化物的化学方程式:Fe2O3 +3CO2 Fe +3CO2 (2)木炭燃烧:C+O2= CO2 2C+O2=2CO 2CO+O2=2CO2 C+ CO2 = 2CO 生成水煤气的化学方程式为:C+H2O=CO+H2 思考:如何防止煤气中毒? 提示:要保持室内空气流通;冬季室内燃煤要安装烟囱等 (3)水垢的形成: 有关化学方程式为:Ca(HCO3)2 CaCO3 ↓+CO2↑+H2O 思考:如何除去水壶中的水垢? 提示:加入酸,可以将CaCO3物质等溶解 (4)无机化合物与有机化合物间的转化 小结:碳及其化合物的转化,对人的生活、生产来说意义重大。 【典型例题】 例1、金刚石、石墨、C60性质有所不同,是由于 ( ) A. 构成原子不同 B. 原子的各自排列方式不同 C. 具有不同的几何外形 D. 硬度不同 答案:B 解析:金刚石、石墨、C60三者是碳元素的同素异形体,构成原子完全相同,只是其内部碳原子排列方式不同,才导致它们结构不同,进而性质不同。 点评:“结构决定性质”是化学的重要规律,对此要不断地加深理解,注重应用。 4 例2、把7.4gNa2CO3•10H2O和NaHCO3组成的混合物溶于水,配成100mLD 溶液,其中c(Na+)=0.6mol/L.若把等质量的混合物加热到恒重时,残留物的质量是( ) A. 3.18g B. 2.21g C. 5.28g D. 4.22g 答案:A 解析:混合物加热最终得到的是Na2CO3,根据Na+守恒, n (Na2CO3)=1/2 n(Na+)=1/2×0.1L×0.6mol/L=0.03mol 所以,m(Na2CO3)=0.03mol×106g/mol=3.18g 点评:守恒法是常用的解题方法,使用时关键认真分析题意,要找准不变量,忽略了繁杂过程,使问题变得简单易解。 例3、现有25mL 2mol/L的Na2CO3 溶液和75mL 1mol/L的稀盐酸,①将Na2CO3溶液缓缓滴加到盐酸中 ②将稀盐酸缓缓滴加到Na2CO3溶液中,在标准状况下产生的气体情况是( ) A. 均为0.84L B. 均为0.56L C. ①>② D. ①<② 答案:C 解析:虽然都是Na2CO3与盐酸反应,但滴加顺序不同,结果产生的CO2的量不一定相同。 ①将Na2CO3溶液滴入盐酸中,刚开始盐酸过量: Na2CO3 +2HCl=2NaCl+CO2+H2O 应按盐酸的量计算气体体积:V1=22.4L/mol×0.075mol×1/2=0.84L ②将盐酸滴入Na2CO3溶液中,反应分两步: Na2CO3 +HCl=NaCl+NaHCO3 ;NaHCO3+HCl=NaCl+CO2+H2O 生成的CO2用第二步余下的盐酸计算:V2=(0.075mol-0.05mol)×22.4L=0.56L 所以V1>V2 点评:本题考查的是Na2CO3 与盐酸反应时,滴加顺序不同时,产生的气体体积也不同,计算时,要分析清楚化学反应的过程,正确写出反应式是关键。 例4、近年来大气中CO2增多引起“温室效应”,请回答有关问题: (1)空气中CO2的主要来源是什么? (2)自然界中消耗CO2的主要过程是哪些? 答案:(1)含碳燃料的大量燃烧。 (2)溶于江水、海水; 绿色植物的光合作用;岩石的风化等。 解析:尽管二氧化碳的产生途径很多,但是大量化石燃料的燃烧是产生二氧化碳的主要来源。 由于江、海的面积大,将溶解大量二氧化碳,光合作用、岩石的风化也将消耗大量二氧化碳。 点评:本题引导学生要关注生活、关注环境问题,做到学以致用,这是新课程的重要精神。 4查看更多