2021新高考化学二轮总复习学案:热点专攻(八) 水溶液中离子平衡的图像分析 Word版含解析
www.ks5u.com
热点专攻(八)
水溶液中离子平衡的图像分析
常以酸碱中和反应和电离平衡、沉淀溶解平衡建立过程中离子浓度变化曲线、pH变化曲线等为设计背景。主要命题点有电解质电离方程式的书写、水电离程度的比较、离子浓度的等量关系、离子浓度大小的比较、电离常数的计算、pH的计算及溶度积的计算等,侧重考查考生分析问题的能力。
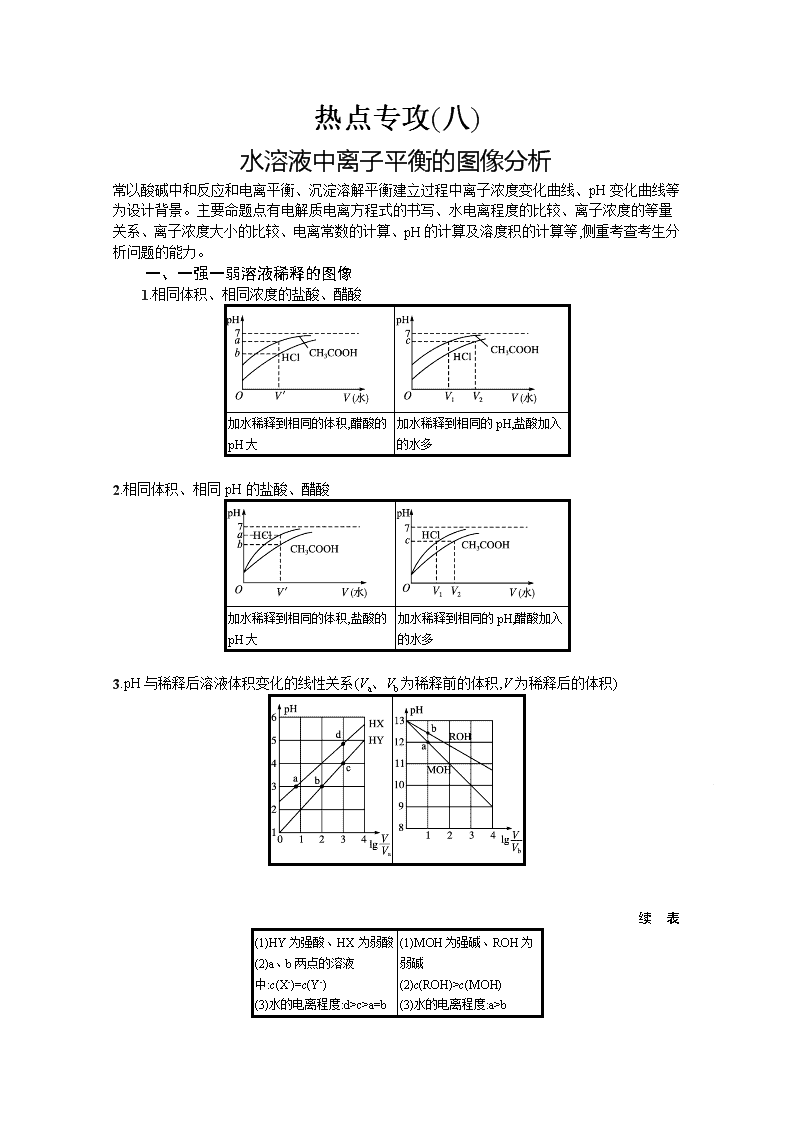
一、一强一弱溶液稀释的图像
1.相同体积、相同浓度的盐酸、醋酸
加水稀释到相同的体积,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
2.相同体积、相同pH的盐酸、醋酸
加水稀释到相同的体积,盐酸的pH大
加水稀释到相同的pH,醋酸加入的水多
3.pH与稀释后溶液体积变化的线性关系(Va、Vb为稀释前的体积,V为稀释后的体积)
续 表
(1)HY为强酸、HX为弱酸
(2)a、b两点的溶液中:c(X-)=c(Y-)
(3)水的电离程度:d>c>a=b
(1)MOH为强碱、ROH为弱碱
(2)c(ROH)>c(MOH)
(3)水的电离程度:a>b
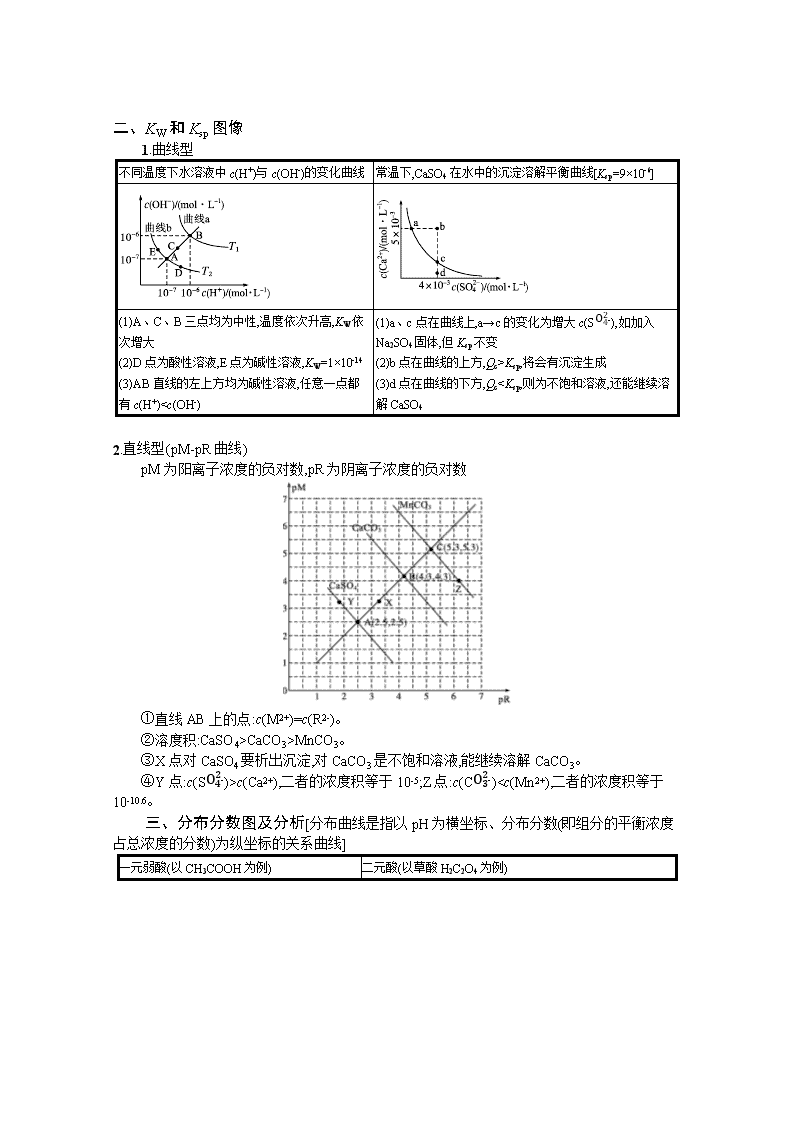
二、KW和Ksp图像
1.曲线型
不同温度下水溶液中c(H+)与c(OH-)的变化曲线
常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6]
(1)A、C、B三点均为中性,温度依次升高,KW依次增大
(2)D点为酸性溶液,E点为碱性溶液,KW=1×10-14
(3)AB直线的左上方均为碱性溶液,任意一点都有c(H+)
Ksp,将会有沉淀生成
(3)d点在曲线的下方,QcCaCO3>MnCO3。
③X点对CaSO4要析出沉淀,对CaCO3是不饱和溶液,能继续溶解CaCO3。
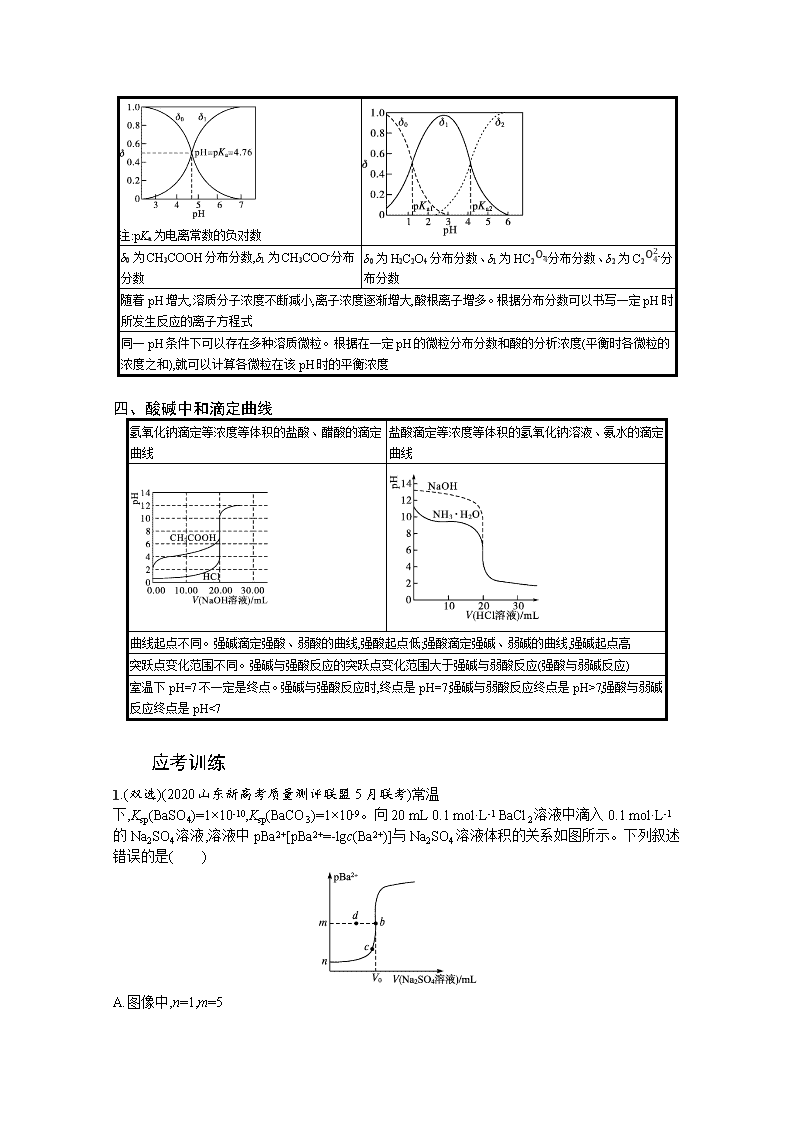
④Y点:c(SO42-)>c(Ca2+),二者的浓度积等于10-5;Z点:c(CO32-)7,强酸与弱碱反应终点是pH<7
应考训练
1.(双选)(2020山东新高考质量测评联盟5月联考)常温下,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。向20 mL 0.1 mol·L-1 BaCl2溶液中滴入0.1 mol·L-1的Na2SO4溶液,溶液中pBa2+[pBa2+=-lgc(Ba2+)]与Na2SO4溶液体积的关系如图所示。下列叙述错误的是( )
A.图像中,n=1,m=5
B.若起始时c(BaCl2)=0.2 mol·L-1,m不变,b点向d点移动
C.若用同浓度的Na2CO3溶液替代Na2SO4溶液,可使b点向c点移动
D.V0时向溶液中滴加Na2CO3溶液,产生BaCO3沉淀的条件是c(CO32-)c(SO42-)>10
2.(2020湖南长郡中学适应性考试)配离子的稳定性可用K不稳衡量,例如[Ag(NH3)2]+的K不稳=c(Ag+)·c2(NH3)c{[Ag(NH3)2]+}。在一定温度下,向0.1 mol·L-1硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=n(X)c(Ag+)+c{[Ag(NH3)2]+}{X代表Ag+或[Ag(NH3)2]+}。下列说法不正确的是( )
Ag+和[Ag(NH3)2]+的分布系数图
A.图中δ2代表的是δ{[Ag(NH3)2]+}
B.向溶液中滴入稀硝酸,δ(Ag+)减小
C.该溶液中c(NH4+)+c(H+)=c(OH-)
D.该温度时,K不稳{[Ag(NH3)2]+}=10-7.3
3.(双选)(2020山东德州一模)常温下,向V mL 0.1 mol·L-1 HA溶液中滴入0.1 mol·L-1 NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( )
A.常温下,Ka(HA)约为10-5
B.P点溶液对应的pH=7
C.M点溶液中存在:c(Na+)=c(A-)+c(HA)
D.N点溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+)
4.(双选)(2020山东济宁三模)常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得沉淀的溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgCl)的数量级为10-10。下列叙述不正确的是( )
A.Ksp(Ag2C2O4)的数量级为10-11
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O42-(aq)的平衡常数为10-0.71
5.(2020辽宁部分重点中学协作体模拟)用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化,已知加入30 mL NaOH溶液后混合溶液呈碱性)。下列叙述不正确的是( )
A.Ka2(H2SO3)的数量级为10-8
B.向X点溶液中加入少量澄清石灰水溶液,c(SO32-)c(HSO3-)的值增大
C.若将NaHSO3与Na2SO3按物质的量之比1∶1混合对应的点应在Y、Z之间
D.图中溶液中水的电离程度:Wc(HAsO42-)>c(OH-)>c(H2AsO4-)>c(AsO43-)
C.向H3AsO4溶液滴加NaOH溶液至中性时c(Na+)=2c(HAsO42-)+3c(AsO43-)
D.AsO43-第一步水解的平衡常数的数量级为10-3
7.(双选)(2020山东济南二模)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
A.图中a、b、c、d四个点,水的电离程度最大的是d点
B.a点处存在c(NH4+)+c(NH3·H2O)=0.1 mol·L-1
C.b点处存在c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.由b到c发生反应的离子方程式为NH4++OH-NH3·H2O
8.(双选)(2020江苏苏锡常镇四市教学情况调查)25 ℃时,将SO2通入NaOH溶液得到一组c(H2SO3)+c(HSO3-)+c(SO32-)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度与pH的关系曲线如下图所示。下列叙述正确的是( )
A.H2SO3的Ka2=10-7.2
B.pH=1.9的溶液中:c(Na+)>c(H2SO3)=c(HSO3-)>c(SO32-)
C.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
D.c(HSO3-)=0.050 mol·L-1的溶液中:c(H+)+c(Na+)<0.150 mol·L-1+c(OH-)
热点专攻(八) 水溶液中离子平衡的图像分析
应考训练1.BC 解析图像中起始时对应0.1mol·L-1BaCl2溶液,此时pBa2+=-lgc(Ba2+)=-lg0.1=1,因此n=1,b点时恰好完全反应,c(Ba2+)=Ksp(BaSO4)mol·L-1=1×10-10mol·L-1=1×10-5mol·L-1,pBa2+=-lgc(Ba2+)=-lg1×10-5=5,因此m=5,故A正确;若起始时c(BaCl2)=0.2mol·L-1,m不变,则加入的Na2SO4溶液体积增大,因此b点应该向右移动,故B错误;BaCO3的溶度积大于BaSO4的溶度积,恰好完全反应生成碳酸钡时,钡离子浓度大,pBa2+值小,而用等浓度的Na2CO3溶液替代Na2SO4溶液,消耗的碳酸钠溶液和Na2SO4溶液体积相同,因此b点应竖直向下迁移,故C错误;V0时向溶液中滴加Na2CO3溶液,c(CO32-)c(SO42-)=Ksp(BaCO3)Ksp(BaSO4)=1×10-91×10-10=10,因此产生BaCO3沉淀的条件是c(CO32-)c(SO42-)>10,故D正确。
2.B 解析向0.1mol·L-1硝酸银溶液中滴入稀氨水,随着氨水的加入,n(Ag+)逐渐减少,n{[Ag(NH3)2]+}逐渐增大,即δ(Ag+)减少,δ{[Ag(NH3)2]+}增大,结合图像变化趋势,δ(Ag+)随着pNH3的增大而增大,所以δ1代表的是δ(Ag+),δ2代表的是δ{[Ag(NH3)2]+},A项正确;NH3与H+反应生成NH4+,使反应Ag++2NH3[Ag(NH3)2]+逆向移动,c(Ag+)增大,则向溶液中滴入稀硝酸,δ(Ag+)增大,B项错误;溶液中电荷守恒关系为c(Ag+)+c{[Ag(NH3)2]+}+c(NH4+)+c(H+)=c(OH-)+c(NO3-),物料守恒关系为:c(Ag+)+c{[Ag(NH3)2]+}=c(NO3-),整理两式可得c(NH4+)+c(H+)=c(OH-),C项正确;a点时,c(Ag+)=c{[Ag(NH3)2]+},pNH3=3.65,则c(NH3)=10-3.65mol·L-1,K不稳{[Ag(NH3)2]+}=c2(NH3)=(10-3.65)2=10-7.3,D项正确。
3.BC 解析由示意图可知,0.1mol·L-1HA溶液中水电离出的氢离子浓度为10-11mol·L-1,溶液中氢离子浓度为10-3mol·L-1,则Ka(HA)=c(H+)·c(A-)c(HA)≈1×10-3×1×10-30.1=10-5,故A正确;P点为NaA和NaOH的混合溶液,溶液呈碱性,溶液的pH>7,故B错误;M点为HA和NaA的混合溶液,溶液呈中性,溶液中c(OH-)=c(H+),由电荷守恒可得c(Na+)+c(H+)=c(A-)+c(OH-)可知,溶液中c(Na+)=c(A-),故C错误;N点水电离出的氢离子浓度的负对数最小,水电离出的氢离子浓度最大,说明HA溶液与NaOH溶液恰好完全反应生成NaA,A-在溶液中水解使溶液呈碱性,溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+),故D正确。
4.BD 解析若曲线X为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)·c(Cl-)=10-4×10-5.75=10-9.75=100.25×10-10,则数量级为10-10,若曲线Y为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)·c(Cl-)=10-4×10-2.46=10-6.46=100.54×10-7,则数量级为10-7,由题意可知Ksp(AgCl)的数量级为10-10,则曲线X为AgCl的沉淀溶解平衡曲线,则曲线Y为Ag2C2O4
的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=c2(Ag+)·c(C2O42-)=(10-4)2×(10-2.46)=10-10.46。由以上分析知,曲线Y为Ag2C2O4的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=100.54×10-11,则Ksp(Ag2C2O4)的数量级为10-11,故A正确;曲线Y为Ag2C2O4的沉淀溶解平衡曲线,n点的离子积Qc(Ag2C2O4)c(AsO43-),同时水也电离出氢氧根离子,故溶液中离子浓度关系为c(Na+)>c(HAsO42-)>c(OH-)>c(H2AsO4-)>c(AsO43-),B正确;向H3AsO4溶液滴加NaOH溶液至中性时,溶液c(H+)=c(OH-),此时溶液中不存在AsO43-,结合电荷守恒可得
c(Na+)=2c(HAsO42-)+c(H2AsO4-),C错误;当pH=11.5时,c(HAsO42-)=c(AsO43-),求得Ka3=c(H+)·c(AsO43-)c(HAsO42-)=10-11.5,则AsO43-第一步水解的平衡常数Kb1=KWKa3=10-1410-11.5=10-2.5,其数量级为10-3,D正确。
7.CD 解析根据反应量的关系可知,a点恰好消耗完H+,溶质为(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3·H2O;(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,b点溶液呈中性,所以a点水的电离程度最大,A错误;等体积混合后浓度变为原来的一半,a点溶质为(NH4)2SO4与Na2SO4,根据物料守恒可知,c(NH4+)+c(NH3·H2O)=c(SO42-)=0.05mol·L-1,B错误;b点溶液显中性,溶质为(NH4)2SO4、Na2SO4和NH3·H2O,NH4+会水解,离子浓度大小关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),C正确;b点溶液为中性溶液,溶质为(NH4)2SO4、Na2SO4和NH3·H2O,再加入NaOH溶液,发生的离子反应为NH4++OH-NH3·H2O,D正确。
8.AD 解析当pH=7.2时,c(H+)=10-7.2mol·L-1,此时c(SO32-)=c(HSO3-),H2SO3的二级电离方程式为HSO3-H++SO32-,则H2SO3的Ka2=c(SO32-)·c(H+)c(HSO3-)=10-7.2,故A正确;根据图像可知,pH=1.9时,溶液中不含SO32-,故B错误;溶液中存在电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(Na+)=0.100mol·L-1时,c(H2SO3)+c(HSO3-)+c(SO32-)=c(Na+),代入电荷守恒式中可得c(H+)+c(H2SO3)=c(OH-)+c(SO32-),故C错误;根据c(H2SO3)+c(HSO3-)+c(SO32-)=0.100mol·L-1,溶液中的c(HSO3-)=0.050mol·L-1,则c(H2SO3)+c(SO32-)=0.05mol·L-1,根据溶液中的电荷守恒可得c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)=2×[0.05mol·L-1-c(H2SO3)]+0.05mol·L-1+c(OH-)=0.150mol·L-1+c(OH-)-2c(H2SO3),则c(H+)+c(Na+)<0.150mol·L-1+c(OH-),故D正确。