- 2021-08-24 发布 |
- 37.5 KB |
- 3页

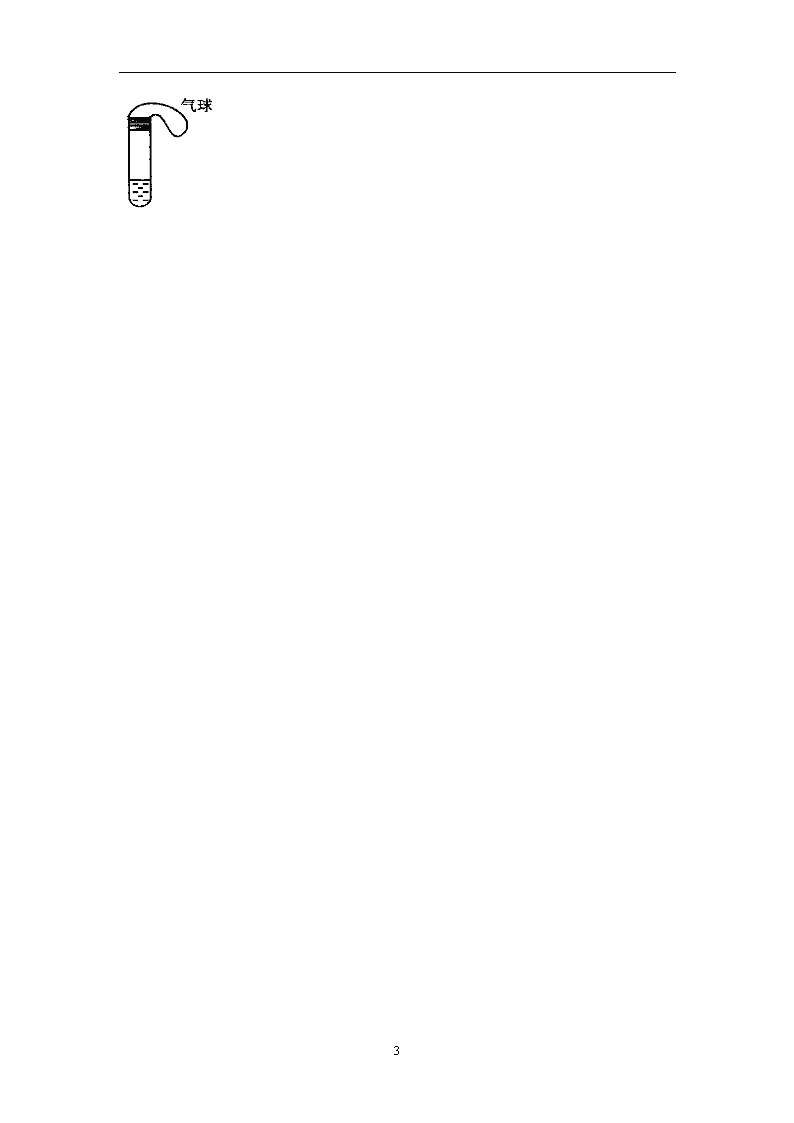
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氮肥的生产和使用导学案
4.2.2 氮肥的生产和使用 导学案 学习目标:掌握氨及铵盐的性质和用途,了解液氨和氨水的区别;知道氮肥的性能和使用氮肥的注意事项;知道氮肥的应用对社会生产的作用和对自然环境的影响。 学习过程: 【自主学习】 阅读课本98~99页 1.氨是无色、有______气味的气体;密度比空气____;______溶于水且能快速溶解,在常温、常压下1体积水能溶解____体积氨。证明氨极易溶于水的实验是___________。 2.工业上如何制备氨气?写出化学反应方程式。 3.常见的铵盐有:______、______、______。铵盐是____溶于水的____色晶体。 4.化学氮肥主要包括铵态氮肥(主要成分为______ )、硝态氮肥(主要成分为_______)和有机态氮肥——尿素_______ 。 5.铵盐如何保存和使用?农家肥主要成分为K2CO3,能否与铵肥一起使用?为什么? 6.目前含氮量最高的氮肥是 (写出化学式)。 【实验探究】 1.氨的喷泉实验 (1)实验操作要点?(2)实验观察到的现象?(3)为什么能形成喷泉? 2. 氨的化学性质 (1)氨与水反应 氨水中含有哪些微粒? ,氨水溶液显 ,(填“酸性”或“碱性”)它能使酚酞试液变 。请写出有关方程式:_____________ 。 (2)氨与酸反应 写出氨气与盐酸、硫酸反应的方程式。 , ★总结:挥发性的强酸与氨气在空气中相遇便产生_________的现象,如HCl,HBr,HI、HNO3等遇氨气均有该现象产生,而H2SO4、H3PO4无此现象。 3.铵盐的性质 (1)铵盐的受热分解 氯化铵、碳酸氢铵受热会发生分解反应。写出有关化学方程式。 ________________________________ ,______________________________________ (2)铵盐与碱反应 写出硫酸铵、硝酸铵与氢氧化钠溶液反应的化学方程式: , 如何检验铵根离子的存在?离子方程式为_______________________ (3)NH3的实验室制法 3 实验室一般用______与_____混合加热来制取氨气。写出P99活动与探究实验2中涉及的化学方程式。 实验室还有什么方法可以制备少量氨气? 氨气的收集与验满:用_______ 收集,并用________ _检验氨所是否收集满。 【典型例题】 例1、题目见“同步导学”P86第6题。 ★选做 例2、在标准状况下,用以下气体做喷泉实验,请根据情况,填写烧瓶中溶液的物质的量浓度(假设烧瓶中溶质不能扩散出来)。 (1)用氯化氢气体做喷泉实验,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为_______; (2)用NH3做喷泉实验,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为_______ ; (3)用NO2气体做喷泉实验,喷泉结束后,水充至烧瓶容积的2/3处,则溶液的物质的量浓度为________; 【巩固练习】 1~5均是B 级题,6题为C级题。 1.能鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液(可以加热)的一种试剂是( ) A.BaCl2 B.Ba(NO3)2 C.Ba(OH)2 D.AgNO3 2.用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是 ( ) 3.氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( ) A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性 C.该反应属于复分解反应 D.生成1molN2有6mol电子转移 4.在下列变化:①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是 ( ) A.①②③ B.②①③ C.③②① D.③①② 5.某学生课外活动小组利用下图所示装置分别做如下实验: (1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅, 冷却后恢复红色,则原溶液可能是______ 溶液;加热时溶液 由红色逐渐变浅的原因是 。 (2)在试管中注入某无色溶液,加热试管,溶液变为红色, 冷却后恢复无色,则此溶液可能是 溶液;加热时溶液 由无色变为红色的原因是 。 6.题目见“同步导学”P86第8题。 3 3查看更多