辽宁师大附中2021届高三化学上学开学试卷(Word版附答案)
辽宁师大附中 高二化学 第 1 页 共 10 页
辽宁师大附中 2019—2020 学年度下学期期末考试
高二化学试题
考试时间:90 分钟 满分:100 分
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 Fe 56 Cu 64 Co 59
第 Ⅰ 卷 选择题(共 60 分)
一、选择题:本题共 10 个小题,每小题 2 分,共 20 分。在每小题给出的四个选项中,
只有一个正确答案。
1.在全国人民众志成城抗击新冠病毒期间,使用的“84 消毒液”的主要有效成分是
A. NaOH B. NaCl C. NaClO D. Na2CO3
2.下列关于 C、Si 及其化合物结构与性质的论述错误的是
A. 键能 、 ,因此 C2H6 稳定性大于 Si2H6
B. 立方型 SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度和熔点
C. 常温下 C、Si 的最高价氧化物晶体类型相同,性质相同。
D. Si 原子间难形成双键而 C 原子间可以,是因为 Si 的原子半径大于 C,难形成
键
3.在给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.S SO3 H2SO4
B.Cu2(OH)2CO3 CuSO4(aq) Cu
C.SiO2 Si SiCl4 Si
D.Mg(OH)2 MgCl2(aq) Mg
4.下列离子方程式书写正确的是
A. CaCO3 与醋酸反应:
B. FeI2 溶液与足量溴水反应:
C. NaOH 溶液与过量 H2C2O4 溶液反应:
D. Na 与水反应: 2Na + 2H2O = 2Na+ +2OH- + H2↑
5.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系
C C>Si Si— — C H>Si H— —
p pπ—
→ 点燃/O2 → OH2
→ 42SOH → aN
→ 高温/C → 高温/lC 2 → 高温/H2
→盐酸 →电解
2- +
3 2 2CO +2H =H O+CO ↑
2+ 3+ -
22Fe +Br =2Fe +2Br
- 2-
2 2 4 2 4 2H C O +2OH =C O +2H O
辽宁师大附中 高二化学 第 2 页 共 10 页
如下图所示(反应条件己略去)。下列有关物质的推断正确的是
甲 乙 丙 丁
A N2 NO NO2 O2
B SO32- HSO3- SO2 H+
C Cl2 FeCl3 FeCl2 Fe
D Al3+ Al(OH)3 AlO2- NH3·H2O
6.化学在生活中有着广泛的应用。下列对应关系错误的是
选项 化学性质 实际应用
A ClO2 具有强氧化性 自来水消毒杀菌
B SO2 具有还原性 用作漂白剂
C NaHCO3 受热分解并且生成气体 焙制糕点
D Al(OH)3 分解吸收大量热量并有 H2O 生成 阻燃剂
7.化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 实际应用
A Al2(SO4)3 和小苏打反应 泡沫灭火器灭火
B 铁比铜金属性强 FeCl3 腐蚀 Cu 刻制印刷电路板
C 次氯酸盐具有氧化性 漂白粉漂白织物
D HF 与 SiO2 反应 氢氟酸在玻璃器皿上刻蚀标记
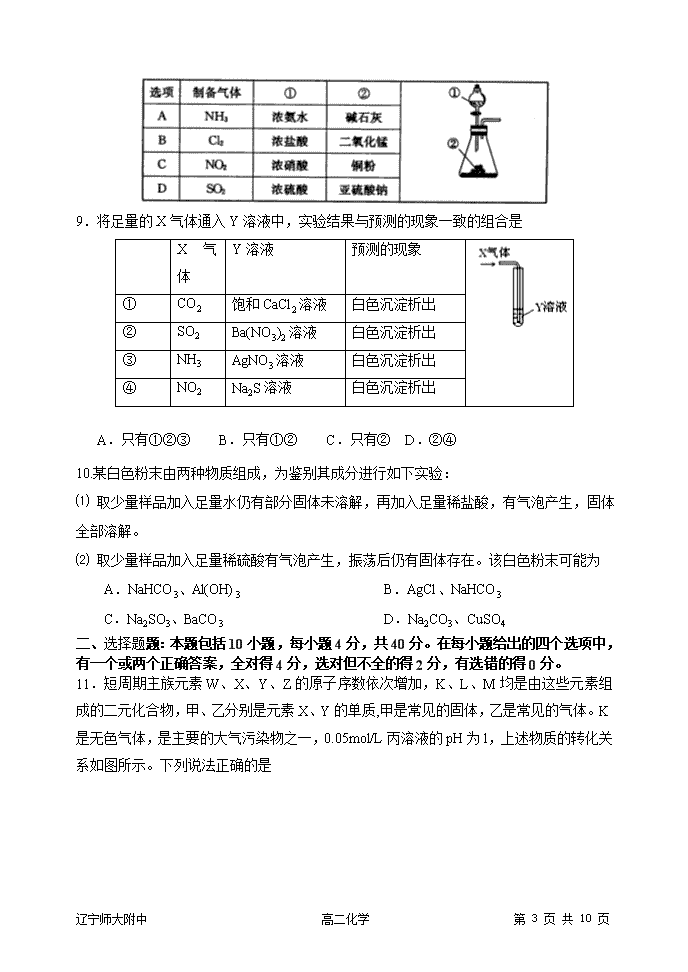
8.利用表中药品及图示装置不能制取的气体是
辽宁师大附中 高二化学 第 3 页 共 10 页
9.将足量的 X 气体通入 Y 溶液中,实验结果与预测的现象一致的组合是
X 气
体
Y 溶液 预测的现象
① CO2 饱和 CaCl2 溶液 白色沉淀析出
② SO2 Ba(NO3)2 溶液 白色沉淀析出
③ NH3 AgNO3 溶液 白色沉淀析出
④ NO2 Na2S 溶液 白色沉淀析出
A.只有①②③ B.只有①② C.只有② D.②④
10.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
⑴ 取少量样品加入足量水仍有部分固体未溶解,再加入足量稀盐酸,有气泡产生,固体
全部溶解。
⑵ 取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为
A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3
C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
二、选择题题:本题包括 10 小题,每小题 4 分,共 40 分。在每小题给出的四个选项中,
有一个或两个正确答案,全对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11.短周期主族元素 W、X、Y、Z 的原子序数依次增加,K、L、M 均是由这些元素组
成的二元化合物,甲、乙分别是元素 X、Y 的单质,甲是常见的固体,乙是常见的气体。K
是无色气体,是主要的大气污染物之一,0.05mol/L 丙溶液的 pH 为 l,上述物质的转化关
系如图所示。下列说法正确的是
辽宁师大附中 高二化学 第 4 页 共 10 页
A.原子半径:W
Y>X
C.化合物 XYZ 中只含共价键 D.K、L、M 中沸点最高的是 M
12.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示,下列说法正
确的是
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为 NO2
B.②中溶液存在:c(Cu2+) + c(H+) = c(NO3-) + c(OH-)
C.由上述实验得出结论:常温下,Cu 既可与稀硝酸反应,也可与稀硫酸反应
D.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4 === 4CuSO4 +2NO↑+4H2O
13.某学生鉴定甲盐溶液的流程如图所示,下列说法正确的是
A.若乙为白色沉淀,则甲可能含有 SiO32﹣
B.若乙为黄色沉淀,则甲可能为 FeI3
C.若乙为浅黄色沉淀,则甲可能含有 S2﹣
D.若乙为浅黄色沉淀,则甲可能是 FeBr2
14.如图是制取、净化并测量生成气体体积的装置示意图。利用如图装置进行下表所列
实验,能达到实验目的的是
丙 的 浓
溶液
甲
K
L
M
加热
丙L、乙
辽宁师大附中 高二化学 第 5 页 共 10 页
选项 a(液体) b(固体) c(液体)
A 稀盐酸 锌粒 浓硫酸
B 浓氨水 生石灰 浓硫酸
C 饱和食盐水 电石 硫酸铜溶液
D 浓硫酸 Cu 片 氢氧化钠溶液
15.有一稀硫酸和稀硝酸的混合酸,其中 H2SO4 和 HNO3 的物质的量浓度分别是 4mol/L
和 2mol/L,取 10mL 此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状
况下的混合气体体积为(设反应中 HNO3 被还原成 NO)
A.0.448L B.0.672L C.0.896L D.0.224L
16.下列各组微粒的空间构型相同的是
①NH3 和 H2O②NH4+ 和 H3O+③NH3 和 H3O+ ④O3 和 SO2⑤CO2 和 BeCl2⑥SiO44- 和
SO42-⑦BF3 和 Al2Cl6
A.全部 B.除④⑥⑦以外
C.③④⑤⑥ D.②⑤⑥
17.下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性 ②
离子晶体是一定含有金属阳离子的晶体 ③共价键可决定分子晶体的熔、沸点 ④干
冰晶体中,每个 CO2 分子周围紧邻 12 个 CO2 分子 ⑤晶胞是晶体结构的基本单元,晶
体内部的微粒按一定规律作周期性重复排列 ⑥晶体尽可能采取紧密堆积方式,以使其
变得比较稳定 ⑦36 g 金刚石晶体和 36 g 石墨晶体含有的 C—C 键数目相同
A.①②③ B.②③④ C.④⑤⑥ D.②③⑦
18. 下列现象与氢键有关的是
①NH3 的熔、沸点比 VA 族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比
辽宁师大附中 高二化学 第 6 页 共 10 页
互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻
羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
19.从中草药中提取的 calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于
calebin A 的说法错误的是
A. 可与 FeCl3 溶液发生显色反应
B. 其酸性水解的产物均可与 Na2CO3 溶液反应
C. 苯环上氢原子发生氯代时,一氯代物有 3 种
D. 1mol 该分子最多与 8molH2 发生加成反应
20.下列操作不能达到实验目的的是
目的 操作
A 除去苯中少量的苯酚 加入适量溴水溶液,振荡、静置、过滤
B 证明酸性:碳酸>苯酚
将盐酸与 NaHCO3 混合产生的气体直接通入苯酚钠
溶液
C 除去碱式滴定管胶管内的气泡 将尖嘴向上弯曲,挤压胶管内玻璃球将气泡排出
D
配制用于检验醛基的氢氧化铜
悬浊液
向试管中加入 2mL10%NaOH 溶液,再滴加数滴
2%CuSO4 溶液,振荡
第 Ⅱ 卷 非选择题(共 40 分)
21.(16 分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用
辽宁师大附中 高二化学 第 7 页 共 10 页
下图装置(部分装置省略)制备 KClO3 和 NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放浓盐酸的仪器名称是________,a 中的试剂为________。
(2)c 中采用冰水冷却方式的目的是_________,c 中化学反应的离子方程式是
________________。
(3)d 的作用是________,可选用试剂________(填标号)。
A.Na2SO3 B.NaCl C.Ca(OH)2 浊液 D.H2SO4
(4)反应结束后,取出 b 中试管,经冷却结晶,________,__________,干燥,得到KClO3
晶体。
(5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液。1 号试
管溶液颜色不变。2 号试管溶液变为棕色,滴入少量 CCl4 溶液显紫色,请写出该反应的
离子方程式 。
22.(12 分)用软锰矿(主要成分为 MnO2,含少量 Fe3O4、Al2O3)和 BaS 制备高纯 MnCO3
的工艺流程如下:
已知:MnO2 是一种两性氧化物;25℃时相关物质的 Ksp 见下表。
辽宁师大附中 高二化学 第 8 页 共 10 页
物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2
Ksp
回答下列问题
(1)软锰矿预先粉碎的目的是 ,
MnO2 与 BaS 溶液反应转化为 MnO 的化学方程式为 。
(2)碳化过程中发生反应的离子方程式为______________________。
(3)滤液 I 可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂 X 为________(填化学式),再加入氨水的目的是 。
(5)检验碳酸锰沉淀是否洗涤干净的操作为 。
23.(12 分)H、C、N、O 是常见的非金属元素;Fe、Co、Ni 是三种重要的金属元素。回
答下列有关它们单质或化合物的问题:
(1)Fe、Co、Ni 在周期表中的位置为_________,基态 Fe 原子的价电子排布式为
__________。
(2) C、 N、O、Fe 的第一电离能由大到小的顺序为 , C、 N、O 最简
单氢化物的沸点由高到低的顺序为 。
(3)C2H2 分子中空间构型为 ,N2H4 分子中心原子的杂化方式为 。
(4)Fe、Co、Ni 能与 C12 反应,其中 Co 和 Ni 均生成二氯化物,由此推断 FeCl3、CoCl3
和 Cl2 的氧化性由强到弱的顺序为 ,Co(OH)3 与盐酸反应有黄绿色气体生成,
写出反应的离子方程式: 。
(5)CoO 的面心立方晶胞如图所示。三种元素二价氧化物的晶胞类型相同,其熔点由高到
低的顺序为_______。设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为
______g﹒cm-3。
16.31 10−× 38.61 10−× 32.31 10−× 12.71 10−×
辽宁师大附中 高二化学 第 9 页 共 10 页
辽宁师大附中 2019—2020 学年度下学期期末考试
高二化学试题答案
一、每题 2 分
1C 2C 3C 4D 5B 6B 7B 8B 9C 10C
二、每题 4 分
11C 12D 13D 14C 15B 16C 17D 18B 19CD 20AB
21.(16 分,除注明空 1 分外,其余每空 2 分)
(1). 分液漏斗 饱和食盐水
(2). 避免生成 NaClO3 Cl2+2OH−=ClO−+Cl−+H2O
(3). 吸收尾气(Cl2) C
(4). 过滤 少量(冷)水洗涤 (每空 1 分)
(5). ClO−+ 2I−+H2O = I2+Cl−+2OH_
辽宁师大附中 高二化学 第 10 页 共 10 页
22.(12 分,除注明空 1 分外,其余每空 2 分)
(1). 增大接触面积,充分反应,提高反应速率:
(2).
(3).蒸发 (1 分)
(4).H2O2 (1 分) 调 PH 促进 Fe3+和 Al3+水解并生成沉淀
(5).取最后一次洗涤液,加入盐酸酸化的氯化钡溶液,若无白色沉淀则洗涤干净。
23.(12 分,除注明空 2 分外,其余每空 1 分)
(1).第四周期第 VIII 族, 3d64s2(2).N﹥O﹥C﹥Fe ,H2O ﹥NH3﹥ CO2
(3).直线形 sp3
(4) CoCl3>Cl2>FeCl3 2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O (2 分)
(5).NiO>CoO>FeO (2 分)
2 2 2MnO BaS H O Ba(OH) MnO S+ + = + +
2
3 3 2 3 4 2Mn HCO NH H O MnCO NH H O+ − ++ + ⋅ = + +↓
32
3
A
3 10a N
×