2021届高考化学一轮复习电解原理及其应用作业
考点20 电解原理及其应用
[题组一 基础小题]
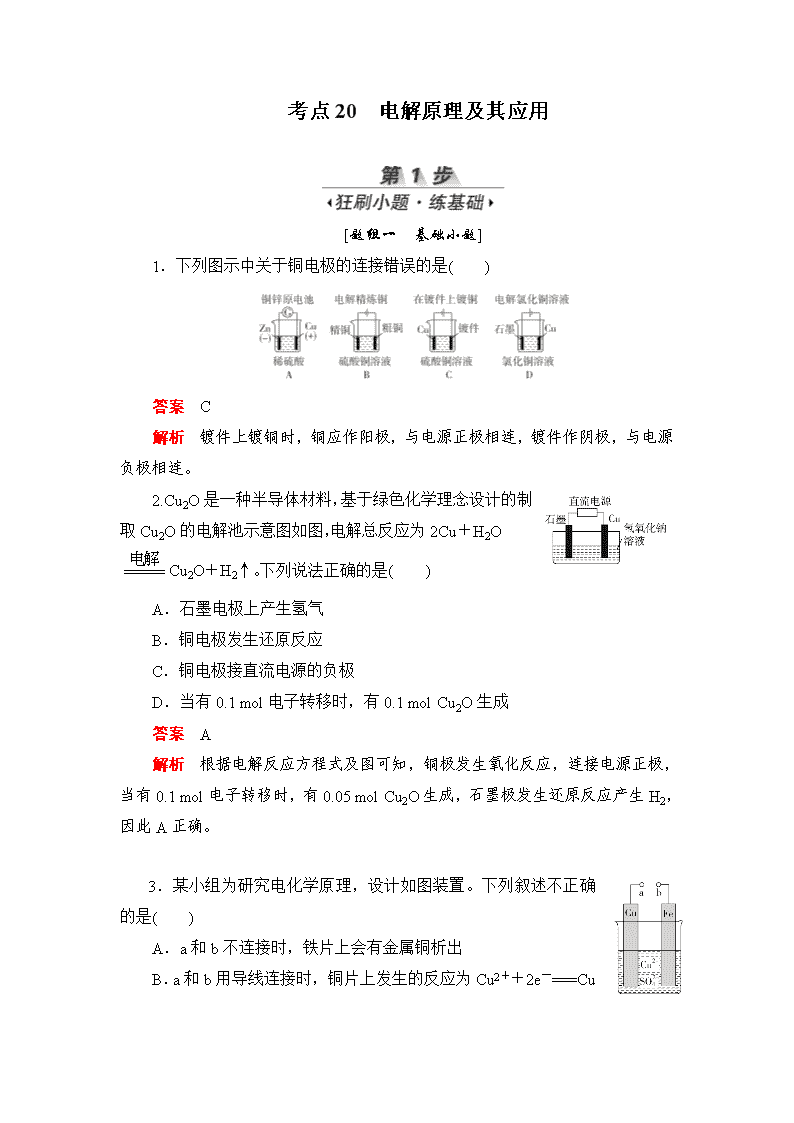
1.下列图示中关于铜电极的连接错误的是( )
答案 C
解析 镀件上镀铜时,铜应作阳极,与电源正极相连,镀件作阴极,与电源负极相连。
2.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应为2Cu+H2OCu2O+H2↑。下列说法正确的是( )
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
答案 A
解析 根据电解反应方程式及图可知,铜极发生氧化反应,连接电源正极,当有0.1 mol电子转移时,有0.05 mol Cu2O生成,石墨极发生还原反应产生H2,因此A正确。
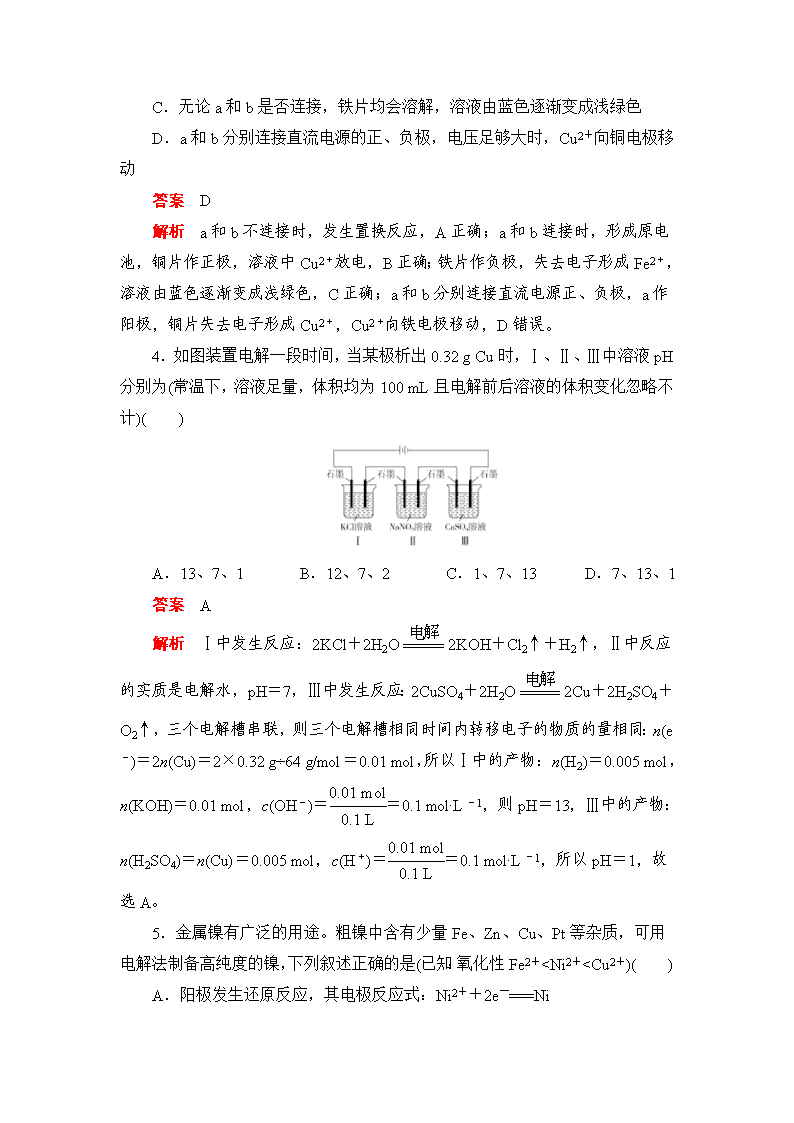
3.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液由蓝色逐渐变成浅绿色
D.a和b分别连接直流电源的正、负极,电压足够大时,Cu2+向铜电极移动
答案 D
解析 a和b不连接时,发生置换反应,A正确;a和b连接时,形成原电池,铜片作正极,溶液中Cu2+放电,B正确;铁片作负极,失去电子形成Fe2+,溶液由蓝色逐渐变成浅绿色,C正确;a和b分别连接直流电源正、负极,a作阳极,铜片失去电子形成Cu2+,Cu2+向铁电极移动,D错误。
4.如图装置电解一段时间,当某极析出0.32 g Cu时,Ⅰ、Ⅱ、Ⅲ中溶液pH分别为(常温下,溶液足量,体积均为100 mL且电解前后溶液的体积变化忽略不计)( )
A.13、7、1 B.12、7、2 C.1、7、13 D.7、13、1
答案 A
解析 Ⅰ中发生反应:2KCl+2H2O2KOH+Cl2↑+H2↑,Ⅱ中反应的实质是电解水,pH=7,Ⅲ中发生反应:2CuSO4+2H2O2Cu+2H2SO4+O2↑,三个电解槽串联,则三个电解槽相同时间内转移电子的物质的量相同:n(e-)=2n(Cu)=2×0.32 g÷64 g/mol=0.01 mol,所以Ⅰ中的产物:n(H2)=0.005 mol,n(KOH)=0.01 mol,c(OH-)==0.1 mol·L-1,则pH=13,Ⅲ中的产物:n(H2SO4)=n(Cu)=0.005 mol,c(H+)==0.1 mol·L-1,所以pH=1,故选A。
5.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+
Fe2+>Zn2+,故阴极反应为Ni2++2e-===Ni,可见,阳极质量减少的是溶解的Zn、Fe、Ni,而阴极质量增加的只是析出的Ni,两者质量是不相等的,故B错误;电解后,溶液中除留下Fe2+、Zn2+外,还有Ni2+,C错误;阳极反应有:Zn-2e-===Zn2+,Fe-2e-===Fe2+,Ni-2e-===Ni2+,Pt为惰性金属,不放电,而Cu要在金属Ni全部转化为Ni2+后才能放电,但此时Cu已没有了支撑物,最后和Pt一起落下,形成阳极泥,故D正确。
6.用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
答案 D
解析 电解Na2SO4溶液相当于电解水,阳极生成氧气,a管中溶液呈酸性,
A错误;电解AgNO3溶液属于“析氧生酸型”,阳极生成氧气,B错误;电解KCl和CuCl2混合溶液,相当于先后电解CuCl2溶液、KCl溶液和水,a管产生H2的体积有可能与b管产生Cl2和O2的混合气体的体积相等,C错误;电解AlCl3溶液时,阴极先产生氢气,a管中生成Al(OH)3沉淀,当Al3+沉淀完全后,继续电解水产生的OH-,又使沉淀溶解,D正确。
7.利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是( )
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO+2H++e-===S2O+2H2O
C.阳极的电极反应式为:SO2+2H2O-2e-===SO+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
答案 C
解析 由装置图知,左侧电极硫元素化合价从+4(SO2)升高到+6(H2SO4),故左侧电极是阳极,a为直流电源的正极,A错误,C正确;阴极的电极反应式为:2HSO+2H++2e-===S2O+2H2O,B错误;由于H+在阴极上反应,故电解时,H+由阳极室通过阳离子交换膜到阴极室,D错误。
[题组二 高考小题]
8.(2018·全国卷Ⅲ)一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向多孔碳材料区迁移
D.充电时,电池总反应为Li2O2-x===2Li+1-O2
答案 D
解析 放电时,O2与Li+在多孔碳材料电极处反应,说明电池内,Li+向多孔碳材料电极移动,因为阳离子移向正极,所以多孔碳材料电极为正极,A错误。因为多孔碳材料电极为正极,外电路电子应该由锂电极流向多孔碳材料电极(由负极流向正极),B错误。充电和放电时电池中离子的移动方向相反,放电时,Li+向多孔碳材料电极移动,充电时向锂电极移动,C错误。根据图示和上述分析,可知放电时,电池的正极反应是O2与Li+得电子转化为Li2O2-x,电池的负极反应是单质Li失电子转化为Li+,所以总反应为:2Li+O2===Li2O2-x,充电时的反应与放电时的反应相反,所以充电时,电池总反应为Li2O2-x===2Li+O2,D正确。
9.(2017·全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4H2C2O4混合溶液。下列叙述错误的是( )
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为Al3++3e-===Al
D.硫酸根离子在电解过程中向阳极移动
答案 C
解析 铝制品表面氧化形成致密的氧化膜,发生氧化反应,所以待加工铝质工件应为阳极,A正确;阴极发生的电极反应为2H++2e-===H2↑,阴极可选用不锈钢网作电极,B正确,C错误;电解质溶液中的阴离子向阳极移动,D正确。
10.(2016·全国卷Ⅰ)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是( )
A.通电后中间隔室的SO离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低
D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成
答案 B
解析 负极区(阴极)电极反应为:4H++4e-===2H2↑,正极区(阳极)电极反应为:4OH--4e-===2H2O+O2↑。通电后SO向正极移动,正极区OH-放电,溶液酸性增强,pH减小,A错误;负极区反应为4H++4e-===2H2↑,溶液pH增大,C错误;当电路中通过1 mol电子的电量时,会有0.25 mol O2生成,D错误。
11.(2015·浙江高考)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A.X是电源的负极
B.阴极的电极反应式是H2O+2e-===H2+O2-、CO2+2e-===CO+O2-
C.总反应可表示为H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1∶1
答案 D
解析 H2O、CO2混合气体制备H2和CO时,氢元素及碳元素的化合价降低,
H2O和CO2发生还原反应,则该极为阴极,连接电源的负极,A正确;因电解质是金属氧化物,故该过程中可以传递O2-,则阴极反应为H2O+2e-===H2+O2-,CO2+2e-===CO+O2-,B正确;图中阳极放出的是O2,2O2-+4e-===O2↑,则总反应方程式为H2O+CO2H2+CO+O2,C正确;从总反应方程式看,阴极和阳极生成的气体的物质的量之比是 2∶1,D错误。
[题组三 模拟小题]
12.(2019·黄石调研)已知反应:2CrO+2H+Cr2O+H2O。某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液。
下列有关叙述正确的是( )
A.Na2CrO4生成Na2Cr2O7的反应为非氧化还原反应,不能通过电解方法获得
B.a为电源正极
C.d口流出的NaOH溶液的浓度与c口通入的NaOH溶液的浓度相同
D.Na+从右侧通过阳离子交换膜进入左侧
答案 D
解析 虽然Na2CrO4转化为Na2Cr2O7的反应为非氧化还原反应,但因为该反应必须在酸性环境中才能发生,反应所需的H+可以通过电解方法获得,A错误;电解装置右侧发生反应时所需的H+来源于H2O的电解,电极反应式为2H2O-4e-===O2↑+4H+,故右侧电极为阳极,阳极连接电源正极,即b为电源正极,a为电源负极,B错误;左侧电极反应式为2H2O+2e-===H2↑+2OH-,故d口流出的NaOH溶液的浓度比c口通入的NaOH溶液的浓度大,
C错误;电解时,阳离子从阳极流向阴极,故Na+从右侧通过阳离子交换膜进入左侧,D项正确。
13.(2019·湖北八校联考)H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是 ( )
A.M室发生的电极反应为2H2O-4e-===O2↑+4H+
B.N室中:a%
查看更多