- 2021-08-24 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习物质的检验、分离和提纯作业(1)
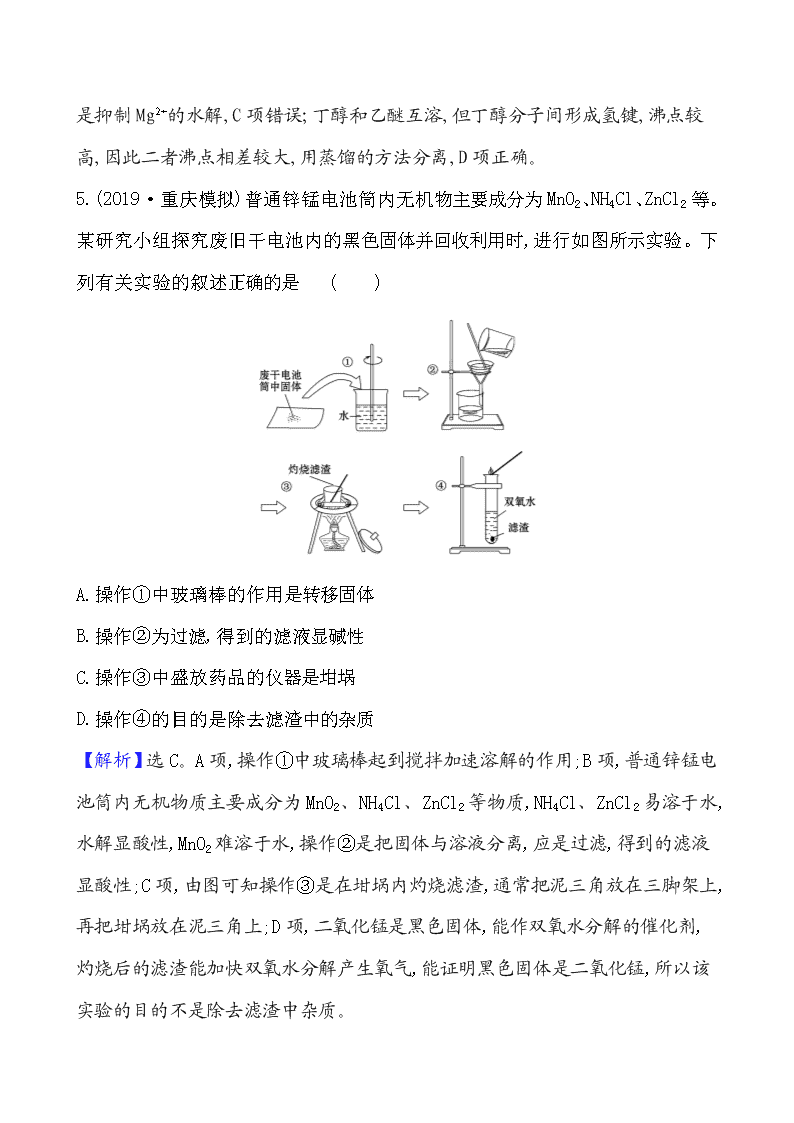
课时分层提升练 三十一 物质的检验、分离和提纯 一、选择题 1.(2019·深圳模拟)《天工开物》中记载了砒霜(As2O3)的制取:“凡烧砒,下鞠(注:在地上挖砌)土窑,纳石其上,上砌曲突(注:烟筒),以铁釜倒悬覆突口。其下灼炭举火。其烟气从曲突内熏贴釜上。”文中涉及的操作为 ( ) A.蒸馏 B.升华 C.干馏 D.萃取 【解析】选B。A项,蒸馏一般分离的是互溶的液体,根据题意,不符合蒸馏研究的对象;B项,升华利用固体受热直接转化成气体,遇冷重新转化成固体,属于物理变化,根据题意,“凡烧砒……烟气从曲突内熏贴釜上”,符合升华原理;C项,干馏是指煤在隔绝空气条件下加强热使之分解,根据题意,不符合干馏的定义;D项,根据上述分析,不符合萃取的原理。 2.(2019·济宁模拟)下列有关实验的说法正确的是 ( ) A.SO2能使品红溶液、酸性KMnO4溶液褪色,加热后都能复原 B.用铂丝蘸取某溶液在酒精灯的火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中不含Na+ C.用滴加BaCl2溶液观察有无白色沉淀生成的方法鉴别K2CO3和NaHCO3 D.少量CO2通入CaCl2溶液能生成白色沉淀,CO2过量时白色沉淀溶解 【解析】选C。A项,SO2使品红溶液褪色后加热能复原,使酸性KMnO4溶液褪色后不能复原;B项,可能含有Na+,因为即使有Na+,其焰色也会被蓝色钴玻璃滤去;D项,无论CO2少量还是过量,都不会有白色沉淀生成。 3.(2019·荆门模拟)下列除去杂质(括号内的物质为杂质)的方法中错误的是 ( ) A.FeSO4 (CuSO4):加足量铁粉后,过滤 B.CO (CO2):用NaOH溶液洗气后,干燥 C.CO2 (HCl):用NaOH溶液洗气后,干燥 D.MnO2 (KCl):加水溶解后,过滤、洗涤、烘干 【解析】选C。A.Fe与硫酸铜反应生成硫酸亚铁和Cu,反应后过滤可除杂,故A正确;B.二氧化碳与NaOH反应,而CO不能,则洗气可分离,故B正确;C.二者均与NaOH反应,不能除杂,应选饱和碳酸氢钠溶液,故C错误;D.KCl溶于水,而MnO2不溶于水,则溶解、过滤、洗涤、烘干可分离,故D正确。 4.(2019·广州模拟)下列实验中,所采取的分离方法与对应原理都正确的是 ( ) 选项 目的 分离方法 原理 A 分离氢氧化铁胶体与FeCl3溶液 过滤 胶体粒子不能通过滤纸 B 用乙醇提取碘水中的碘 萃取 碘在乙醇中的溶解度较大 C 用MgCl2溶液制备无水MgCl2固体 蒸发 MgCl2受热不分解 D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大 【解析】选D。分离氢氧化铁胶体与FeCl3溶液,用渗析的方法,胶体粒子能透过滤纸,不能通过半透膜,A项错误;乙醇与水互溶,不能用作萃取碘水中的碘的萃取剂,B项错误;用MgCl2溶液制备无水MgCl2 固体,需要在HCl氛围中加热,目的是抑制Mg2+的水解,C项错误;丁醇和乙醚互溶,但丁醇分子间形成氢键,沸点较高,因此二者沸点相差较大,用蒸馏的方法分离,D项正确。 5.(2019·重庆模拟)普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废旧干电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是 ( ) A.操作①中玻璃棒的作用是转移固体 B.操作②为过滤,得到的滤液显碱性 C.操作③中盛放药品的仪器是坩埚 D.操作④的目的是除去滤渣中的杂质 【解析】选C。A项,操作①中玻璃棒起到搅拌加速溶解的作用;B项,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质,NH4Cl、ZnCl2易溶于水,水解显酸性,MnO2难溶于水,操作②是把固体与溶液分离,应是过滤,得到的滤液显酸性;C项,由图可知操作③是在坩埚内灼烧滤渣,通常把泥三角放在三脚架上,再把坩埚放在泥三角上;D项,二氧化锰是黑色固体,能作双氧水分解的催化剂,灼烧后的滤渣能加快双氧水分解产生氧气,能证明黑色固体是二氧化锰,所以该实验的目的不是除去滤渣中杂质。 6.(2019·昆明模拟)在一无色溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+ ③Cl- ④N ⑤S2- ⑥C ⑦N ⑧Mg2+ ⑨Al3+ ⑩Al。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是 ( ) A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨ C.③④⑦⑧⑨ D.①②③⑤⑥⑩ 【解析】选D。溶液是无色的,则不可能存在Cu2+、Fe3+;溶液酸性很强,则一定不存在S2-、C、Al;有Ag+,则不含有Cl-,所以答案选D。 二、非选择题 7.一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O,并回收单质硫的工艺流程如下: 已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。 回答下列问题: (1)步骤①混合研磨成细粉的主要目的是______________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为________________ ______。 (2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________ ______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是______________ ____________________。步骤⑤所得滤渣为____________________________(填化学式)。 (3)步骤⑦需在90~100 ℃下进行,该反应的化学方程式为 ____________。 (4)测定产品MnSO4·H2O的方法之一是准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液V mL,产品中Mn2+的质量分数为w(Mn2+)=________。 【解析】(1)步骤①混合研磨成细粉的主要目的是增大反应物的接触面积,提高硫酸浸取时的浸取速率和浸取率,提高原料的利用率;硫酸浸取时的反应方程式为3MnO2+2FeS2+6H2SO43MnSO4+Fe2(SO4)3+4S↓+6H2O。 (2)由于Fe2+具有较强的还原性,在酸性条件下可用软锰矿粉(MnO2)或H2O2将其氧化为Fe3+,既不引入杂质,又能达到除去的目的;用碱液处理时,需将溶液加热至沸,然后在不断搅拌下调节pH为4~5,再继续煮沸一段时间,以破坏Fe(OH)3胶体并使沉淀颗粒增大,便于过滤分离,得到的滤渣为Fe(OH)3。 (3)步骤⑦在90~100 ℃下进行,反应的化学方程式为(NH4)2Sx+12NH3↑+H2S↑+xS↓。 (4)已知本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。根据得失电子守恒可得二者反应的方程式为2KMnO4+3MnSO4·H2O5MnO2+K2SO4+2H2SO4 +H2O,已知n(KMnO4)=c mol·L-1×V×10-3L=cV×10-3mol,则n(MnSO4·H2O)=1.5cV×10-3mol,产品中Mn2+的质量分数为w(Mn2+)=[1.5cV×10-3mol×55 g·mol-1]/a g×100%=(8.25cV/a)%。 答案:(1)增大接触面积,提高硫酸浸取时的浸取速率和浸取率 3MnO2+2FeS2+6H2SO43MnSO4+Fe2(SO4)3+4S↓+6H2O (2)软锰矿粉或H2O2 破坏Fe(OH)3胶体并使沉淀颗粒增大,便于过滤分离 Fe(OH)3 (3)(NH4)2Sx+12NH3↑+H2S↑+xS↓ (4)(8.25cV/a)%或(8.25cV×10-2)/a或0.082 5cV/a或0.082 5cV/a×100% 一、选择题 1.(2019·晋城模拟)下列实验方案、现象和结论都合理的是 ( ) 实验目的 实验方案、现象 结论 A 检验溶 液中有 无N 用试管取少量的待检测溶液,加入少量的稀NaOH溶液,用一块湿润的红色石蕊试纸放在试管口 若试纸变蓝,则有N,否则无N B 检验溶液中有无K+ 用洁净的铂丝蘸取待测液进行焰色反应,火焰呈黄色 原溶液中一定无K+ C 检验溶液中有无S 用试管取少量的待检测溶液,加入足量稀盐酸无现象,再加入BaCl2溶液,出现白色沉淀 原溶液中有S D 检验淀粉水解产物有无还原性 用试管取少量的淀粉溶液加入适量的稀硫酸,加热一段时间后,加入少量的新制Cu(OH)2悬浊液,加热至沸腾,没有产生砖红色沉淀 水解产物没有还原性 【解析】选C。A项,因氨气极易溶于水,向待测液中加入稀NaOH溶液,即使溶液中含有N,也很难生成氨气,应向待测液中加入浓NaOH溶液并加热才能检验;B项,观察K+的焰色反应时,需要透过蓝色的钴玻璃滤去黄光,而在实验中并没有透过蓝色的钴玻璃观察,所以不能确定是否含有K+;C项,检验溶液中是否含有S ,采取的方法是用试管取少量待测液,加入足量稀盐酸无明显现象,再加入BaCl2溶液,生成白色沉淀,说明原溶液中含有S;D项,用新制Cu(OH)2悬浊液检验醛基必须在碱性环境下进行,因此应先用过量的NaOH溶液除去稀硫酸,再加入新制Cu(OH)2悬浊液进行检验。 2.(2019·武汉模拟)按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。 下列说法错误的是 ( ) A.步骤①需要过滤装置 B.步骤②需要用到分液漏斗 C.步骤③需要用到坩埚 D.步骤④需要蒸馏装置 【解析】选C。步骤①得到滤液和不溶性物质,所以为过滤,故A项正确;步骤②得到水层溶液和有机层溶液,所以为分液,仪器为分液漏斗,故B项正确;步骤③由水层溶液析出固体,需要加热蒸发,仪器为蒸发皿,故C项错误;步骤④从有机层溶液中得到甲苯,需要蒸馏,故D项正确。 3.(2019·沧州模拟)溶液X中可能含有K+、Mg2+、Al3+、Al、Si、C、S、S中的若干种离子。某同学对该溶液进行了如下实验: 下列判断正确的是 ( ) A.气体甲一定是纯净物 B.沉淀甲是硅酸和硅酸镁的混合物 C.K+、Al和Si一定存在于溶液X中 D.C和S一定不存在于溶液X中 【解析】选C。据流程图,加过量稀盐酸有气体产生,说明溶液中含有C或S或两者都有,生成的气体是二氧化碳或二氧化硫或两者都有,一定不存在和C或S不共存的离子,所以不存在Mg2+、Al3+;加盐酸有沉淀生成,说明溶液中一定含有Si,硅酸是沉淀;加入过量氨水(提供OH-)有白色沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在Al3+,但是原来溶液中的Al3+一定不能存在,所以该Al3+是Al和盐酸反应生成的,所以,原溶液中一定存在Al;要保证溶液呈电中性,只有K+这一种阳离子,所以一定存在K+。根据上述分析可知,气体甲可能是二氧化碳或二氧化硫或两者的混合气体,A项错误;根据上述分析知,原溶液中不含有Mg2+,所以沉淀甲是硅酸,不可能含硅酸镁,B项错误;根据上述分析,K+、Al和Si一定存在于溶液X中,C项正确;不能确定溶液中是否含有S,但可能含有C,D项错误。 二、非选择题 4.某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下: 回答下列问题: (1)在下列装置中,第一次浸出必须用________,第二次浸出应选用________。(填标号) (2)第二次浸出时,向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成__________________。滤渣2的主要成分是________ ________。 (3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是________。 (4)某同学在实验完成之后,得到1.5 g CuSO4·5H2O,则铜的回收率为________。 【解析】(1)根据题给化学工艺流程知第一次浸出发生反应ZnO+H2SO4ZnSO4 +H2O、ZnS+H2SO4ZnSO4+H2S↑,有有毒气体H2S生成,必须用氢氧化钠溶液进行尾气处理,选D装置,第二次浸出时发生反应:CuS+H2O2+H2SO4CuSO4+S+2H2O,不产生有毒气体,可选用A装置。 (2)第二次浸出时,向盛有滤渣1的反应器中加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成H2O2与固体颗粒接触分解。滤渣2的主要成分是SiO2(SiO2和S)。 (3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是蒸发皿。 (4)15.0 g废催化剂中含有铜的物质的量为15.0 g×12.8%÷96 g·mol-1= 0.02 mol,1.5 g CuSO4·5H2O中铜的物质的量为1.5 g÷250 g·mol-1=0.006 mol,则铜的回收率为×100%=30%。 答案:(1)D A (2)H2O2与固体颗粒接触分解 SiO2(SiO2和S) (3)蒸发皿 (4)30% 【加固训练】 工业上生产高氯酸(沸点:90 ℃)时还同时生产了亚氯酸钠,其工艺流程如下: (1)实验室进行过滤操作的常用玻璃仪器有________________________。 (2)反应器Ⅰ中的温度最宜选择________(填序号);操作②的名称为________。 A.0 ℃ B.20 ℃ C.80 ℃ D.120 ℃ (3)反应器Ⅱ中发生反应的离子方程式为____________________。 (4)加快反应器Ⅱ中反应速率的措施有____________________________________(写出一种措施即可)等。从反应器Ⅱ中获得NaClO2粗品的实验操作依次是________(填序号,下同),进一步提纯的操作名称为________。 A.过滤 B.重结晶 C.蒸馏 D.蒸发浓缩 E.蒸干灼烧 F.冷却结晶 G.萃取分液 (5)上述流程中可循环使用的物质为________,副产品除NaClO2、NaHSO4外还有__________________________(填化学式)。 【解析】(1)实验室常用的玻璃仪器有(普通)漏斗、玻璃棒、烧杯。 (2)反应器Ⅰ中加入的氯酸钠在浓硫酸的作用下发生了氧化还原反应,Cl化合价+4←+5→+7,因此得到的含氯化合物中有ClO2气体和高氯酸,所以要得到较高浓度的高氯酸溶液,应该尽可能的升温使ClO2气体溢出,同时温度不能过高,超过高氯酸沸点温度90 ℃容易使高氯酸气化,所以最佳温度应该选C,80 ℃。而在后一阶段的滤液中再获得纯净的高氯酸产品,可以选择蒸馏,升高温度至高氯酸沸点温度,蒸馏得到高氯酸纯品。 (3)从反应Ⅱ的前后反应物和产物可以看出,Cl的化合价+4→+3,发生了氧化还原反应,ClO2气体作氧化剂,SO2在反应中被氧化为了S,有碱参与反应生成盐和水,所以根据氧化还原得失电子守恒进行缺 项配平,可得反应的离子方程式为2ClO2+SO2+4OH-2Cl+S+2H2O。 (4)反应器Ⅱ中有Na2SO4、NaClO2等,上述物质均溶于水,所以只能采用重结晶法分离。 (5)由操作②后箭头可知除得到产品还有一种可循环利用的物质,分析反应器Ⅰ中参加反应的物质H2SO4和NaClO3及产物可知可循环利用的是硫酸。 答案:(1)(普通)漏斗、玻璃棒、烧杯 (2)C 蒸馏 (3)2ClO2+SO2+4OH-2Cl+S+2H2O (4)适当升高温度[增大NaOH溶液的浓度、增大气体(SO2、ClO2)和NaOH溶液的接触面积等] DFA B (5)硫酸 Na2SO4 5.某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: 普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题: (1)操作②玻璃棒的作用是________ ; (2)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为________(填化学式); (3)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为________ (填化学式); (4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容: 实验 目的 操作 实验现象 结论 ①检验Cl- 取少许滤液于试管中,加入____________ 产生白色沉淀 含有Cl- ②检验N 取少许滤液于试管中,加入 __________ ________ 含有N ③检验Zn2+ 取少许滤液于试管中,加入稀氨水 先产生白色沉淀,继续加入氨水,沉淀又溶解 含有Zn2+ 【解析】(1)过滤操作中,玻璃棒的作用是引流。 (2)使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,二氧化碳可由黑色的碳单质灼烧制得,二氧化硫可由淡黄色的硫单质灼烧制得,所以该黑色物质是碳单质。 (3)能使带火星的木条复燃的气体是氧气,能使双氧水迅速产生氧气的黑色固体物质是二氧化锰。 (4)氯离子的检验:取少许滤液于试管中,加入硝酸酸化的硝酸银溶液,银离子和氯离子反应生成不溶于水的白色沉淀氯化银;如果有白色沉淀生成,就说明有氯离子。 铵根离子的检验:铵根离子能和强碱在加热条件下反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝色;如果湿润的红色石蕊试纸变蓝色,就说明有铵根离子存在。 答案:(1)引流 (2)C (3)MnO2 (4)①硝酸酸化的硝酸银溶液 ②浓氢氧化钠溶液并加热,将湿润的红色石蕊试纸置于试管口附近 石蕊试纸变蓝色 关闭Word文档返回原板块查看更多