- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习大题题型专攻5 物质结构与性质学案
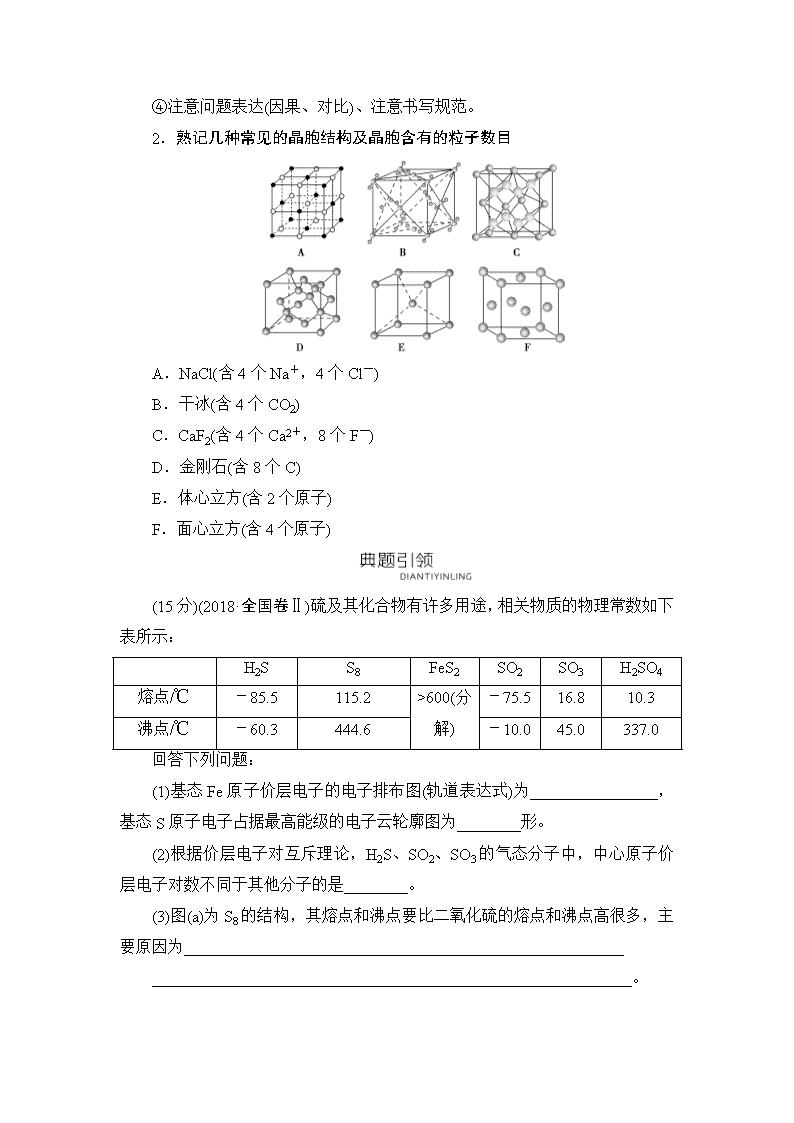
大题题型专攻五 物质结构与性质 [题型简介] “物质结构与性质”试题以选考题的形式出现,分值为15分,全国统一考试大纲对这部分内容要求不高,都是较为基础的知识点。要求考生学会根据某些物质的结构特征解释一些物理现象,能够运用价层电子对互斥理论或杂化轨道理论推测简单的分子或离子的立体构型。学会运用外层的电子排布之间的关系推断出元素。纵观近年全国卷化学部分试题,考查的热点涉及①核外电子排布、②元素性质(电离能、电负性)、③共价键类型、④分子间作用力(范德华力、氢键)、⑤分子立体构型、⑥杂化类型、⑦等电子体、⑧键角比较、⑨晶体熔点比较、⑩晶胞计算、⑪晶体中的粒子位置坐标等。 1.突破物质结构与性质的“三步”思维 (1)审题——正确推断题中元素或物质 有些物质结构与性质题,不需要进行元素与物质的推断,题干很简单,往往介绍简单的背景材料,略作了解即可;有些题需进行元素与物质的推断,认真阅读题目所提供信息,根据原子结构、元素周期律知识、物质的性质正确推断题中元素与物质。 (2)析题——认真分析,关注有效信息 ①物质结构特点:有些题目常考查物质所含σ键和π键,需正确书写物质的结构式进行分析;单键均为σ键,双键、三键中只有一个为σ键,其余为π键。运用等电子体知识,理解物质中原子的杂化方式和空间结构,以及电子式的书写方法等。 ②关注晶胞结构:题目中有关晶体的理解常提供晶胞结构,需认真分析,想象晶体中原子在空间的连接方式,正确确定物质的化学式。 (3)答题——关注细节,规范正确答题 ①原子结构的考查,应注意看清是原子的电子排布式、离子的电子排布式、价电子排布式还是电子排布图等。 ②第一电离能的考查,特别注意第ⅡA和ⅤA族的特殊性。 ③对于物质熔、沸点的高低比较,特别注意不要忽略氢键的问题。 ④注意问题表达(因果、对比)、注意书写规范。 2.熟记几种常见的晶胞结构及晶胞含有的粒子数目 A.NaCl(含4个Na+,4个Cl-) B.干冰(含4个CO2) C.CaF2(含4个Ca2+,8个F-) D.金刚石(含8个C) E.体心立方(含2个原子) F.面心立方(含4个原子) (15分)(2018·全国卷Ⅱ)硫及其化合物有许多用途,相关物质的物理常数如下表所示: H2S S8 FeS2 SO2 SO3 H2SO4 熔点/℃ -85.5 115.2 >600(分解) -75.5 16.8 10.3 沸点/℃ -60.3 444.6 -10.0 45.0 337.0 回答下列问题: (1)基态Fe原子价层电子的电子排布图(轨道表达式)为________________,基态S原子电子占据最高能级的电子云轮廓图为________形。 (2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是________。 (3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_______________________________________________________ ____________________________________________________________。 图(a) 图(b) 图(c) (4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。 (5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________ g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为________nm。 [命题立意] 设问 知识落点 核心素养 (1) 电子排布图书写、电子云轮廓图判断 微观探析 (2) 价层电子对互斥理论的应用——确定价层电子对数 (3) 分子性质——熔点和沸点的影响因素 宏观辨识与微观探析 (4) 分子立体构型、共价键类型和杂化类型 (5) 晶体的晶胞计算——密度和边长 证据推理与模型认知 【解答指导】 (2)价层电子对数=σ电子对数+(a-bx) ⇒ (4)SO3的中心S原子杂化方式为sp2杂化⇒SO3中S形成3个σ键和1个π键⇒平面三角形分子。 (5)晶胞图示⇒晶胞包含4个FeS2⇒(a×10-7)3ρNA=4M ⇓ ⇒正八面体的边长为原晶胞面对角线长的⇒正八面体的边长为a。 【解析】 (1)基态Fe原子核外有26个电子,按照构造原理,其核外电子排布式为[Ar]3d64s2,按照洪特规则,价层电子3d上6个电子优先占据5个不同轨道,故价层电子的电子排布图为。基态S原子的核外电子排布式为1s22s22p63s23p4,电子占据最高能级为3p,p能级的电子云轮廓图为哑铃(纺锤)形。(2)价层电子对数包括成键电子对数和孤电子对数,H2S中S的成键电子对数为2,孤电子对数为=2,故价层电子对数为4(或价层电子对数为=4),同理,SO2中S的价层电子对数为=3,SO3中S的价层电子对数为=3,H2S中S的价层电子对数不同于SO2、SO3。(3)S8和SO2均为分子晶体,分子间存在的作用力均为范德华力,S8的相对分子质量大,分子间范德华力强,故熔点和沸点高。(4)气态SO3为单分子,分子中S无孤电子对,其分子的立体构型为平面三角形,S和O之间形成双键,故共价键有σ键和π键两种。固态SO3为三聚分子,分子中每个S与4个O成键,S无孤电子对,故原子的杂化轨道类型为sp3。(5)该晶胞中Fe2+位于棱上和体心,个数为12×+1=4,S位于顶点和面心,个数为8×+6×=4,故晶体密度为×4 g÷(a×10-7 cm)3=×1021 g·cm-3。根据晶胞结构,S所形成的正八面体的边长为该晶胞中相邻面的面心之间的连线之长,即为晶胞边长的,故该正八面体的边长为a nm。 【答案与评分标准】 (1) 哑铃(纺锤)(每空2分) (2)H2S(2分) (3)S8相对分子质量大,分子间范德华力强(2分) (4)平面三角 2 sp3(每空1分) (5)×1021 a(每空2分) [题后升华] 物质结构与性质涉及的各知识之间的联系 (1)原子(离子)结构知识关系 (2)分子结构知识关系 (3)晶体结构知识关系 1.(2018·试题调研)锂磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。 (1)写出基态Cu2+的电子排布式:_______________________________。 (2)PO的空间构型是________。 (3)P、S元素第一电离能大小关系为______________________________, 原因是_______________________________________________________。 (4)氨基乙酸铜分子结构如图所示,碳原子的杂化方式为________,基态碳原子核外电子有________种运动状态。 (5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有π键的数目为______(NA表示阿伏加德罗常数的值)。 (6)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,晶体铜的密度为________g·cm-3(列出计算式即可)。 甲 乙 【解析】 (1)Cu2+核外有27个电子,根据核外电子排布规律,基态Cu2+的电子排布式是1s22s22p63s23p63d9或[Ar]3d9。(2)根据价层电子对互斥理论,价层电子对数为4+=4,无孤对电子,所以PO的空间构型是正四面体。(3)P原子3p轨道上的电子处于半充满状态,结构稳定,比S难失去电子,所以P、S元素第一电离能大小关系为P>S。(4)单键碳原子杂化方式为sp3、双键碳原子杂化方式为sp2,中既有单键碳原子又有双键碳原子,所以碳原子的杂化方式为sp3和sp2;基态碳原子核外有6个电子,就有6种运动状态。(5)CN-存在碳氮三键,1个碳氮三键中有2个π键,所以1 mol该配合物含有8 mol π键,数目为8NA。(6)离铜原子最近且距离相等的原子为铜原子的配位原子,根据图甲可知铜原子配位数是12;根据图乙可知,晶胞的面对角线长为127.8 pm×4,则晶胞棱长为2×127.8×10-10cm,每个晶胞含有铜原子数为8×+6×=4。1个晶胞的体积为(2×127.8×10-10)3cm3,质量为g,所以密度为g·cm-3。 【答案】 (1)1s22s22p63s23p63d9(或[Ar]3d9) (2)正四面体 (3)P>S P原子3p轨道上的电子处于半充满状态,结构稳定,失去电子比S难 (4)sp3和sp2 6 (5)8NA (6)12 2.铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。 (1)基态Fe3+的简化电子排布式为__________________________。 (2)实验室用KSCN、苯酚(OH)检验Fe3+。N、O、S的第一电离能由大到小的顺序为________(用元素符号表示),苯酚中碳原子的杂化轨道类型为________。 (3)FeCl3的熔点为306 ℃,沸点为315 ℃。FeCl3的晶体类型是______________。FeSO4常作净水剂和补铁剂,SO的立体构型是________。 (4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含________mol σ键,与CO互为等电子体的离子是________(填化学式,写一种)。 (5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。 (6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为____;Fe2+与O2-最短核间距为________pm。 图1 图2 【解析】 (1)Fe3+的简化电子排布式为[Ar]3d5。(2)N、O、S的第一电离能:N>O>S。苯酚中碳原子的杂化轨道类型为sp2杂化。(3)氯化铁晶体的熔点、沸点较低,它是分子晶体。SO中硫的价层有4个成键电子对,无孤电子对,SO的立体构型为正四面体形。(4)CO与N2互为等电子体,1个CO分子中有1个σ键,1个CO分子与Fe形成1个配位键,配位键也是σ键,所以1 mol Fe(CO)5含10 mol σ键。与CO互为等电子体的离子有CN-、C。(5)氮化铁晶胞为六棱柱,顶点贡献率为,棱点贡献率为,面点贡献率为。观察晶胞知,12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于体内,2个氮原子位于体内。1个晶胞含铁微粒数为12×+2×+3=6,含氮微粒数为2,故铁、氮微粒数之比为6 ∶2=3∶1。(6)氧化亚铁晶胞类似氯化钠晶胞。棱上3个离子相切,晶胞参数等于相邻两个离子核间距的2倍。观察题图2知,上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,而氧化亚铁中氧离子、亚铁离子个数比为1∶1,所以,有12个Fe2+与Fe2+紧邻且等距离。1个氧化亚铁晶胞含Fe2+数为8×+6×=4,含O2-数为12×+1=4,所以,1个氧化亚铁晶胞含4个“FeO”。设Fe2+与O2-的最短核间距为d pm,有ρ=,解得d=×1010 pm。 【答案】 (1)[Ar]3d5 (2)N>O>S sp2杂化 (3)分子晶体 正四面体形 (4)10 CN-或C(合理即可) (5)3∶1 (6)12 ×1010 3.(2018·石家庄联考)现有某第四周期过渡金属元素A,其基态原子排布中有四个未成对电子,由此元素可构成固体X。 (1)区分固体X为晶体或非晶体的方法为__________。若此固体结构如图甲、乙所示,则按甲虚线方向切乙得到的A~D图中正确的是________。 (2)写出A的基态电子排布式___________________________________, A2+的价层电子排布图是_____________________________________。 (3)A可与CO反应生成A(CO)5,常压下熔点为-20.3 ℃,沸点为103.6 ℃,试推测:该晶体类型是_____________________________________________。 (4)A可与另两种元素B、C构成某种化合物,B、C的外围电子排布式分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为________。该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d=________g·cm-3。(保留两位小数) 【解析】 (1)根据题干信息可知元素A为Fe。甲中Fe位于顶点和体心,乙由8个甲组成,按甲虚线方向切乙形成的截面是长方形,则排除B、D,由于甲的体心含有1个Fe原子,则A图符合题意。(4)根据B、C的外围电子排布式分别为3d104s1、3s23p4可判断B为Cu、C为S。该晶胞中,Fe原子有6个位于面上、4个位于棱上,个数为4×+6×=4,Cu原子有4个位于面上、1个位于体内、8个位于顶点,个数为8×+4×+1=4,S原子数为8。晶体中N(Cu)∶N(Fe)∶N(S)=4∶4∶8=1∶1∶2,故该晶体的化学式为CuFeS2。晶胞质量=,晶胞体积=(524×10-10cm)2×1 030×10-10cm,故该晶体的密度d=≈4.32 g·cm-3。 【答案】 (1)X射线衍射实验 A (2)1s22s22p63s23p63d64s2 (3)分子晶体 (4)CuFeS2 4.32查看更多