山东省实验中学2021届高三第一次诊断考试(10月)化学试题
山东省实验中学2021届高三第一次诊断考试
化学试题
2020.10
(本试卷共8页,20题;全卷满分100分,考试用时90分钟)
注意事项:
1.答卷前,先将自己的姓名、准考证号填写在试卷和答题纸上.
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.
3.非选择题的作答:用0.5mm黑色签字笔直接答在答题卡上对应的答题区域内,写在试卷、草稿纸和答题卡上的非答题区域均无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mn 55 Cu 64
第I卷(共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列有关说法正确的是
A.反应Hg(1)+H2SO4(aq)=HgSO4(aq)+H2(g)在常温下不能自发进行,则△H<0
B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C.SnC12+H2OSn(OH)C1↓+HC1配制氯化亚锡溶液时加入NaOH固体
D.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
2.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、C1-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、C1-、SO42-
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、A13+、C1-、NO3-
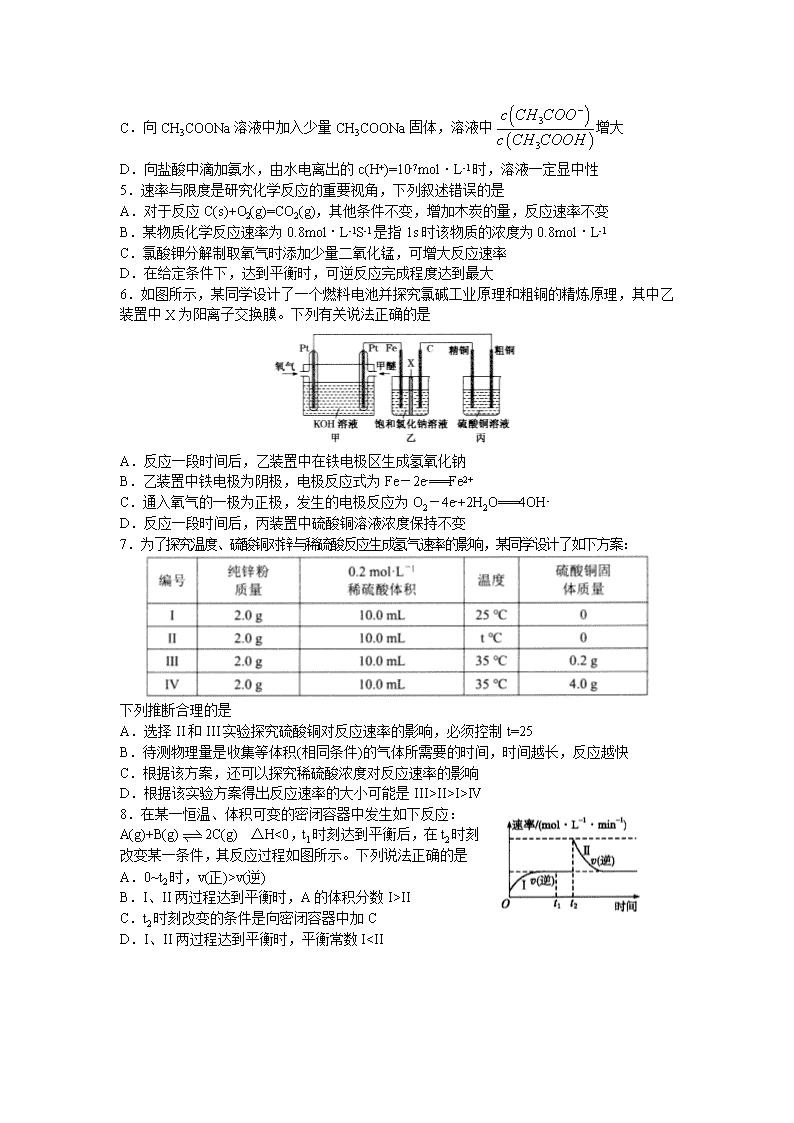
3.N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其总反应为N2O(g)+CO(g)===CO2(g)+N2(g) △H,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
A.△H=△H1+△H2 B.△H=-226kJ·mol-1
C.由图乙知该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充Pt2O+和Pt2O2+
4.25℃时,下列有关电解质溶液的说法正确的是
A.加水稀释0.1mol·L-1氨水,溶液中c(H+)·c(OH-)和均不变
B.向饱和AgC1溶液中加入少量AgNO3固体,AgC1的Ksp和溶解度均不变
C.向CH3COONa溶液中加入少量CH3COONa固体,溶液中增大
D.向盐酸中滴加氨水,由水电离出的c(H+)=10-7mol·L-1时,溶液一定显中性
5.速率与限度是研究化学反应的重要视角,下列叙述错误的是
A.对于反应C(s)+O2(g)=CO2(g),其他条件不变,增加木炭的量,反应速率不变
B.某物质化学反应速率为0.8mol·L-1S-1是指1s时该物质的浓度为0.8mol·L-1
C.氯酸钾分解制取氧气时添加少量二氧化锰,可增大反应速率
D.在给定条件下,达到平衡时,可逆反应完成程度达到最大
6.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是
A.反应一段时间后,乙装置中在铁电极区生成氢氧化钠
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-===Fe2+
C.通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O===4OH-
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
7.为了探究温度、硫酸铜对锌与稀硫酸反应生成氢气速率的影响,某同学设计了如下方案:
下列推断合理的是
A.选择II和III实验探究硫酸铜对反应速率的影响,必须控制t=25
B.待测物理量是收集等体积(相同条件)的气体所需要的时间,时间越长,反应越快
C.根据该方案,还可以探究稀硫酸浓度对反应速率的影响
D.根据该实验方案得出反应速率的大小可能是III>II>I>IV
8.在某一恒温、体积可变的密闭容器中发生如下反应:
A(g)+B(g)2C(g) △H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
A.0~t2时,v(正)>v(逆)
B.I、II两过程达到平衡时,A的体积分数I>II
C.t2时刻改变的条件是向密闭容器中加C
D.I、II两过程达到平衡时,平衡常数I
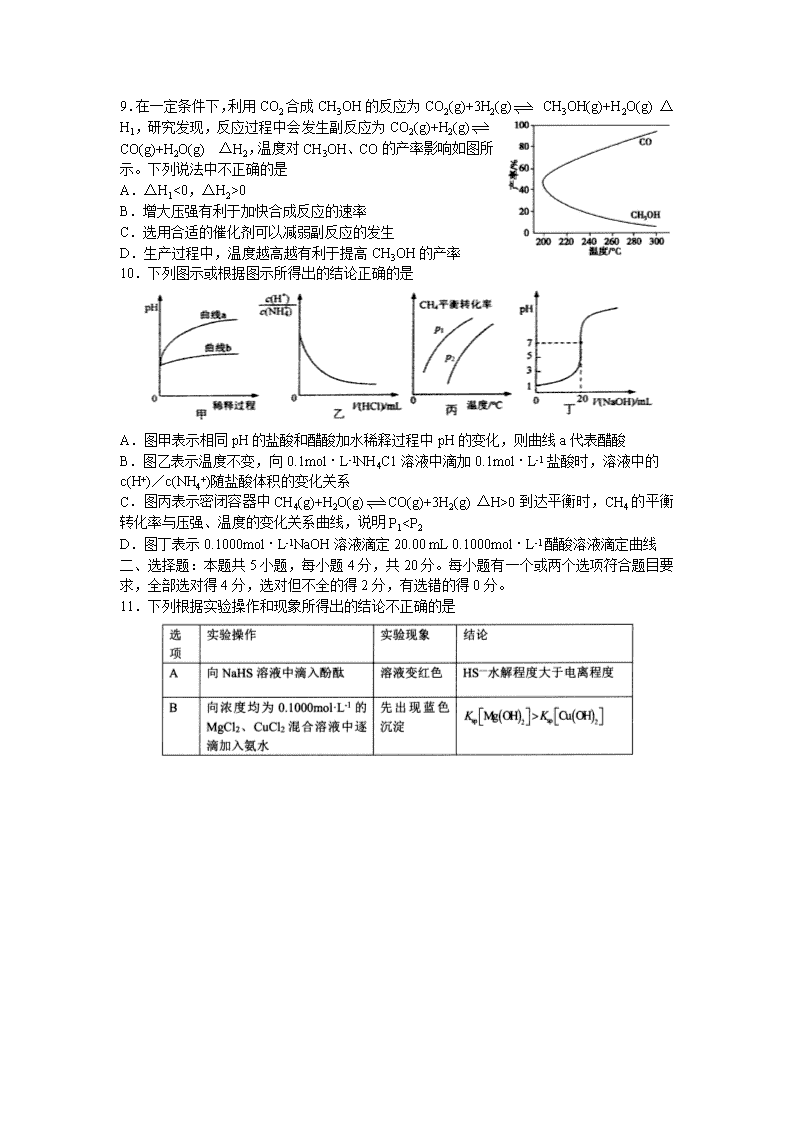
0
B.增大压强有利于加快合成反应的速率
C.选用合适的催化剂可以减弱副反应的发生
D.生产过程中,温度越高越有利于提高CH3OH的产率
10.下列图示或根据图示所得出的结论正确的是
A.图甲表示相同pH的盐酸和醋酸加水稀释过程中pH的变化,则曲线a代表醋酸
B.图乙表示温度不变,向0.1mol·L-1NH4C1溶液中滴加0.1mol·L-1盐酸时,溶液中的
c(H+)/c(NH4+)随盐酸体积的变化关系
C.图丙表示密闭容器中CH4(g)+H2O(g)CO(g)+3H2(g) △H>0到达平衡时,CH4的平衡转化率与压强、温度的变化关系曲线,说明P10)反应的能量变化
B.乙图表示碳的燃烧热
C.丙图表示实验的环境温度20℃,将物质的量浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图(已知Vl+V2=60mL)
D.由丁图可知A、B、C的稳定性顺序为:Bc(HPO42-)>c(PO43-)>c(H2PO4-)
D.等浓度的NaH2PO4和Na2HPO4的混合溶液中有2c(H+)+c(H2PO4-)+3c(H3PO4)=2c(OH-)
+c(HPO4-)+3c(PO43-)
l5.在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g)(正反应放热)。下列说法正确的是
A.a<1.6 B.b>0.8
C.平衡时V正(SO2):v(I)”“=”或“<”)
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)_________(填“>”“<”或“=”)c(NO3-)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为___________________________。
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是_________________g。
18.(8分)研究含氮元素物质的反应对生产和生活具有重要的意义。
(1)已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(1) △H1
②2H2(g)+O2(g)===2H2O(g) △H2
③C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(1)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为______________。
(2)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)N2(g)+2CO2(g) △H=-746.8k·mol-1,实验测得,V正=k正·c2(NO)·c2(CO),V逆=k逆·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在2L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则____________。(保留一位小数)
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)
。下列表述正确的是_______________(填标号)。
A.N2O分解反应中:k值与是否含碘蒸气无关 B.第二步对总反应速率起决定作用
C.第二步活化能比第三步大 D.IO为反应的催化剂
19.(10分)碳热还原法广泛用于合金及材料的制备。下列是碳热还原制锰合金的三个反应,CO与CO2平衡分压比的自然对数(In[])与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数,分压=总压×气体的物质的量分数)。
回答下列问题:
①△H>0的反应是_____________________________ (填“I”“II”或“III”)
②1200K时在一体积为2L的恒容密闭容器中有17.7gMn3C(s)和0.4molCO2,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol·L-1,则0~5min内V(CO2)=________mol·L-1·min-1。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应II,下列能说明反应II达到平衡状态的是__________(填标号)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应III.则在A点反应达到平衡时,容器的总压为akPa,CO2的转化率为_______(保留一位小数):A点对应温度下的Kp(III)=________。
20.(18分)
(1)25℃时,部分物质的电离平衡常数如表所示:
①0.1mol·L-1NH4C1O溶液中离子浓度由大到小的顺序是___________________
C1O-水解反应的平衡常数Kh=_________(保留两位有效数字)。
②少量SO2通入过量的Na2CO3溶液中,发生反应的离子方程式为________________
(2)某小组同学探究饱和NaC1O和KA1(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaC1O加入饱和KA1(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是_____________________________(请用反应的离子方程式表示)。
(3)常温下,Cr(OH)3的溶度积Ksp=C(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol·L-1
,溶液的pH应调至_________________________________。
(4)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
I.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0mol·L-1NH4SCN标准溶液,备用。
II.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL 0.100 0mol·L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0mol·L-1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
f数据处理。回答下列问题:
①滴定应在pH<0.5的条件下进行,其原因是___________________________
②测得c(I-)=__________________mol·L-1。
③在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为_____________________
____________________________________________________________________。
④下列操作对c(I-)测定结果的影响偏高的是________________
A.若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出
B.若在滴定终点读取滴定管刻度时,俯视标准液液面
C.用滴定管量取25.00mL待测NaI溶液,读取初始液面示数时有气泡,后来无气泡。