2020届高考化学二轮复习化学反应原理作业
化学反应原理
1.(2019黑龙江哈师大附中高三期末)下列各项关系中正确的是( )
A.0.1 mol·L-1 Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)=0.2 mol·L-1
B.常温下pH=a的稀硫酸与pH=b的氨水等体积混合后恰好完全反应,则a+b<14
C.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.pH相同的三种溶液①NH4Cl、②(NH4)2SO4、③NH4HSO4,c(NH4+)大小关系为①>②>③
2.已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是( )
A.25 ℃时,0.1 mol·L-1HF溶液中pH=1
B.该体系中有CaF2沉淀产生
C.Ksp(CaF2)随温度和浓度的变化而变化
D.加入CaCl2溶液后体系中的c(H+)浓度不变
3.(2019陕西西安第一中学高三月考)常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)c(H+)=1×10-8。下列叙述正确的是( )
A.该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
B.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中:c(H+)+c(Na+)=c(A-)+c(OH-)
4.(2019山东菏泽高三一模)25 ℃时,向10 mL 0.1 mol·L-1的一元弱碱XOH溶液中逐滴滴加0.1 mol·L-1的HCl溶液,溶液的AG[AG=lgc(H+)c(OH-)]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
A.若a=-8,则Kb(XOH)≈10-5
B.M点表示盐酸和XOH恰好完全反应
C.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D.M点到N点,水的电离程度先增大后减小
5.(2019湖南师大附中高三月考)若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是( )
A.HNO2的电离平衡常数:c点>b点
B.b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C.c点混合溶液中:c(OH-)>c(HNO2)
D.d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
6.(2019河南南阳第一中学高三质检)一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释到体积为原来的10倍后,其pH=b,则a
②>①
7.(2019河南开封一模)常温下向10 mL 0.1 mol·L-1的HR溶液中逐滴加入0.1 mol·L-1的氨水,所得溶液pH及导电性变化如图。下列分析正确的是( )
A.a~c点,溶液中离子数目先增大后减小
B.b点溶液pH=7说明c(NH4+)=c(R-)
C.c点溶液存在c(NH4+)>c(R-)>c(H+)>c(OH-)
D.b、c两点对应溶液中,水的电离程度相同
8.(2019安徽A10联盟高三开年考试)常温下,向20 mL 0.01 mol·L-1的NaOH溶液中逐滴加入0.01 mol·L-1的CH3COOH溶液,溶液中水所电离出的c(OH-)的对数随加入CH3COOH溶液的体积变化如图所示,下列说法正确的是( )
A.F点溶液显中性
B.若G点由水电离出的c(OH-)=2.24×10-6 mol·L-1,则Ka(CH3COOH)≈1×10-6
C.H点离子浓度关系为c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.E点由水电离的c(H+)=10-3 mol·L-1
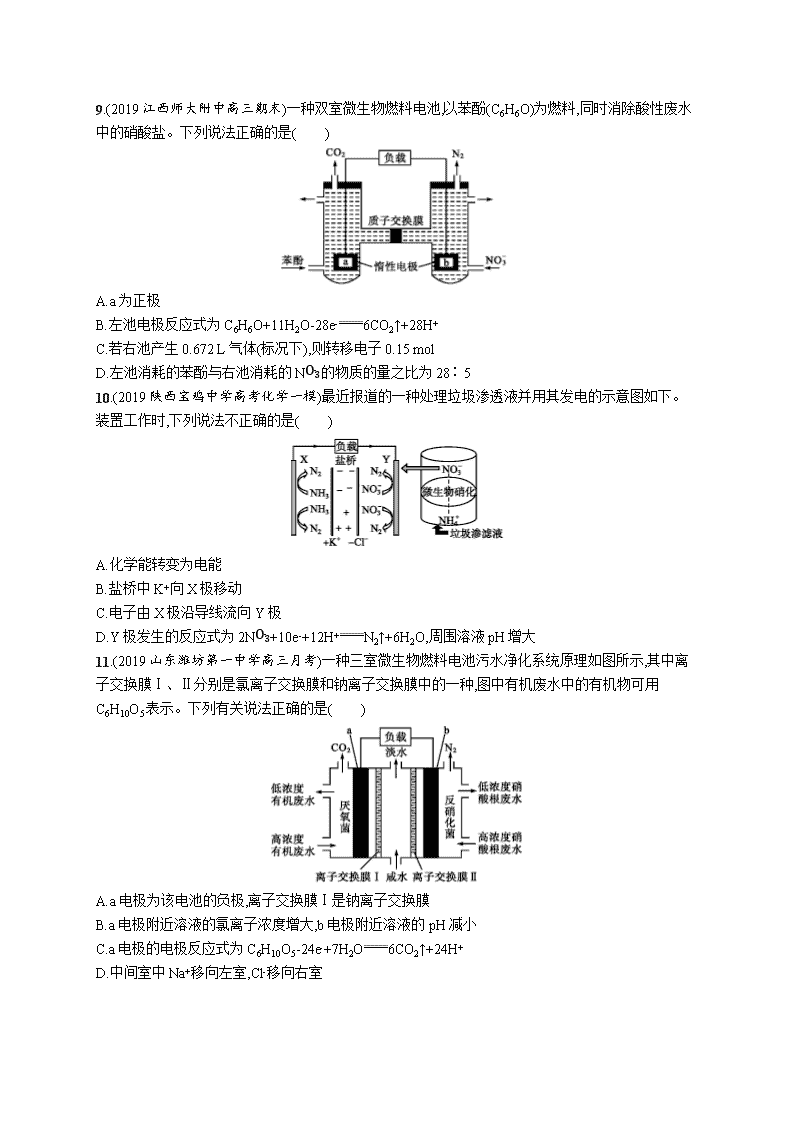
9.(2019江西师大附中高三期末)一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐。下列说法正确的是( )
A.a为正极
B.左池电极反应式为C6H6O+11H2O-28e-6CO2↑+28H+
C.若右池产生0.672 L气体(标况下),则转移电子0.15 mol
D.左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28∶5
10.(2019陕西宝鸡中学高考化学一模)最近报道的一种处理垃圾渗透液并用其发电的示意图如下。装置工作时,下列说法不正确的是( )
A.化学能转变为电能
B.盐桥中K+向X极移动
C.电子由X极沿导线流向Y极
D.Y极发生的反应式为2NO3-+10e-+12H+N2↑+6H2O,周围溶液pH增大
11.(2019山东潍坊第一中学高三月考)一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜Ⅰ、Ⅱ分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是( )
A.a电极为该电池的负极,离子交换膜Ⅰ是钠离子交换膜
B.a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C.a电极的电极反应式为C6H10O5-24e-+7H2O6CO2↑+24H+
D.中间室中Na+移向左室,Cl-移向右室
12.(2019河南开封一模)某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是( )
A.放电时,负极的电极反应式为Li-e-Li+
B.放电时,电子通过电解质从Li流向Fe2O3
C.充电时,Fe作阳极,电池逐渐摆脱磁铁吸引
D.充电时,阳极的电极反应式为2Fe+3Li2O-6e-Fe2O3+6Li+
13.(2019广东深圳高三调研)下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是( )
A.充电时,a为电源正极
B.充电时,Cl-向Bi电极移动,Na+向NaTi2(PO4)3电极移动
C.放电时,正极的电极反应式为BiOCl+2H++3e-Bi+Cl-+H2O
D.充电时,新增入电极中的离子:n(Na+)∶n(Cl-)=1∶3
14.(2019山西五地高三期末)以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
上述装置工作时,下列有关说法正确的是( )
A.Na+由乙池穿过交换膜进入甲池
B.甲池电极反应为4CO32-+2H2O-4e-4HCO3-+O2↑
C.乙池电极接电源正极,气体X为H2
D.NaOH溶液Y比NaOH溶液Z的浓度小
15.(2019福建福州高三质量检测)乙醛酸(HOOC—CHO)是一种重要的有机合成中间体。在乙二酸(HOOC—COOH)电还原法合成乙醛酸的基础上,化学工作者创新性地提出双极室成对电解法装置模型及工作原理如图所示。下列说法中错误的是( )
A.该离子交换膜应选择阳离子交换膜
B.HCl是制取乙醛酸反应的催化剂,并起导电作用
C.该方法的总反应为OHC—CHO+HOOC—COOH2HOOC—CHO
D.乙二醛、乙二酸分别在阴、阳电极表面放电,故称为双极室成对电解法
16.(2019湖南湖北八市十二校高三第二次调研)国内某科技研究小组首次提出一种新型的Li+电池体系,该体系正极采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如下)。已知I-+I2I3-,则下列有关判断正确的是( )
A.图甲是原电池工作原理图,图乙是电池充电原理图
B.放电时,正极液态电解质溶液的颜色变浅
C.充电时,Li+从右向左通过聚合物离子交换膜
D.放电时,负极的电极反应式为
17.(2019华中师大第一附属中学高三期中)下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
A.放电时,负极反应为3NaBr-2e-NaBr3+2Na+
B.充电时,阳极反应为2Na2S2-2e-Na2S4+2Na+
C.放电时,Na+经过离子交换膜,由b池移向a池
D.用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40 g Na2S4
18.(2019湖北武汉第六中学高三月考)微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,该电池的工作原理和废水中Cr2O72-的浓度与去除率的关系如下图。下列说法正确的是( )
A.反应一段时间后,N极附近的溶液pH下降
B.外电路转移4 mol电子时,M极产生22.4 L CO2
C.Cr2O72-浓度较大时,可能会造成还原菌失活
D.M为电池正极,CH3COOH被还原
19.(2019四川泸县第四中学高三二诊模拟)目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N为离子交换膜。下列说法正确的是( )
A.X电极为电解池的阴极,该电极反应式为2H+-2e-H2↑
B.电子流向:电源负极→X电极→Y电极→电源正极
C.电路中每转移1 mol电子,X、Y两极共得到标准状况下16.8 L的气体
D.M为阳离子交换膜,A室获得副产品NaOH,若去掉B室双极膜,B室产物不变
参考答案
1.B 解析 根据物料守恒0.1 mol·L-1 Na2SO3溶液中:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)=0.2 mol·L-1,故A错误;氨水是弱碱溶液,若a+b=14,pH=a的稀硫酸与pH=b的氨水等体积混合后氨水过量,故B正确;0.2 mol·L-1
CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合,溶质为等浓度的CH3COOH和CH3COONa,由物料守恒和电荷守恒可得到2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故C错误;pH相同的三种溶液,NH4HSO4是强酸的酸式盐,c(NH4+)最小,NH4Cl、(NH4)2SO4溶液因为铵根水解呈酸性,pH相同,所以c(NH4+)相同,故c(NH4+)大小关系为①=②>③,故D错误。
2.B 解析 HF为弱电解质,不能完全电离,因此0.1 mol·L-1HF溶液中c(H+)<0.1 mol·L-1,故pH>1,故A错误;向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,刚混合时溶液中c(H+)=c(F-)=3.6×10-4×0.1 mol·L-1=6×10-3 mol·L-1,c(Ca2+)=0.1 mol·L-1,则c2(F-)×c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,则该体系中有CaF2沉淀产生,故B正确;溶度积只受温度的影响,不随浓度的变化而变化,故C错误;溶液中存在电离平衡HFH++F-和溶解平衡CaF2(s)Ca2+(aq)+2F-(aq),加入CaCl2溶液后,Ca2+浓度增大,沉淀溶解平衡向生成沉淀的方向移动,则F-浓度减小,促进HF的电离,则c(H+)浓度增大,故D错误。
3.D 解析 溶液中c(OH-)c(H+)=1×10-8,由KW=c(H+)×c(OH-)=10-14可得c(H+)=10-3 mol·L-1,酸溶液中由水电离出的c(H+)等于溶液中的c(OH-)=10-11 mol·L-1,故A错误;由于HA是弱酸,pH=3的HA溶液与pH=11的NaOH溶液等体积混合后酸过量,溶液呈酸性,由电荷守恒可得c(A-)>c(Na+)>c(H+)>c(OH-),故B错误;浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,说明HA电离大于NaA的水解,c(A-)>c(Na+)>c(HA),故C错误;0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中,存在的阳离子是H+、Na+,阴离子有A-、OH-,根据电荷守恒可得c(H+)+c(Na+)=c(A-)+c(OH-),故D正确。
4.B 解析 a点表示0.1 mol·L-1一元弱碱XOH溶液,若a=-8,则c(OH-)=10-3 mol·L-1,所以Kb(XOH)≈c(X+)·c(OH-)c(XOH)=10-3×10-30.1=10-5,故A正确;两者恰好反应时,生成强酸弱碱盐,溶液显酸性。M点AG=0,则溶液中c(H+)=c(OH-),溶液呈中性,所以溶质为XOH和XCl,两者不是恰好完全反应,故B错误;若R点恰好为XCl溶液时,根据物料守恒可得c(X+)+c(XOH)=c(Cl-),故C正确;M点的溶质为XOH和XCl,继续加入盐酸,直至溶质全部为XCl时,该过程水的电离程度先增大,然后XCl溶液中再加入盐酸,水的电离程度又减小,所以从M点到N点,水的电离程度先增大后减小,故D正确。
5.B 解析 HNO2的电离是吸热过程,温度越高电离平衡常数越大,而c点温度高于b点,所以电离平衡常数c点>b点,故A正确;b点得到HNO2和NaNO2的混合溶液显酸性,说明电离大于水解,所以离子浓度大小为c(NO2-)>c(Na+)>c(H+)>c(OH-),故B错误;c点温度最高,说明两者恰好完全反应,而c→d温度降低,说明溶液中以盐的水解为主,所以c点得到NaNO2溶液是强碱弱酸盐,溶液呈碱性,所以c(OH-)>c(HNO2),故C正确;d点混合溶液中当c(NaOH)较大时,得到NaOH和NaNO2的混合溶液,所以离子的浓度为c(Na+)>c(OH-)>c(NO2-)>c(H+),故D正确。
6.B 解析 H2S为二元弱酸,分步电离,H2S溶液中存在平衡H2SH++HS-、HS-H++S2-、H2OH++OH-,因此pH=5的H2S溶液中,c(H+)=1×10-5 mol·L-1>c(HS-),故A错误;加水稀释促进NH3·H2O电离,pH=a的氨水,稀释到体积为原来的10倍后,溶液中的氢氧根离子浓度大于原来的110,其pH=b,则aH2CO3>HClO,根据盐类水解规律:组成盐的酸根离子对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,则pH越大,故pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液中溶质的浓度由大到小为①>②>③,即c(Na+)大小为①>②>③,故D错误。
7.B 解析 根据图像可知a~b点,溶液的导电能力增强,b~c点溶液的导电能力减弱,说明从a~c点溶液中自由移动的离子浓度先增大后减小,但是离子总数目在整个过程中一直在增大,A错误;根据图像可知b点溶液的pH=7,c(H+)=c(OH-),结合电荷守恒c(H+)+c(NH4+)=c(R-)+c(OH-),可得出c(NH4+)=c(R-),B正确;根据图像可知c点溶液的pH>7,说明c点溶液中离子浓度c(OH-)>c(H+),C错误;由曲线起点的pH可知HR为弱酸,b点溶液的pH=7时溶液的导电性最强,两者恰好完全反应生成弱酸弱碱盐,该盐水解促进水的电离,而c点溶液显碱性,说明氨水过量,氨水电离产生OH-会抑制水的电离,使水的电离程度减小,所以水的电离程度b>c,D错误。
8.C 解析 氢氧化钠抑制水的电离,向氢氧化钠溶液中加入醋酸,对水的电离的抑制作用逐渐减弱,当溶液为醋酸钠溶液时,水的电离程度最大,所以G点为醋酸钠溶液,从E到G为氢氧化钠和醋酸钠的混合溶液,溶液为碱性。F点为氢氧化钠和醋酸钠的混合溶液,溶液为碱性,故A错误;若G点由水电离出的c(OH-)=2.24×10-6 mol·L-1,根据醋酸根离子水解的离子方程式可知,溶液中c(CH3COOH)约等于c(OH-),醋酸钠的浓度为0.005 mol·L-1,则醋酸根离子的水解平衡常数为2.24×10-6×2.24×10-60.005≈1×10-9,则Ka(CH3COOH)=KW10-9≈1×10-5,故B错误;H点为醋酸钠和醋酸的混合溶液,溶液为中性,c(H+)=c(OH-),则根据电荷守恒有c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故C正确;E点为氢氧化钠溶液,氢氧化根离子浓度为0.01 mol·L-1,则溶液中水电离的氢离子浓度为10-12 mol·L-1,故D错误。
9.B 解析 根据装置示意图分析可知,a为负极,故A项错误;左池电极为负极,电极反应式为C6H6O+11H2O-28e-6CO2↑+28H+,故B项正确;右池产生的气体为氮气,n(N2)=0.672 L22.4 L·mol-1=0.03 mol,由正极的电极反应式可知转移电子的物质的量为0.3 mol,故C项错误;根据电子守恒,结合电极反应式可知左池消耗的苯酚与右池消耗的NO3-的物质的量之比应为5∶28,故D项错误。
10.B 解析 处理垃圾渗透液的装置属于原电池装置,该过程是化学能转化为电能,故A正确;处理垃圾渗透液的装置属于原电池装置,盐桥中的阴离子移向负极,即氯离子向X极移动,盐桥中K+向Y极移动,故B错误;电子由负极流向正极,即电子由X极沿导线流
向Y极,故C正确;Y是正极,发生得电子的还原反应,电极反应式为2NO3-+10e-+12H+N2↑+6H2O,消耗氢离子,周围溶液pH增大,故D正确。
11.C 解析 a电极为该电池的负极,负极反应生成氢离子,为维持溶液呈电中性,咸水中阴离子Cl-移向负极室左室,则离子交换膜Ⅰ是氯离子交换膜,故A错误;电解质溶液中阴离子Cl-移向负极室左室,a电极附近溶液的氯离子浓度增大,b电极消耗氢离子,附近溶液的pH增大,故B错误;a电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O6CO2↑+24H+,故C正确;放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl-移向负极室左室,故D错误。
12.B 解析 该电池在充、放电时的反应为6Li+Fe2O33Li2O+2Fe。放电时Li为负极,失去电子,发生氧化反应,电极反应式为Li-e-Li+,选项A正确;放电时,电子通过外电路从负极Li流向正极Fe2O3,不能经过电解质,选项B错误;充电时,Fe作阳极,失去电子发生氧化反应,被氧化变为Fe2O3,Fe2O3不能被磁铁吸引,故电池逐渐摆脱磁铁吸引,选项C正确;充电时,阳极失去电子发生氧化反应,该电极反应式为2Fe-6e-+3Li2OFe2O3+6Li+,选项D正确。
13.D 解析 充电时Bi→BiOCl失电子,所以Bi电极为阳极,a为电源正极,故A正确;充电时Bi电极为阳极,NaTi2(PO4)3电极为阴极,阴离子向阳极定向移动,阳离子向阴极定向移动,故B正确;放电时作为原电池,正极得电子发生还原反应,电极反应为BiOCl+2H++3e-Bi+Cl-+H2O,故C正确;充电时,阳极的电极反应式为Bi+Cl-+H2O-3e-BiOCl+2H+,阴极的电极反应式为NaTi2(PO4)3+2Na++2e-Na3Ti2(PO4)3,根据得失电子守恒可得n(Na+)∶n(Cl-)=3∶1,故D错误。
14.B 解析 根据题意分析可得甲池中电极为阳极,乙池中电极为阴极。Na+向阴极移动,由甲池穿过交换膜进入乙池,故A错误;甲池电极上水放电生成氧气和氢离子,氢离子与碳酸根反应生成碳酸氢根,电极反应式为4CO32-+2H2O-4e-4HCO3-+O2↑,故B正确;乙池电极为阴极,乙池电极接原电源负极,阴极上水放电生成氢气和氢氧根,故C错误;电解时,甲池得到碳酸氢钠,乙池得到氢氧化钠,则NaOH溶液Y比NaOH溶液Z的浓度大,故D错误。
15.D 解析 由图可知,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中D电极上HOOC—COOH得电子生成HOOC—CHO,C电极氯离子失电子生成氯气,氯气具有氧化性,能将醛基氧化为羧基,则乙二醛与氯气反应生成乙醛酸。根据以上分析可知,C为阳极,发生的反应为2Cl--2e-Cl2↑、OHC—CHO+Cl2+H2OHOOC—CHO+2Cl-+2H+,D为阴极,电极反应式为HOOC—COOH+2e-+2H+HOOC—CHO+H2O,氢离子由阳极向阴极移动,所以应选择阳离子交换膜,故A正确;由于阳极发生的反应为2Cl--2e-Cl2↑、OHC—CHO+Cl2+H2OHOOC—CHO+2Cl-+2H+,反应后HCl并没改变,所以HCl是制取乙醛酸反应的催化剂,并起导电作用,故B正确;根据两电极反应可知,总反应为OHC—CHO+HOOC—COOH2HOOC—CHO,故C正确;根据以上分析可知,
乙二醛在阳极被阳极产物氧化为HOOC—CHO,但乙二醛不在阳极表面放电;乙二酸在阴极得电子生成HOOC—CHO,故D错误。
16.B 解析 甲图是电子传向固体有机聚合物,电子传向负极材料,则图甲是电池充电原理图,图乙是原电池工作原理图,A项错误;放电时,正极液态电解质溶液的I2也会得电子生成I-,故电解质溶液的颜色变浅,B项正确;充电时,Li+向阴极移动,Li+从左向右通过聚合物离子交换膜,C项错误;放电时,负极失电子,故负极的电极反应式为
,D项错误。
17.C 解析 放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),则Na2S2在负极失电子,NaBr3在正极得电子。充电时,阴极反应为放电时负极的逆反应,阳极反应为放电时正极的逆反应,放电时负极Na2S2失电子,则负极的电极反应式为2S22--2e-S42-,故A错误;充电时,阳极上Br-失电子转化为Br3-,则阳极的电极反应式为3Br--2e-Br3-,故B错误;电池放电时,Na2S2和NaBr3反应,则电池的总反应方程式为2Na2S2+NaBr3Na2S4+3NaBr,Na+经过离子交换膜,由b池移向a池,故C正确;用该电池电解饱和食盐水,产生2.24 L H2时,此气体体积不一定是标准状况下的体积,不能进行计算,则b池生成Na2S4的质量不一定是17.40 g,故D错误。
18.C 解析 由图中信息可知,电池工作时,N极上氧气得到电子转化为水,氢离子浓度减小,故N附近溶液pH增大,选项A错误;负极上CH3COOH被氧化生成CO2,负极的电极反应式为CH3COOH-8e-+2H2O2CO2↑+8H+,外电路转移4 mol电子时,M极产生标况下的22.4 L CO2,选项B错误;由图可知,Cr2O72-浓度较大时,其去除率几乎为0,因其有强氧化性和毒性,可能会造成还原菌的蛋白质变性而失活,选项C正确;由题图可知,该电池中有机物在微生物作用下发生氧化反应生成二氧化碳,所以M电极为负极,氧气和Cr2O72-被还原,N电极为正极,选项D错误。
19.C 解析 电解池中阳离子向阴极移动,故X电极为阴极,电极反应式为2H++2e-H2↑,选项A错误;电子流向:电源负极→阴极X电极、阳极Y电极→电源正极,选项B错误;阴极反应为2H++2e-H2↑,阳极反应为4OH--4e-O2↑+2H2O,当电路中通过1 mol电子时,阴极得到0.5 mol H2,阳极得到0.25 mol O2,两极一共得到气体为0.5 mol+0.25 mol=0.75 mol,标准状况下气体体积为16.8 L,选项C正确;电解池中,电解时溶液中的阳离子向阴极移动,阴离子向阳极移动,因此M为阳离子交换膜,A室获得副产品NaOH,若去掉双极膜(BP),则Cl-会在阳极失去电子生成Cl2,在阳极室会有Cl2生成,B室产物发生变化,选项D错误。