2021版化学名师讲练大一轮复习鲁科新高考地区专用版题组训练过关:第5章 考点2 5-2元素周期表 元素周期律
温馨提示:
此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。
题组训练过关
微粒半径的大小比较
1.(改编)比较下列微粒半径大小,用“>”或“<”填空。
(1)Na________Mg________Cl
(2)Li________Na________K
(3)Na+________Mg2+________Al3+
(4)F-________Cl-________Br-
(5)Cl-________O2-________Na+________Mg2+
(6)Fe2+________Fe3+
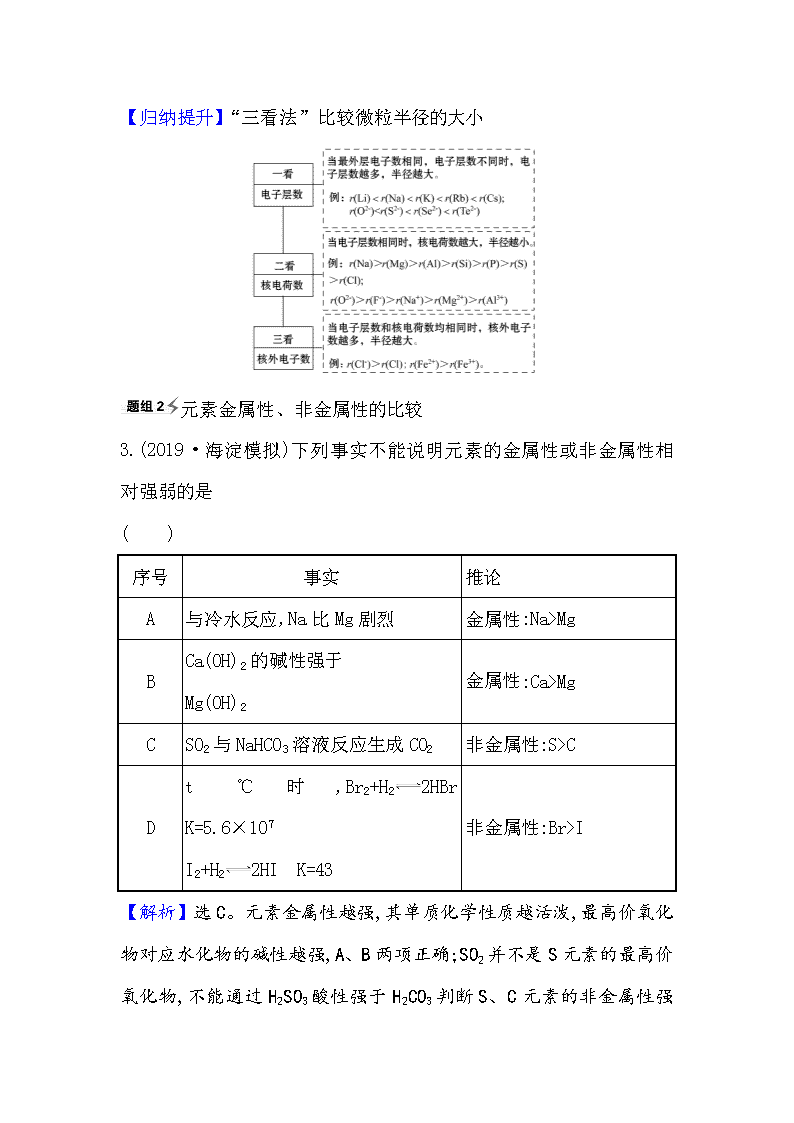
【解析】(1)Na、Mg、Cl同属于第三周期,电子层数相同,因此核电荷数越大半径越小,有Na>Mg>Cl。
(2)Li、Na、K同属于第ⅠA族,最外层电子数相同,因此电子层数越多,半径越大,故Li
Mg2+>Al3+。
(4)F-、Cl-、Br-属于同主族的阴离子(最外层电子数相同),因此电子层数越多,半径越大,故有F-Na+>Mg2+,所以有Cl->O2->Na+>Mg2+。
(6)Fe2+、Fe3+属于同一种元素的阳离子,其核内质子数均为26,Fe2+核外有24个电子,而Fe3+核外有23个电子,因此半径Fe2+>Fe3+。
答案:(1)> > (2)< < (3)> >
(4)< < (5)> > > (6)>
2.(双选)(2020·衡阳模拟改编)X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
元素
X
Y
Z
原子半径/nm
0.154
0.130
0.071
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是 ( )
A.原子最外层电子数:Z>X>Y
B.三种元素可能为同周期元素
C.原子序数:Y>X>Z
D.离子半径:Z>X>Y
【解析】选C、D。由已知得三种元素在周期表中相对位置为,最外层电子数Z>Y>X,故A、B错误;由位置可知,原子序数Y>X>Z,故C正确;具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径Z>X>Y,故D正确。
【归纳提升】“三看法”比较微粒半径的大小
元素金属性、非金属性的比较
3.(2019·海淀模拟)下列事实不能说明元素的金属性或非金属性相对强弱的是
( )
序号
事实
推论
A
与冷水反应,Na比Mg剧烈
金属性:Na>Mg
B
Ca(OH)2的碱性强于
Mg(OH)2
金属性:Ca>Mg
C
SO2与NaHCO3溶液反应生成CO2
非金属性:S>C
D
t ℃时,Br2+H22HBr K=5.6×107
I2+H22HI K=43
非金属性:Br>I
【解析】选C。元素金属性越强,其单质化学性质越活泼,最高价氧化物对应水化物的碱性越强,A、B两项正确;SO2并不是S元素的最高价氧化物,不能通过H2SO3酸性强于H2CO3
判断S、C元素的非金属性强弱,C项错误;非金属性越强,其单质越易与H2发生化合反应,D项正确。
4.(2020·福州模拟)下列实验不能作为判断依据的是( )
A.向等物质的量浓度的NaNO3溶液和Na2SiO3溶液中分别滴加3滴酚酞溶液,观察溶液的颜色,判断N和Si的非金属性强弱
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱
C.硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱
D.Br2和I2分别与H2反应的难易,判断溴与碘的非金属性强弱
【解析】选B。A项,由现象可知,Na2SiO3溶液水解显碱性,则硝酸的酸性大于硅酸,则非金属性:N>Si,正确;B项,铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液先和水反应生成氢氧化钠,再和CuSO4反应,不能置换铜,所以不能判断钠与铁的金属活动性强弱;C项,CO2通入硅酸钠溶液,发生强酸制取弱酸的反应,生成硅酸沉淀可以知道碳酸的酸性大于硅酸,正确;D项,卤素单质与氢气化合越容易,非金属性越强,可用Br2和I2分别与H2反应的难易,判断溴与碘的非金属性强弱,正确。
【归纳提升】金属性和非金属性强弱的判断方法
电离能、电负性
5.(2020·成都模拟)现有三种元素的基态原子的电子排布式如下: ①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是 ( )
A.第一电离能:③>②>①
B.原子半径:③>②>①
C.电负性:③>②>①
D.最高正化合价:③>②>①
【解析】选A。根据元素的基态原子的电子排布式可知,三种元素分别是S、P、F。一般非金属性越强,第一电离能越大,但P原子的3p轨道处于半充满状态,稳定性强,所以第一电离能大于S,A正确;原子半径应是②>①>③,B不正确;非金属性越强,电负性越大,应是③>①>②,C不正确;F没有正价,S最高价为+6,P最高价为+5,D不正确。
6.(2020·青岛模拟)已知X、Y元素同周期,且电负性X>Y,下列说法不正确的是 ( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y可能小于X,也可能大于X
C.含氧酸的酸性:X>Y
D.气态氢化物的稳定性:HmY小于HnX
【解析】选C。电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故A正确;一般同周期的主族元素的第一电离能随核电荷数的增加而逐渐增大,但当原子外围电子为全充满或半充满状态时第一电离能相对较高,则有第一电离能Y可能小于X,也可能大于X,故B正确;应为最高价的含氧酸的酸性X>Y,故C错误;非金属性X>Y,非金属性越强,气态氢化物越稳定,故X的气态氢化物的稳定性强,故D正确。
【加固训练】
1.(2020·吉安模拟)以下有关元素性质的说法不正确的是 ( )
A.具有下列电子排布式的原子中:
①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,
④1s22s22p63s23p4,原子半径最大的是①
B.具有下列价电子排布式的原子中:①3s23p1,
②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③
C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的电负性随原子序数增大而递增的是④
D.某元素气态基态原子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,
当它与氯气反应时可能生成的阳离子是X3+
【解析】选D。A项,①为Si,②为N,③为C,④为S,原子半径最大的为Si,正确;B项,①为Al,②为Si,③为P,④为S,第一电离能最大的为P,正确;C项,同一主族元素,电负性从上到下逐渐减小,同一周期主族元素,电负性从左到右逐渐增大,正确;D项,根据各级电离能变化趋势,基态原子的最外层应有2个电子,所以与Cl2反应时应呈+2价,不正确。
2.(2020·大连模拟)已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表数据判断,下列选项错误的是 ( )
元素
I1
I2
I3
I4
X
500
4 600
6 900
9 500
Y
580
1 800
2 700
11 600
A.元素X的常见化合价是+1价
B.元素Y是第ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
【解析】选D。X为第ⅠA族元素,Y为第ⅢA族元素;D项,若元素Y处于第三周期,则Y为Al,Al不与冷水反应。
【归纳提升】电离能、电负性的应用
(1)电离能常见的四个应用
①判断元素金属性的强弱:电离能越小,金属越容易失去电子,
金属性越强;反之越弱。
②判断元素的化合价:如果某元素的In+1≫In,则该元素的常见化合价为+n,如钠元素I2≫I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况:多电子原子中,元素的各级电离能逐渐增大,当电离能的变化出现突跃时,电子层数就可能发生变化。
④反映元素原子的核外电子排布特点:同周期元素原子的最外层电子排布是全空、半充满和全充满状态时,第一电离能就会反常得大,如第ⅡA族、ⅤA族元素。
(2)电负性常见的四个应用
①确定元素类型(电负性>1.8,一般为非金属元素;电负性<1.8,一般为金属元素)。
②确定化学键类型(一般两成键元素电负性差值>1.7,为离子键;两成键元素电负性差值<1.7,为共价键)。
③判断元素价态正、负(化合物中电负性大的元素呈现负价,电负性小的元素呈现正价)。
④判断元素金属性和非金属性强弱(表征原子得失电子能力强弱)。
关闭Word文档返回原板块