- 2021-08-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020新教材高中化学第2章化学键化学反
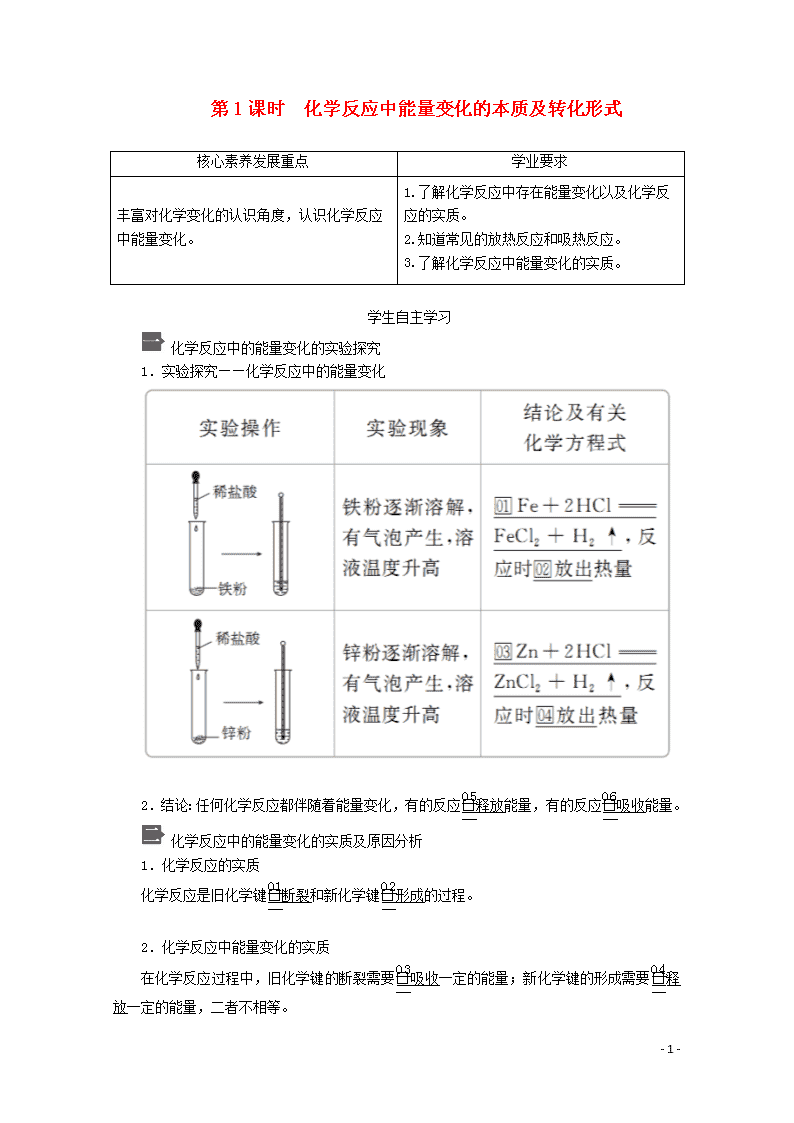
第1课时 化学反应中能量变化的本质及转化形式 核心素养发展重点 学业要求 丰富对化学变化的认识角度,认识化学反应中能量变化。 1.了解化学反应中存在能量变化以及化学反应的实质。 2.知道常见的放热反应和吸热反应。 3.了解化学反应中能量变化的实质。 学生自主学习 化学反应中的能量变化的实验探究 1.实验探究——化学反应中的能量变化 2.结论:任何化学反应都伴随着能量变化,有的反应释放能量,有的反应吸收能量。 化学反应中的能量变化的实质及原因分析 1.化学反应的实质 化学反应是旧化学键断裂和新化学键形成的过程。 2.化学反应中能量变化的实质 在化学反应过程中,旧化学键的断裂需要吸收一定的能量;新化学键的形成需要释放一定的能量,二者不相等。 - 6 - 3.化学反应中放出或吸收能量的原因 若形成新化学键所释放的总能量大于破坏旧化学键所吸收的总能量,就会有一定的能量以热能、电能或光能等形式释放出来能量;如果形成新化学键所释放的能量小于破坏旧化学键所吸收的能量,则需要吸收能量。 4.化学反应中能量转化的形式 化学反应的过程可以看作是“储存”在物质内部的能量(化学能)转化为热能、电能或光能等释放出来,或是热能、电能或光能等物质外部的能量转化为物质内部的能量(化学能)被“储存”起来的过程。 一个确定的化学反应发生时是吸收能量还是释放能量,取决于反应物的总能量与生成物的总能量的相对大小。 课堂互动探究 一、化学反应中的能量变化 1.放热反应一定容易发生,吸热反应一定难以发生吗? 提示:放热反应不一定容易发生,如合成氨的反应;吸热反应不一定难以发生,如Ca(OH)2与NH4Cl的反应。 2.需要加热才能发生的反应一定是吸热反应吗? 提示:不一定。如木炭的燃烧。 1.概念 放热反应:放出热量的化学反应; 吸热反应:吸收热量的化学反应。 2.常见的放热反应 (1)所有的燃烧反应,如木炭、H2、CH4等在氧气中的燃烧,H2在Cl2中的燃烧。 (2)酸碱中和反应,如H++OH-===H2O。 (3)大多数的化合反应,如H2+Cl22HCl。 (4)铝热反应,如8Al+3Fe3O44Al2O3+9Fe。 (5)活泼金属与酸或H2O的反应,如2Al+6H+===2Al3++3H2↑,2Na+2H2O===2Na++2OH-+H2↑。 3.常见的吸热反应 (1)铵盐与碱的反应,如Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O。 - 6 - (2)大多数的分解反应,如NH4ClHCl↑+NH3↑。 (3)碳与水蒸气的反应:C+H2O(g)CO+H2。 (4)以C、H2、CO为还原剂的氧化还原反应,如C+CO22CO。 知识拓展 化学反应中必然有能量变化,但有能量变化的过程不一定发生化学反应。如NaOH固体溶于水、水蒸气转化为液态水时放出能量,都是放热的物理变化过程而不是发生了放热反应;NH4NO3固体溶于水、碘升华、水蒸发时吸收能量,都是吸热的物理变化过程而不是发生了吸热反应。 1.下列说法不正确的是( ) A.大多数的化合反应是释放能量的反应 B.大多数的分解反应是吸收能量的反应 C.化学反应必然伴随着能量的变化 D.吸收能量的反应都需要加热 答案 D 解析 化学反应的能量变化与反应条件无关。 2.下列说法正确的是( ) ①需要加热才能发生的反应一定是吸热反应 ②伴有能量变化的物质变化都是化学变化 ③H2在O2中的燃烧是放热反应 ④放热反应加热到一定温度引发后,停止加热,反应仍能继续进行 A.③④ B.①② C.①②③④ D.②③④ 答案 A 解析 ①错:需要加热才能发生的反应不一定是吸热反应,如铝热反应。②错:冰融化成水、碘的升华、液体的汽化等物理变化过程以及核变化(如原子弹的爆炸)都伴随有能量变化,但它们都不是化学反应。③对:燃烧都是放热反应。④对:因为放热反应在反应过程中放出热量,可以维持反应的继续进行,所以停止加热后反应也可以继续进行。 规律方法 吸热反应与放热反应判断的注意事项 - 6 - (1)需要点燃、加热、光照的反应不一定是吸热反应,有些放热反应需要加热等条件引发反应。如H2在O2中的燃烧、木炭的燃烧等。 (2)不需要加热(在常温下)能进行的反应不一定是放热反应。如Ba(OH)2·8H2O与NH4Cl的反应为吸热反应,在常温下能反应。 (3)在高温下或持续加热条件下进行的反应一般是吸热反应。 (4)放热反应在常温下不一定能进行反应,吸热反应在常温下也可能进行反应。 二、化学反应中能量变化的原因 为什么所有化学反应前后都有能量的变化? 提示:因为化学反应一定有旧化学键的断裂和新化学键的形成,旧化学键断裂吸收的能量与新化学键形成释放的能量不等。 1.从化学键的断裂与形成分析能量变化 ①若E1>E2,反应吸收能量(吸热反应); ②若E1查看更多