2020届二轮复习化学反应与能量变化学案(全国通用)(2)
研析最新考纲
洞悉命题热点
1.了解化学反应中能量转化的原因及常见的能量转化形式。
2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义,能正确书写热化学方程式。
4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
5.了解焓变(ΔH)与反应热的含义。
6.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。
1.热化学方程式的书写及正误判断
2.盖斯定律的应用、反应热的计算
3.燃烧热、中和热的意义及计算
[全国卷]
(2014·全国卷Ⅱ)室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A. ΔH2>ΔH3 B. ΔH1<ΔH3
C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2>ΔH3
[解析] 1 mol CuSO4·5H2O(s)溶于水会使溶液温度降低,为吸热反应,故ΔH1>0,1 mol CuSO4(s)溶于水会使溶液温度升高,为放热反应,故ΔH2<0,1 mol CuSO4·5H2O(s)溶于水可以分为两个过程,先分解成1 mol CuSO4(s)和5 mol水,然后1 mol CuSO4(s)再溶于水,CuSO4·5H2O的分解为吸热反应,即ΔH3>0,根据盖斯定律得到关系式ΔH1=ΔH2+ΔH3,分析得到答案:ΔH1<ΔH3。
[答案] B
[省市卷]
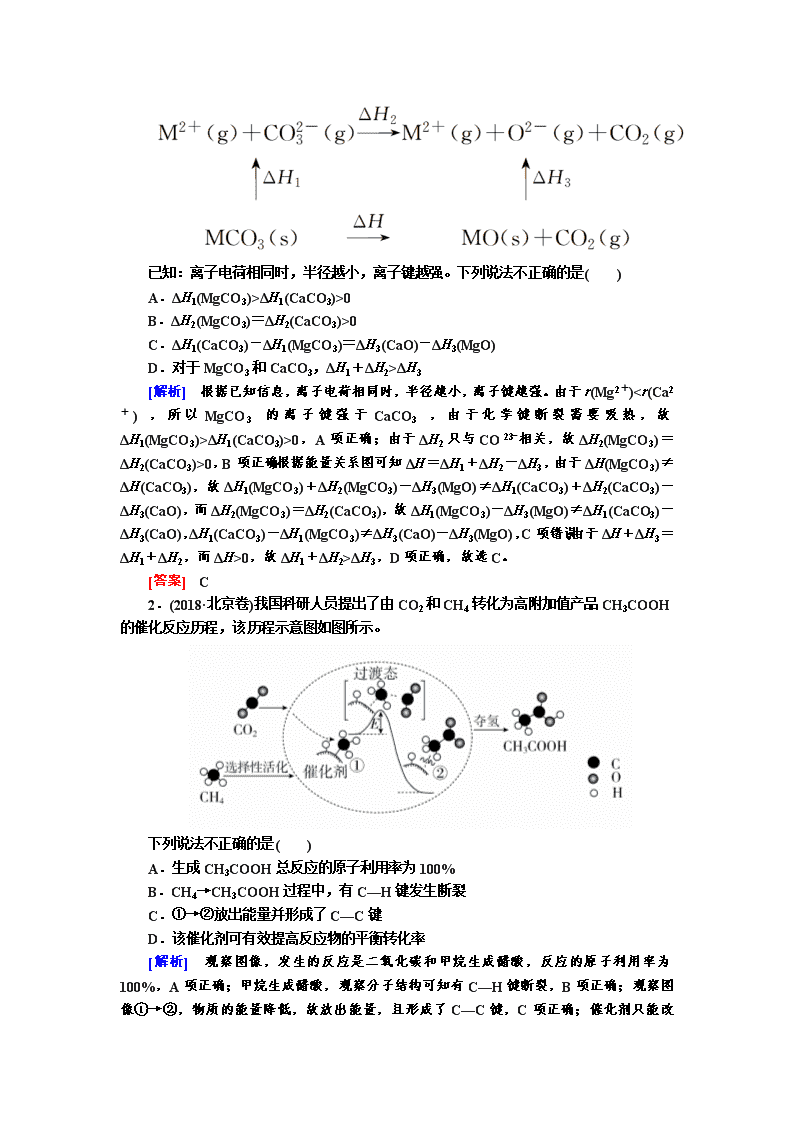
1.(2019·浙江卷)MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是( )
A.ΔH1(MgCO3)>ΔH1(CaCO3)>0
B.ΔH2(MgCO3)=ΔH2(CaCO3)>0
C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
[解析] 根据已知信息,离子电荷相同时,半径越小,离子键越强。由于r(Mg2+)
ΔH1(CaCO3)>0,A项正确;由于ΔH2只与CO相关,故ΔH2(MgCO3)=ΔH2(CaCO3)>0,B项正确;根据能量关系图可知ΔH=ΔH1+ΔH2-ΔH3,由于ΔH(MgCO3)≠ΔH(CaCO3),故ΔH1(MgCO3)+ΔH2(MgCO3)-ΔH3(MgO)≠ΔH1(CaCO3)+ΔH2(CaCO3)-ΔH3(CaO),而ΔH2(MgCO3)=ΔH2(CaCO3),故ΔH1(MgCO3)-ΔH3(MgO)≠ΔH1(CaCO3)-ΔH3(CaO),ΔH1(CaCO3)-ΔH1(MgCO3)≠ΔH3(CaO)-ΔH3(MgO),C项错误;由于ΔH+ΔH3=ΔH1+ΔH2,而ΔH>0,故ΔH1+ΔH2>ΔH3,D项正确,故选C。
[答案] C
2.(2018·北京卷)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如图所示。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
[解析] 观察图像,发生的反应是二氧化碳和甲烷生成醋酸,反应的原子利用率为100%,A项正确;甲烷生成醋酸,观察分子结构可知有C—H键断裂,B项正确;观察图像①→②,物质的能量降低,故放出能量,且形成了C—C键,C
项正确;催化剂只能改变反应速率,不影响平衡的转化率,D项错误。
[答案] D
3.(2018·浙江卷)已知:H2O(g)===H2O(l) ΔH1
C6H12O6(g)===C6H12O6(s) ΔH2
C6H12O6(s)+6O2(g)===6H2O(g)+6CO2(g) ΔH3
C6H12O6(g)+6O2(g)===6H2O(l)+6CO2(g) ΔH4
下列说法正确的是( )
A.ΔH1<0,ΔH2<0,ΔH3<ΔH4
B.6ΔH1+ΔH2+ΔH3-ΔH4=0
C.-6ΔH1+ΔH2+ΔH3-ΔH4=0
D.-6ΔH1+ΔH2-ΔH3+ΔH4=0
[解析] 将题给4个已知反应分别命名为反应1、反应2、反应3、反应4,ΔH3与ΔH4所对应的反应均为放热反应,且反应4所放出的热量大于反应3所放出的热量,则ΔH3>ΔH4,A项错误;由盖斯定律可知6×反应1+反应2+反应3=反应4,所以6ΔH1+ΔH2+ΔH3=ΔH4,B项正确,C、D项错误。
[答案] B
考点一 反应热 热化学方程式
1.从两种角度理解化学反应热
反应热图示
图像
分析
微观
宏观
a表示断裂旧化学键吸收的热量;
b表示生成新化学键放出的热量;
c表示反应热
a表示反应物的活化能;
b表示活化分子形成生成物释放的能量;
c表示反应热
ΔH的计算
ΔH=H(生成物)-H(反应物)
ΔH=∑E(反应物键能)-∑E(生应物键能)
2.热化学方程式书写的注意事项
[注意] (1)注意同素异形体转化的名称问题
对于具有同素异形体的物质,除了要注明聚集状态之外,还要注明物质的名称。
(2)注意可逆反应中的反应热及热量变化问题
由于反应热是指反应完全时的热效应,所以对于可逆反应,当反应物起始时的物质的量与其化学计量数相同时,其实际放出或吸收的热量要小于反应热。
3.燃烧热和中和热应用中的注意事项
(1)均为放热反应,ΔH<0,单位为kJ·mol-1。
(2)燃烧热概念理解的三要点:①外界条件是25℃、101 kPa;②反应的可燃物是1 mol;③生成物是稳定的氧化物(包括状态),如碳元素生成的是CO2,而不是CO,氢元素生成的是液态水,而不是水蒸气。
(3)中和热概念理解三要点:①溶液是稀溶液,不存在稀释过程中的热效应;②生成产物水是1 mol;③反应物的酸碱是强酸、强碱时的ΔH=-57.3 kJ·mol-1。
1.(2019·湖南省四校摸底调研联考)一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
A.这些离子中结合H+能力最强的是E
B.A、B、C、D、E五种微粒中C最稳定
C.C―→B+D,反应物的总键能大于生成物的总键能
D.B―→A+D反应的热化学力程式为:3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116 kJ·mol-1
[解析] 酸越弱,对应的阴离子结合H+的能力越强,HCl为强酸,而HClOx中x值越大,酸性越强,因此HClO的酸性最弱,且为弱酸,故这些离子中结合H+能力最强的是B(ClO-),A项错误;A、B、C、D、E五种微粒中A(Cl-)的能量最低,根据能量越低越稳定可知,A(Cl-)最稳定,B项错误;C―→B+D的热化学方程式为:2ClO(aq)===ClO-(aq)+ClO(aq) ΔH=(60+64-2×100) kJ·mol-1=-76 kJ·mol-1,该反应为放热反应,反应物总能量高于生成物总能量,但反应物总键能小于生成物总键能,C项错误;B―→A+D反应的热化学方程式为:3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=(64-60×3) kJ·mol-1=-116 kJ·mol-1,D项正确。
[答案] D
2.(2019·山东青岛模拟)下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)===C(金刚石) ΔH=+1.90 kJ·mol-1可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,则放出的热量大于57.3 kJ
[解析] S(g)变为S(s)为放热过程,则等量的S(g)和S(s)在O2中分别完全燃烧,放出热量S(g)多,即前者放出热量多,故A错误;石墨转化为金刚石为吸热反应,可以知道,金刚石具有的能量多,则石墨比金刚石稳定,故B错误;2 g H2即1 mol H2在101 kPa时,燃烧放热为285.8 kJ,则2 mol H2燃烧放热为571.6 kJ,故C错误;浓H2SO4溶解放热,所以放出的热大于57.3 kJ,故D正确。
[答案] D
考点二 盖斯定律 焓变的计算
1.盖斯定律
(1)定律内容
一定条件下,一个反应不管是一步完成,还是分几步完成,反应的总热效应相同,即反应热的大小与反应途径无关,只与反应的始态和终态有关。
(2)常用关系式
2.反应热的计算方法
(1)根据热化学方程式计算:反应热与反应物和生成物各物质的物质的量成正比。
(2)根据反应物和生成物的总能量计算。
(3)依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算。
(4)根据盖斯定律进行计算。
(5)根据物质燃烧热数值计算:Q(放)=n(可燃物)×|ΔH|。
(6)根据比热公式进行计算:Q=c·m·ΔT。
【典例】 (2019·广东惠州三调)工业上可采用氧化法除去NO,热化学方程式如下:
①NO(g)+O3(g)===NO2(g)+O2(g)ΔH1=-200.9 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)ΔH2=-116.2 kJ·mol-1
③3NO(g)+O3(g)===3NO2(g)ΔH3
下列说法正确的是( )
A.上述反应③中,ΔH3=-84.7 kJ·mol-1
B.反应②和③在高温下能自发进行
C.2O3(g)===3O2(g) ΔH=-285.6 kJ·mol-1
D.1 mol O3(g)具有的能量比1 mol O2(g)高142.8 kJ
[思路点拨]
[解析] A项,由盖斯定律知,ΔH3=ΔH1+ΔH2=-317.1 kJ·mol-1,错误;B项,反应②、③是熵减、焓减反应,在较低温度下能自发进行,错误;C项,①×2-②得:2O3(g)===3O2(g) ΔH=-200.9 kJ·mol-1×2+116.2 kJ·mol-1=-285.6 kJ·mol-1,正确;D项,1 mol O3(g)具有的能量比1.5 mol O2(g)多142.8 kJ,错误。
[答案] C
题组一:盖斯定律的应用
1.(2019·泉州二模)一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
下列选项不正确的是( )
A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
B.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH3<ΔH1
C.若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ
D.若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol
[解析] A项,得出:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH= kJ·mol-1=-867 kJ·mol-1,正确;B项,H2O(g)===H2O(l) ΔH<0,因此两式相加,ΔH3<ΔH1,正确;C项,根据A选项,放出热量为(867×0.2) kJ=173.4 kJ,但没有说明H2O的状态,若是气态,则正确,若是液态,则大于173.4 kJ,不正确;D项,根据A选项,消耗1 mol CH4转移8 mol e-,则消耗0.1 mol CH4转移电子为0.8 mol,正确。
[答案] C
2.(2019·重庆市七校联合考试)利用热化学循环系统在较低温度下可将水或硫化氢转变为氢气,其原理如下图所示:
下列说法不正确的是( )
A.反应②也是资源化利用SO2的方法之一
B.由系统(Ⅱ)中的反应可得:H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1
C.制取等物质的量的氢气,系统(Ⅰ)所需的能量较多
D.缩小反应③所在容器的体积,可提高HI的转化率
[解析] 反应②是吸收SO2生成HI和H2SO4的反应,所以该反应也是SO2资源化利用的方法之一,A项正确;根据盖斯定律,由②+③+④得H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1,B项正确;根据盖斯定律,由①+②+③得H2O(l)===H2(g)+O2(g) ΔH=+286 kJ·mol-1,而H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1,故制取等物质的量的H2,系统(Ⅰ)所需的能量较多,C项正确;反应③中只有H2为气态,缩小容器体积,平衡逆向移动,HI的转化率减小,D项错误。
[答案] D
题组二:焓变的计算
3.(2019·保定调研)已知氢气的燃烧热为286 kJ·mol-1,N2与O2反应的热化学方程式为N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,且N2(g)与H2(g)在铁催化剂表面反应生成NH3(g)的过程如图所示。
则氨气的催化氧化反应4NH3(g)+5O2(g)===4NO(g)+6H2O(l)的ΔH为( )
A.+1540 kJ·mol-1 B.-1540 kJ·mol-1
C.+1172 kJ·mol-1 D.-1172 kJ·mol-1
[解析] 由氢气的燃烧热可写出热化学方程式①H2(g)+O2(g)===H2O(l) ΔH1=-286 kJ·mol-1;由合成氨的能量变化图像可得合成氨反应②H2(g)+N2(g)??NH3(g) ΔH2=1127 kJ·mol-1-(324+389+460) kJ·mol-1=-46 kJ·mol-1;结合题给反应③N2(g)+O2(g)===2NO(g) ΔH3=+180 kJ·mol-1,根据盖斯定律,由①×6-②×4+③×2,即得4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=ΔH1×6-ΔH2×4+ΔH3×2=-1172 kJ·mol-1。
[答案] D
4.(2019·大连二模)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H键、O===O键和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.-332 B.-118
C.+350 D.+130
[解析] 根据盖斯定律,由第一个反应×2-第二个反应得,2H2O(g)===O2(g)+2H2(g) ΔH=(2a+220) kJ·mol-1。根据反应热与键能的关系计算,则2a+220=4×462-(436×2+496),解得a=+130。
[答案] D
根据盖斯定律计算ΔH的步骤和方法
专题强化训练(五)
能力练(20分钟)
一、选择题
1.(2019·福州质量抽测)已知化学反应A2(g)+B2(g)===2AB(s)的能量变化如图所示,下列叙述正确的是( )
A.该反应可以自发进行
B.ΔH=+(a-b) kJ·mol-1
C.使用催化剂可以减小a、b的差值
D.1 mol A2和1 mol B2完全分解为气态原子需吸收a kJ能量
[解析] 该反应为吸热反应,ΔH>0,反应后气体分子数减小,ΔS<0,则ΔH-T·ΔS>0,故该反应不能自发进行,A项错误;该反应为吸热反应,ΔH=+(a-b) kJ·mol-1,B项正确;使用催化剂可以降低正、逆反应的活化能,但反应热不变,即a、b的差值不变,C
项错误;1 mol A2(g)和1 mol B2(g)完全分解为气态原子需吸收a kJ能量,D项错误。
[答案] B
2.(2019·长沙模拟)2 mol金属钠和1 mol氯气反应的能量关系如图所示,下列说法不正确的是( )
A.相同条件下,K(s)的(ΔH′2+ΔH′3)ΔH5
D.ΔH7<0,且该过程形成了分子间作用力
[解析] K比Na活泼,相同条件下K更易失去电子,则K(s)的(ΔH′2+ΔH′3)Br,故相同条件下,2Br(g)的ΔH′5>ΔH5,C项正确;NaCl为离子化合物,不能形成分子间作用力,D项错误。
[答案] D
3.(2019·贵阳市监测考试)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g)
ΔH=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)
ΔH=+640.5 kJ·mol-1
则反应FeO(s)+CO(g)===Fe(s)+CO2(g)的反应热约为( )
A.-109 kJ·mol-1 B.-218 kJ·mol-1
C.-232 kJ·mol-1 D.-1308 kJ·mol-1
[解析] 将已知热化学方程式依次编号为①、②、③,根据盖斯定律,由3×①-②-2×③得6FeO(s)+6CO(g)===6Fe(s)+6CO2(g) ΔH=-1308.2 kJ·mol-1,则FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-218 kJ·mol-1,B项正确。
[答案] B
4.(2019·山东潍坊调研)有关化学键的键能数据如表所示:
化学键
C—H
O===O
C—C
H—O
键能/(kJ·mol-1)
413
498
x
465
甲烷的燃烧热为890 kJ·mol-1,某种单质碳的燃烧热为395 kJ·mol-1,该单质碳中只存在C—C键且基本结构单元为正四面体,则x=( )
A.619.7 B.196.25
C.392.5 D.1138.1
[解析] 先根据燃烧热定义可写出:①C(s)+O2(g)===CO2(g) ΔH=-395 kJ·mol-1,②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。根据盖斯定律,②-①得:CH4(g)+O2(g)===C(s)+2H2O(l) ΔH=-495 kJ·mol-1。由于在碳的正四面体结构中,每个碳原子形成4个C—C键,每个C—C键由2个碳原子共有,故每个碳原子拥有的C—C键数目为2。结合反应热与键能的关系:ΔH=反应物的总键能-生成物的总键能,可得-495=(4×413+498)-(2x+4×465),计算得x=392.5。
[答案] C
5.(2019·河北省九校第二次联考)已知:P4(s)+6Cl2(g)===4PCl3(g) ΔH=-1266 kJ·mol-1,P4为正四面体结构,其中P—P键的键能为198 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1。下列说法正确的是( )
A.该反应在任何温度下都能自发进行
B.1 mol P4(s)和6 mol Cl2(g)具有的总能量比4 mol PCl3(g)具有的能量低
C.PCl3的电子式为
D.P—Cl键的键能为326 kJ·mol-1
[解析] ΔH-TΔS<0时反应才能自发进行,该反应的ΔH<0,ΔS<0,故该反应在低温下能自发进行,在高温下不能自发进行,A项错误;该反应为放热反应,反应物的总能量比生成物的总能量高,B项错误;PCl3的电子式为P··,·· ,C项错误;设P—Cl键的键能为x kJ·mol-1,则有:6×198+6×243-12x=-1266,解得x=326,D项正确。
[答案] D
6.(2019·武汉调研)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g)===CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程如图1所示,能量变化过程如图2所示,下列说法正确的是( )
A.由图1可知ΔH1=ΔH+ΔH2
B.加入Pt2O+,可使反应的焓变减小
C.为了实现转化需不断补充Pt2O+和Pt2O
D.由图2可知正反应的活化能小于逆反应的活化能
[解析] 由图1可得①N2O(g)+Pt2O+(s)===Pt2O(s)+N2(g) ΔH1,②Pt2O(s)+CO(g)===Pt2O+(s)+CO2(g) ΔH2,根据盖斯定律,由①+②得N2O(g)+CO(g)===CO2(g)+N2(g) ΔH=ΔH1+ΔH2,A项错误;由图1可知,Pt2O+参与反应后又生成,Pt2O+是总反应的催化剂,Pt2O是中间产物,均不需要补充,催化剂只能改变反应的途径,不能改变反应的焓变,B、C项错误;ΔE1为正反应的活化能,ΔE2为逆反应的活化能,正反应的活化能较小,D项正确。
[答案] D
7.(2019·吉林百校联盟联考)肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。已知200℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1(200℃)=-32.9 kJ·mol-1
反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2(200℃)=-41.8 kJ·mol-1
下列说法不正确的是( )
A.图1所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1
[解析] 过程②是NH3在催化剂作用下分解生成N2和H2,根据盖斯定律,由反应Ⅰ-3×反应Ⅱ,得:2NH3(g)??N2(g)+3H2(g) ΔH=ΔH1-3ΔH2=(-32.9+3×41.8) kJ·mol-1=+92.5 kJ·mol-1,故过程②是吸热反应,A项错误;反应Ⅱ是放热反应,能量过程示意图正确,B项正确;放热反应中,反应物的化学键的键能之和小于生成物的化学键的键能之和,C项正确;根据盖斯定律,由反应Ⅰ-2×反应Ⅱ,得:N2H4(g)??N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1,D项正确。
[答案] A
二、非选择题
8.Ⅰ.(2019·合肥高三期末)减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体二氧化碳的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一。
已知:H2和CH4的燃烧热分别为285.5 kJ·mol-1和890.0 kJ·mol-1;
H2O(l)===H2O(g) ΔH=+44 kJ·mol-1。
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式______。
(2)CO2在Cu-ZnO催化下,可同时发生如下的反应ⅰ、ⅱ,其是解决温室效应及能源短缺的重要手段。
ⅰ.CO2(g)+3H2(g)??CH3OH(g)+H2O(g)
ΔH1=-57.8 kJ·mol-1
ⅱ.CO2(g)+H2(g)??CO(g)+H2O(g)
ΔH2=+41.2 kJ·mol-1
某温度时,若反应ⅰ的速度v1大于反应ⅱ的速度v2,则下列反应过程的能量变化正确的是________(填选项)。
Ⅱ.(2019·河北衡水调研)(3)甲醇与O2的反应体系中存在以下反应:2CH3OH+O2===2HCHO+2H2O、CH3OH+O2===CO+2H2O、2CO+O2===2CO2。工业生产中常用催化剂来选择反应进行的方向。如图所示为一定条件下1 mol CH3OH与O2发生反应时,分别生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
①在催化剂作用下,反应初始阶段CH3OH与O2反应主要生成________(填“CO”“CO2”或“HCHO”)。
②2HCHO(g)+O2(g)===2CO(g)+2H2O(g) ΔH=________。
(4)查阅文献,化学键的键能数据如表所示:
化学键
H—H
N—H
N≡N
键能/(kJ/mol)
436
391
946
已知氨分解反应NH3(g)??H2(g)+N2(g)的活化能Ea1=300 kJ·mol-1,则反应3H2(g)+N2(g)??2NH3(g)的活化能Ea2=________。
[解析] Ⅰ.(1)已知①H2(g)+O2(g)===H2O(l) ΔH=-285.5 kJ·mol-1,②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.0 kJ·mol-1,③H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,根据盖斯定律,由①×4-②+③×2得出:CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.0 kJ·mol-1。(2)①反应ⅰ是放热反应,反应物的总能量大于生成物的总能量,反应ⅱ是吸热反应,反应物的总能量小于生成物的总能量,因为反应ⅰ的速度大于反应ⅱ,因此反应ⅰ的活化能低于反应ⅱ,故D项正确。
Ⅱ.(3)①不理解反应速率与活化能之间的联系而无法判断。活化能越低,普通分子越容易转化成活化分子,反应越容易发生,反应速率越快,单位时间内生成的产物越多,由题图可知在催化剂作用下,CH3OH与O2反应生成HCHO的活化能降低,故反应初始阶段主要生成HCHO。②不能有效地提取图像所示信息去解决物质之间的能量转化情况。根据图示可知2HCHO(g)+O2(g)===2CO(g)+2H2O(g)中反应物能量高,生成物能量低,故该反应为放热反应,然后依据图中给出数据可得ΔH=-[(676-158-283)×2]kJ·mol-1=-470 kJ·mol-1。
(4)不能通过反应热将活化能与键能之间建立联系而出错。根据ΔH=反应物总键能-生成物总键能,可知反应3H2(g)+N2(g)??2NH3(g)的ΔH=3×436+946-2×3×391=-92 kJ·mol-1,再结合ΔH=正反应的活化能-逆反应的活化能=Ea2-2Ea1,可知Ea2=508 kJ·mol-1。
[答案] (1)CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.0 kJ·mol-1 (2)D
(3)①HCHO ②-470 kJ·mol-1 (4)508 kJ·mol-1
拔高练(25分钟)
一、选择题
1.(2019·成都摸底)下列说法正确的是( )
A.锂电池使用时,能量只存在由化学能到电能的转化
B.已知P4(白、s)===4P(红、s) ΔH=-18.4 kJ·mol-1,故白磷比红磷稳定
C.H2在Cl2中燃烧:H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则H2的燃烧热为184.6 kJ·mol-1
D.中和热测定时,其他不变,用醋酸代替盐酸测得的反应热ΔH偏大
[解析] 锂电池使用时,能量由化学能转化为电能和热能,A项错误;该反应为放热反应,说明白磷能量高,红磷能量低,故红磷比白磷稳定,B项错误;氢气的燃烧热是指25℃、101 kPa时,1 mol氢气完全燃烧生成液态水时放出的热量,C
项错误;测定中和热时,其他不变,若用醋酸代替盐酸,由于醋酸电离时吸收热量,则反应放出热量减小,但中和热为负值,因此中和热偏大,D项正确。
[答案] D
2.(2019·河南适应性考试)联氨(N2H4)常温下为无色液体,可用作火箭燃料。已知:
①2O2(g)+N2(g)===N2O4(l) ΔH1
②N2(g)+2H2(g)===N2H4(l) ΔH2
③O2(g)+2H2(g)===2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1048.9 kJ·mol-1
下列说法不正确的是( )
A.ΔH4=2ΔH3-2ΔH2-ΔH1
B.O2(g)+2H2(g)===2H2O(l) ΔH5,ΔH5>ΔH3
C.1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)具有的总能量
D.联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热
[解析] 根据盖斯定律,由③×2-②×2-①可得④,则ΔH4=2ΔH3-2ΔH2-ΔH1,A项正确;由于气态水液化时放热,故氢气和氧气反应生成液态水放出的热量多,放出的热量越多,ΔH越小,故ΔH5<ΔH3,B项错误;氢气和氧气反应生成水为放热反应,放热反应的反应物总能量高于生成物总能量,故1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)具有的总能量,C项正确;联氨和N2O4作火箭推进剂的原因是反应放出大量的热,并且产物无污染,D项正确。
[答案] B
3.(2019·长春市质量监测一)某化学反应2X(g)===Y(g)+Z(s)的能量变化如图所示,下列说法正确的是( )
A.2 mol X的键能低于1 mol Y的键能
B.升高温度,体系中活化分子百分数增加
C.加入催化剂,E1、E2和ΔH均发生改变
D.该反应一定能自发进行
[解析] 根据图像可知该反应是吸热反应,则ΔH=反应物的总键能-生成物的总键能>0,即2 mol X的键能一定高于1 mol Y和1 mol Z的键能,A
项错误;升高温度,体系中活化分子数增多,活化分子百分数增加,B项正确;使用催化剂,能降低反应的活化能,但ΔH不变,C项错误;该反应为吸热反应,且该反应熵变ΔS<0,即ΔH>0,ΔS<0,因此该反应一定不能自发进行,D项错误。
[答案] B
4.(2019·开封市高三定位考试)已知H2(g)+2ICl(g)===I2(g)+2HCl(g),该反应分①、②两步进行,其能量变化曲线如图所示,下列有关说法正确的是( )
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.HI(g)+ICl(g)===I2(g)+HCl(g) ΔH=-218 kJ·mol-1
[解析] 根据图像可知,反应①和反应②中反应物总能量都大于生成物总能量,故反应①和反应②均为放热反应,A项错误;反应①中H的化合价升高,I的化合价降低,故反应①是不同元素之间发生的氧化还原反应,反应②中I的化合价有升有降,其他元素化合价不变,故反应②是同种元素之间发生的氧化还原反应,B项错误;反应①比反应②的速率慢,因为反应①的正反应的活化能较大,反应②的正反应的活化能较小,C项正确;H2(g)+2ICl(g)===I2(g)+2HCl(g) ΔH=-218 kJ·mol-1,由于反应①的焓变未知,无法根据盖斯定律计算反应②的焓变,D项错误。
[答案] C
5.(2019·江西省红色七校第一次联考)下列说法不正确的是( )
A.已知冰的熔化热为6.0 kJ·mol-1,冰中氢键键能为20 kJ·mol-1,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,电离常数Ka=。若加水稀释,则CH3COOH??CH3COO-+H+向右移动,a增大,Ka不变
C.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成
NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
[解析] 1 mol冰熔化时,熔化热能破坏的氢键的物质的量为:=0.3 mol,占冰中氢键的百分数为×100%=15%,A项正确;醋酸溶液加水稀释,电离平衡向正反应方向移动,电离度增大,由于电离常数只与温度有关,Ka保持不变,B项正确;甲烷的标准燃烧热表示25℃、101 kPa时1 mol甲烷完全燃烧生成液态水时放出的热量,该热化学方程式正确,C项正确;合成氨的反应为可逆反应,0.5 mol N2和1.5 mol H2不能完全反应,生成的NH3小于1 mol,放热19.3 kJ,而热化学方程式N2(g)+3H2(g)2NH3(g) ΔH对应生成2 mol NH3,故放出热量大于38.6 kJ,ΔH<-38.6 kJ·mol-1,D项错误。
[答案] D
6.(2019·山西名校联考)中俄天然气项目将在2019年后首次输气,天然气作为民生工程受到人们普遍关注。已知天然气不完全燃烧的热化学方程式为2CH4(g)+3O2(g)===2CO(g)+4H2O(g) ΔH。且O===O键的键能为a kJ·mol-1,C—H键的键能为b kJ·mol-1,CO键的键能是c kJ·mol-1,O—H键的键能为d kJ·mol-1。则ΔH为( )
A.(2c+8d-3a-8b) kJ·mol-1
B.(2c+8d-3a-4b) kJ·mol-1
C.(3a+8b-2c-4d) kJ·mol-1
D.(3a+8b-2c-8d) kJ·mol-1
[解析] 反应焓变ΔH=反应物的总键能-生成物的总键能=3×a kJ·mol-1+2×4×b kJ·mol-1-2×c kJ·mol-1-4×2×d kJ·mol-1=(3a+8b-2c-8d) kJ·mol-1,D项正确。
[答案] D
7.(2019·湖北调研)工业合成氨是农业用氮肥的主要来源。合成氨的原料气之一——H2可用甲烷制得,反应的热化学方程式为CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH。下面是一组化学反应的能量变化曲线图:
下列热化学方程式书写正确的是( )
A.CH4(g)+O2(g)===CO2(g)+H2O(l) ΔH=-423.2 kJ·mol-1
B.2CO2(g)===2CO(g)+O2(g) ΔH=+282 kJ·mol-1
C.O2(g)+2H2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
D.CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=-161 kJ·mol-1
[解析] 由图甲中曲线变化及图像中标注的物质可知,热化学方程式中生成物水应为气态,A项错误;图乙中CO2、CO的计量数为1,而选项中的热化学方程式计量数为2,故ΔH=+564 kJ·mol-1,B项错误;根据图甲、图乙、图丙可写出3个热化学方程式:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-846.4 kJ·mo-1①;CO2(g)===CO(g)+O2(g) ΔH=+282 kJ·mol-1②;O2(g)+H2(g)===H2O(g) ΔH=-241.8 kJ·mol-1③;根据盖斯定律,①+②-③×3可得新的热化学方程式:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161 kJ·mol-1,D项错误。
[答案] C
二、非选择题
8.(2019·郑州质检)“一碳化工”是重要的化学工业,部分原理如下:
反应①:C(s)+O2(g)===CO(g) ΔH1
反应②:C(s)+H2O(g)??CO(g)+H2(g)
ΔH2=+130 kJ·mol-1
反应③:CO(g)+2H2(g)===CH3OH(g)
ΔH3=-90.1 kJ·mol-1
反应④:2CH3OH(g)??CH3OCH3(g)+H2O(g) ΔH4
反应④的能量变化如图所示:
反应⑤:3CH3OH(g)??CH3CH===CH2(g)+3H2O(g) ΔH5=-31.0 kJ·mol-1
已知:H2的燃烧热为285.8 kJ·mol-1,H2O的汽化热(在标准状况下,1 mol物质在一定温度下蒸发所需要的热量)为44 kJ·mol-1,回答下列问题:
(1)反应①的ΔH1=________kJ·mol-1。
(2)反应③中正反应的活化能________(填“大于”“小于”或“等于”)逆反应的活化能。
(3)反应④中使用催化剂的曲线是________(填“Ⅰ”或“Ⅱ”),曲线Ⅰ的峰中出现小波谷的原因是________________,
反应④的ΔH4=________kJ·mol-1。
(4)用适量的CO与H2反应,每生成420 g CH3CH===CH2(g)时,________(填“吸收”或“放出”)________kJ的热量。
[解析] (1)根据H2的燃烧热和H2O的汽化热可写出热化学方程式:⑥H2(g)+O2(g)===H2O(l) ΔH6=-285.8 kJ·mol-1;⑦H2O(l)===H2O(g) ΔH7=+44 kJ·mol-1。根据盖斯定律:①=②+⑥+⑦,则ΔH1=ΔH2+ΔH6+ΔH7=+130 kJ·mol-1-285.8 kJ·mol-1+44 kJ·mol-1=-111.8 kJ·mol-1。(2)反应③是放热反应,反应物的能量高,生成物的能量低,故反应物分子达到活化分子吸收的能量少,即正反应活化能小。(3)使用催化剂降低了反应的活化能,故使用催化剂的曲线是Ⅰ;曲线Ⅰ的峰中出现的小波谷对应的能量是生成的中间产物具有的能量,该催化反应包括反应物与催化剂生成中间产物、中间产物再与反应物生成产物两个反应过程,都有断键吸热和成键放热的过程。由图像可知,ΔH4=(152-286) kJ·mol-1 =-134 kJ·mol-1。(4)根据盖斯定律,③×3+⑤得3CO(g)+6H2(g)??CH3CH===CH2(g)+3H2O(g) ΔH=-90.1 kJ·mol-1×3-31.0 kJ·mol-1=-301.3 kJ·mol-1,故生成420 g(即10 mol)CH3CH===CH2(g)放出的热量是301.3 kJ·mol-1×10 mol=3013 kJ。
[答案] (1)-111.8 (2)小于
(3)Ⅰ 曲线Ⅰ的峰中出现的小波谷对应的能量是生成的中间产物具有的能量,该催化反应包括反应物与催化剂生成中间产物和中间产物与反应物再生成产物两个反应过程,都有断键吸热和成键放热的过程 -134 (4)放出 3013