- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年新教材高中化学课后作业16金属材料新人教版必修第一册
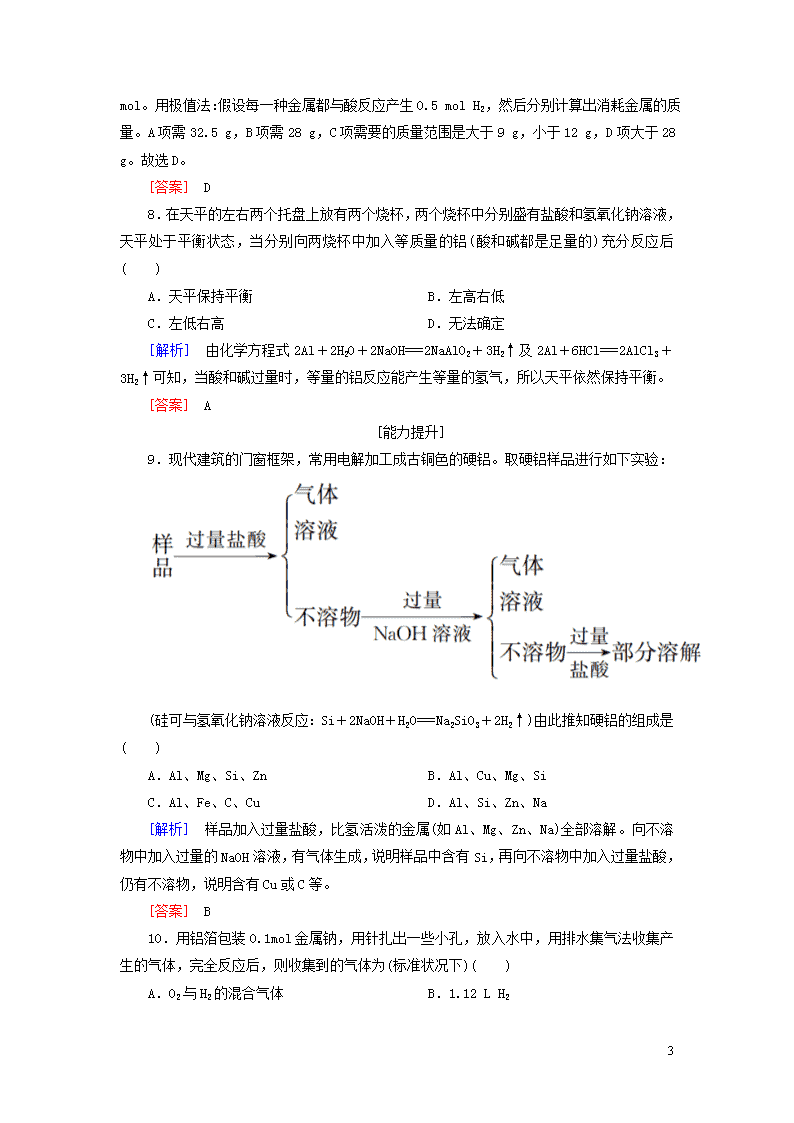
课后作业(十六) [基础巩固] 一、常见合金的性质 1.中国短道速滑队在索契冬奥会取得了骄人的成绩。速滑冰刀可用不锈钢制成,不锈钢含有的主要元素是( ) A.铁 B.碳 C.铜 D.铝 [解析] 钢的含碳量是0.03%~2%,不锈钢含有铁、碳、铬、镍等,故不锈钢含有的主要元素是铁元素。故A正确。 [答案] A 2.纯铁的熔点为1535 ℃,而高炉中炼铁时生铁(含碳量较高的铁的合金)在1200 ℃左右就熔化了,这是因为( ) A.铁的纯度越高,熔点越低 B.合金的熔点一般比其成分物质的熔点低 C.因为形成了铁碳合金,所以熔点变高 D.在高炉内熔化的过程中发生了化学反应 [答案] B 3.中国最新战机歼31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应如下:TiCl4+2MgTi+2MgCl2。下列有关该反应的说法正确的是( ) A.TiCl4是还原剂 B.Mg被氧化 C.TiCl4发生氧化反应 D.Mg得到电子 [解析] 分析方程式中元素化合价的变化。Ti元素化合价由+4降低到0价被还原作氧化剂,Mg元素化合价由0价升高到+2价,失去电子被氧化作还原剂,故B项正确。 [答案] B 4.下列成语或谚语中蕴含着一定的化学知识或原理,下列有关说法错误的是( ) A.百炼成钢——通过反复锤炼,除去铁中部分杂质,使其转化为钢 B.水滴石穿——CO2+H2O+CaCO3===Ca(HCO3)2(以大理石为例) C.恨铁不成钢——钢的性能远优于铁 D.真金不怕火炼——单质金的熔点很高 [解析] 百炼成钢的原理是生铁中的碳在高温下与氧气反应生成二氧化碳,使生铁中的含碳量降低,除去铁中部分杂质,使其转化为钢,故A说法正确;水滴石穿是因为水、二氧化碳和大理石的主要成分碳酸钙反应生成易溶于水的碳酸氢钙——CO2+H2O+CaCO3===Ca(HCO3)2 7 ,故B说法正确;恨铁不成钢——钢的性能远优于铁,故C说法正确;真金不怕火炼这句话的意思是:因为金元素的化学性质稳定,在通常的高温下不易与其他物质发生化学反应,且单质金的熔点不是很高,低于铁或铜的熔点,故D说法错误。 [答案] D 二、铝及铝合金 5.下列说法正确的是( ) A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物 B.因为Al2O3是金属氧化物,所以它是碱性氧化物 C.Al2O3能跟所有的酸碱溶液反应 D.Al2O3能跟强的酸碱溶液反应 [解析] Al2O3虽然难溶于水,但是2Al(OH)3Al2O3+3H2O,Al2O3和Al(OH)3中Al的化合价相同,所以Al2O3是Al(OH)3对应的氧化物;金属氧化物与碱性氧化物是两个不同的概念,二者没有必然的联系;Al2O3是两性氧化物;Al2O3与强酸、强碱反应,与弱酸、弱碱不反应。 [答案] D 6.氧化铝的熔点很高,常用于制造耐火材料,例如制作耐火坩埚。下列操作不能在氧化铝坩埚中进行的是( ) A.加热使CuSO4·5H2O失水 B.加热使KMnO4分解 C.加热熔化烧碱 D.加热分解碱式碳酸铜 [解析] 氧化铝能与强酸、强碱反应,所以用氧化铝材料制作的坩埚不能在强碱或强酸性条件下使用。A、B、D选项均为加热盐类操作,且在操作过程中都没有强碱性、强酸性物质生成。 [答案] C 7.某金属与盐酸反应时,生成H2的质量与消耗金属质量的关系如图所示,此金属可能是( ) A.纯锌 B.纯铁 C.镁铝合金 D.铜铁合金 [解析] 首先由图可知,消耗金属质量为30 g时,产生氢气的质量为1 g,即0.5 7 mol。用极值法:假设每一种金属都与酸反应产生0.5 mol H2,然后分别计算出消耗金属的质量。A项需32.5 g,B项需28 g,C项需要的质量范围是大于9 g,小于12 g,D项大于28 g。故选D。 [答案] D 8.在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后( ) A.天平保持平衡 B.左高右低 C.左低右高 D.无法确定 [解析] 由化学方程式2Al+2H2O+2NaOH===2NaAlO2+3H2↑及2Al+6HCl===2AlCl3+3H2↑可知,当酸和碱过量时,等量的铝反应能产生等量的氢气,所以天平依然保持平衡。 [答案] A [能力提升] 9.现代建筑的门窗框架,常用电解加工成古铜色的硬铝。取硬铝样品进行如下实验: (硅可与氢氧化钠溶液反应:Si+2NaOH+H2O===Na2SiO3+2H2↑)由此推知硬铝的组成是( ) A.Al、Mg、Si、Zn B.Al、Cu、Mg、Si C.Al、Fe、C、Cu D.Al、Si、Zn、Na [解析] 样品加入过量盐酸,比氢活泼的金属(如Al、Mg、Zn、Na)全部溶解。向不溶物中加入过量的NaOH溶液,有气体生成,说明样品中含有Si,再向不溶物中加入过量盐酸,仍有不溶物,说明含有Cu或C等。 [答案] B 10.用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,用排水集气法收集产生的气体,完全反应后,则收集到的气体为(标准状况下)( ) A.O2与H2的混合气体 B.1.12 L H2 7 C.大于1.12 L H2 D.小于1.12 L气体 [解析] 在题中隐藏着一个至关重要的条件“铝箔”,Na与水反应放出H2,并且生成NaOH,铝能与NaOH溶液反应,也生成H2,故最后收集到的气体是这两部分H2的总和,显然要比Na单独反应产生的H2多。 [答案] C 11.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图所示),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升,根据实验现象判断下列说法错误的是( ) A.实验中发生的反应都是氧化还原反应 B.铝是一种较活泼的金属 C.铝与氧气反应放出大量的热量 D.铝片上生成的白毛是氧化铝和氧化汞的化合物 [解析] 整个过程中发生两个反应,首先Al与Hg(NO3)2发生置换反应:2Al+3Hg2+===2Al3++3Hg,之后将铝置于空气中发生:4Al+3O2===2Al2O3。A中,两个反应中Al元素化合价均发生变化,属于氧化还原反应,故A正确;B中,铝的化学性质较活泼,不久铝箔表面生出“白毛”,可知Al易被氧化,可以说明铝是一种活泼金属,故B正确;C中,红墨水柱右端上升说明装置内气体膨胀,说明铝与氧气反应过程中放热,故C项正确;D中,汞的化学性质不活泼,以单质的形式存在,铝片上生成的白毛是Al2O3,故D项错误。 [答案] D 12.历史上金、银、铜主要是作为货币金属或装饰品被应用。 (1)金、银、铜常被作为钱币流通,从化学角度来看,主要是利用它们的________(填字母)。 A.硬度适中 B.密度适中 C.在自然界里都可得到纯净的单质 D.不活泼性 (2)试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样,按下图所示进行实验: 7 请写出步骤③中所发生的全部反应的离子方程式: ______________________。 若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为________________(用m表示)。 [解析] (1)金、银、铜都属于不活泼金属,易加工,因此,在历史上都曾经用作货币。(2)试样与过量盐酸反应所得溶液Y为FeCl2、CuCl2混合溶液,粉末Z为Fe、Cu混合物,将Y和Z混合,发生反应:Fe+Cu2+===Fe2++Cu,Fe+2H+===Fe2++H2↑,由生成的溶液呈强酸性且溶液中不含Cu2+,则不溶物W全部是金属铜,氧化铜的质量为0.5m×=m。 [答案] (1)D (2)Fe+Cu2+===Fe2++Cu,Fe+2H+===Fe2++H2↑ m 13.用铁、铝的混合物进行如下实验: (1)操作X的名称是________。 (2)气体A是______________。 (3)加入足量NaOH溶液时发生反应的离子方程式为 ____________________________;加入稀盐酸发生反应的离子方程式为________________________。 (4)溶液B中阴离子除OH-外还有________,溶液D中存在的金属离子为________。 [解析] (1)进行操作X后得到溶液和固体,故操作X为过滤。(2)Al与氢氧化钠溶液反应产生氢气,故气体A为H2。(3)混合物中加入足量NaOH溶液,Al与NaOH溶液反应;固体C为铁,加入稀盐酸,Fe与稀盐酸反应。(4)溶液B中阴离子有OH-、AlO,溶液D中金属离子为Fe2+。 [答案] (1)过滤 (2)H2(或氢气) (3)2Al+2OH-+2H2O===2AlO+3H2↑ 7 Fe+2H+===Fe2++H2↑ (4)AlO Fe2+ 14.铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白: 【探究一】 实验方案:铝镁合金测定剩余固体质量 实验中发生反应的化学方程式是____________。 实验步骤:(1)称取5.4 g铝镁合金粉末样品,投入体积为V的2.0 mol·L-1NaOH溶液中,充分反应。则取用NaOH溶液的体积V不小于________。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”或“偏低”)。 【探究二】 实验方案:铝镁合金测定生成气体的体积(实验装置如图所示) 问题讨论:(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是________(填“需要”或“不需要”)。 (2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点): ①__________________; ②__________________。 [解析] 【探究一】利用NaOH溶液与Al反应,余下的为Mg。合金质量为5.4g,Mg的含量为3%~5%,Al的最大质量为5.4 g×97%,Al与NaOH按1∶1反应,V(NaOH溶液)== 7 eq f(f(5.4 g×97%,27 g·mol-1),2.0 mol·L-1)=0.097 L,即97 mL。 若不洗涤固体,杂质附着在Mg上,使结果偏高。 【探究二】酸雾可溶于水,不需要加除杂装置。注意量气装置的使用:①要检查气密性;②读数时一定要保证B、C装置中液面相平。 [答案] 【探究一】2Al+2NaOH+2H2O===2NaAlO2+3H2↑ (1)97 mL (2)偏高 【探究二】(1)不需要 (2)①检查装置的气密性 ②使C中液面与B中液面相平(或加入足量盐酸或调整量气管C的高度,合理答案均可) 7查看更多