- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习14物质结构与性质作业(天津专用)
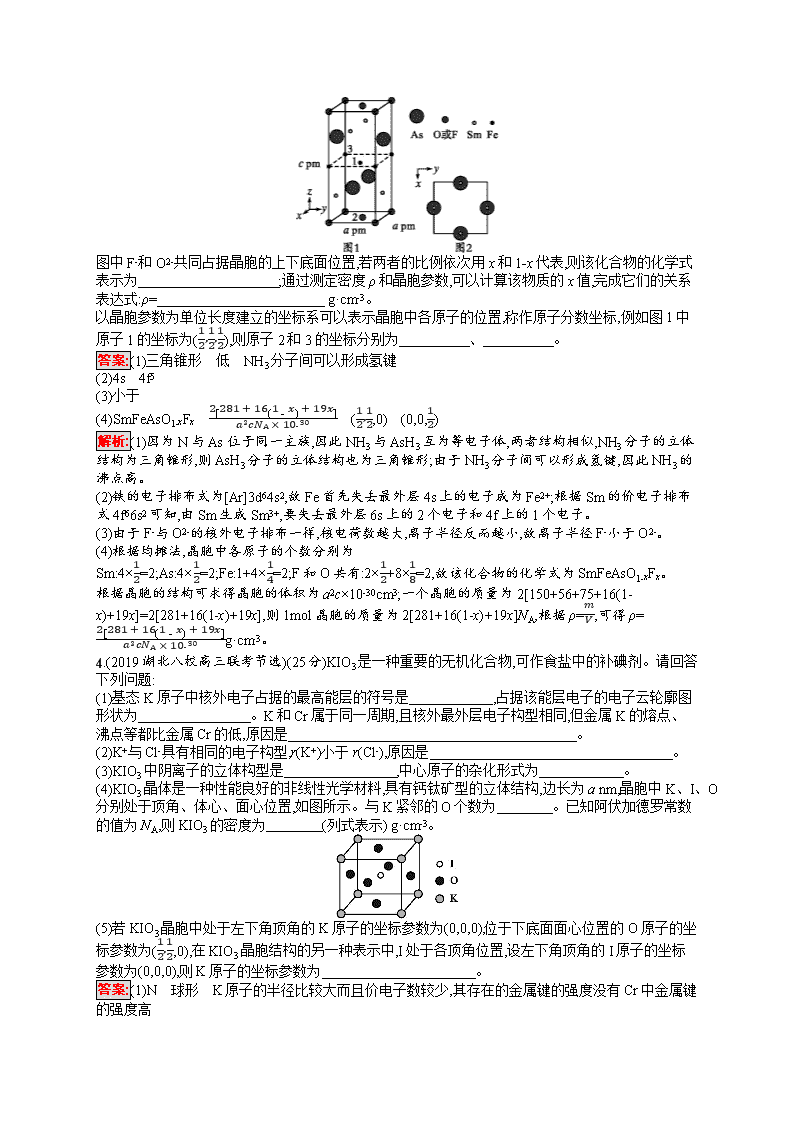
专题能力训练十四 物质结构与性质 (时间:45分钟 满分:100分) 专题能力训练第26页 非选择题(共4小题,共100分) 1.(2019济南外国语学校高三模拟)(25分)铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题: (1)Cu2O中阳离子的基态核外电子排布式为 ;Cu和Ni在元素周期表中的位置相邻,Ni在周期表中的位置是 。 (2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。 ①乙醇分子中C原子的轨道杂化类型为 ,NH3与H+以配位键形成NH4+,则NH4+的立体构型为 。 ②[Cu(NH3)4]SO4·H2O中存在的化学键除了极性共价键外,还有 。 ③NH3极易溶于水的原因主要有两个,一是 ,二是 。 (3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1个CN-中含有的π键数目为 。与CN-互为等电子体的离子有 (写出一种即可)。 (4)Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F间的最近距离为 pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。 答案:(1)1s22s22p63s23p63d10或[Ar]3d10 第四周期第Ⅷ族 (2)①sp3 正四面体形 ②离子键、配位键 ③氨分子和水分子之间能形成氢键 氨分子和水分子都是极性分子,相似相溶 (3)2 C22-(或其他合理答案) (4)34×34×83a·NA×1010 解析:(1)Cu2O中的阳离子为Cu+,其基态核外电子排布式为1s22s22p63s23p63d10;Ni在周期表中的位置是第四周期第Ⅷ族。 (2)①乙醇分子中C原子的轨道杂化类型为sp3,NH3与H+以配位键形成NH4+,则NH4+的立体构型为正四面体形。 ②[Cu(NH3)4]SO4·H2O中存在的化学键有极性共价键,铜与氨分子之间的配位键,铜与硫酸根离子之间的离子键。 ③因为氨分子和水分子之间能形成氢键,氨分子和水分子都是极性分子,根据相似相溶原理NH3极易溶于水。 (3)氮气与CN-互为等电子体,分子中含有三键,则1个CN-中含有的π键的数目为2。原子总数和价电子总数分别都相等的粒子互为等电子体,与CN-互为等电子体的离子有C22-。 (4)由图中晶胞的结构可知1个晶胞中:铜原子数为8×18+6×12=4,F原子数为4,所以晶胞的化学式CuF。 晶体密度为ag·cm-3,根据密度公式a=mV,设晶胞边长为xcm,则a=4×83NA·x3,x=34×83a·NA,则Cu与F间的最近距离为34×34×83a·NA×1010pm。 2.(2019湖南师范大学附属中学高三月考)(25分)A、B、C、D、E为原子序数依次增大的5种元素。A元素原子的价电子层中的未成对电子有3个;B元素原子的最外层电子数为其内层电子数的3倍;C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素原子最外层有1个未成对电子;E元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。请回答下列问题: (1)D元素基态原子的核外电子排布式为 ,E元素基态原子的价电子排布图为 。 (2)元素B有两种同素异形体,其中沸点高的是 (填化学式),原因是 。 (3)A、B、C中第一电离能最大的是 (填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。 (4)化合物D2B的立体构型为 ,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为 。 (5)E与C所形成化合物晶体的晶胞如图所示。 ①在1个晶胞中,E离子的数目为 。 ②该化合物的化学式为 。 答案:(1)1s22s22p63s23p5(或[Ne]3s23p5) (2)O3 O3相对分子质量较大,范德华力较大 (3)N sp3 (4)V形 2Cl2+2Na2CO3+H2OCl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3Cl2O+2NaCl+CO2) (5)①4 ②ZnS 解析:B元素原子的最外层电子数为其内层电子数的3倍,即B为O;五种元素原子序数依次增大,A元素原子的价电子层中的未成对电子有3个,A位于ⅤA族,即A为N;C的基态原子的3p轨道上有4个电子,即C为S,C和D属于同周期,且原子序数依次增大,D元素原子最外层有1个未成对电子,即D为Cl;E元素位于第四周期,内层轨道全部排满,最外层电子数为2,即E为Zn。 (1)Cl元素基态原子的核外电子排布式为1s22s22p63s23p5(或[Ne]3s23p5);Zn为副族元素,价电子包括最外层电子和次外层d能级上的电子,即价电子排布图为。 (2)O元素的两种同素异形体为O2和O3,依据相对分子质量进行沸点的比较,相对分子质量越大,范德华力越大,沸点越高,即沸点高的是O3。 (3)同主族从上到下元素的第一电离能逐渐减小,同周期从左向右主族元素第一电离能呈增大趋势,但第ⅡA族>第ⅢA族、第ⅤA族>第ⅥA族,因此第一电离能最大的元素是N,A的氢化物是NH3,N与H形成3个σ键,孤电子对数为(5-3×1)2=1,价层电子对数为4,N的杂化类型为sp3。 (4)D2B的分子式为Cl2O,可以看作O为中心原子,O与Cl形成2个σ键,孤电子对数为6-2×12=2,即Cl2O的立体构型为V形;根据题意,得出制备Cl2O的化学方程式为2Cl2+2Na2CO3+H2OCl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3Cl2O+2NaCl+CO2)。 (5)①利用均摊法,E离子位于顶点和面心,晶胞中含有E离子的个数为8×18+6×12=4。 ②C离子位于晶胞内部,个数为4,因此该化合物的化学式为ZnS。 3.(2019全国Ⅱ)(25分)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题: (1)元素As与N同族。预测As的氢化物分子的立体结构为 ,其沸点比NH3的沸点 (填“高”或“低”),其判断理由是 。 (2)Fe成为阳离子时首先失去 轨道电子,Sm的价电子排布式为4f66s2,Sm3+价电子排布式为 。 (3)比较离子半径:F- (填“大于”“等于”或“小于”)O2-。 (4)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。 图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为 ;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们的关系表达式:ρ= g·cm-3。 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(12,12,12),则原子2和3的坐标分别为 、 。 答案:(1)三角锥形 低 NH3分子间可以形成氢键 (2)4s 4f5 (3)小于 (4)SmFeAsO1-xFx 2[281+16(1-x)+19x]a2cNA×10-30 (12,12,0) (0,0,12) 解析:(1)因为N与As位于同一主族,因此NH3与AsH3互为等电子体,两者结构相似,NH3分子的立体结构为三角锥形,则AsH3分子的立体结构也为三角锥形;由于NH3分子间可以形成氢键,因此NH3的沸点高。 (2)铁的电子排布式为[Ar]3d64s2,故Fe首先失去最外层4s上的电子成为Fe2+;根据Sm的价电子排布式4f66s2可知,由Sm生成Sm3+,要失去最外层6s上的2个电子和4f上的1个电子。 (3)由于F-与O2-的核外电子排布一样,核电荷数越大,离子半径反而越小,故离子半径F-小于O2-。 (4)根据均摊法,晶胞中各原子的个数分别为 Sm:4×12=2;As:4×12=2;Fe:1+4×14=2;F和O共有:2×12+8×18=2,故该化合物的化学式为SmFeAsO1-xFx。 根据晶胞的结构可求得晶胞的体积为a2c×10-30cm3;一个晶胞的质量为2[150+56+75+16(1-x)+19x]=2[281+16(1-x)+19x],则1mol晶胞的质量为2[281+16(1-x)+19x]NA,根据ρ=mV,可得ρ=2[281+16(1-x)+19x]a2cNA×10-30g·cm-3。 4.(2019湖北八校高三联考节选)(25分)KIO3是一种重要的无机化合物,可作食盐中的补碘剂。请回答下列问题: (1)基态K原子中核外电子占据的最高能层的符号是 ,占据该能层电子的电子云轮廓图形状为 。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr的低,原因是 。 (2)K+与Cl-具有相同的电子构型,r(K+)小于r(Cl-),原因是 。 (3)KIO3中阴离子的立体构型是 ,中心原子的杂化形式为 。 (4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。与K紧邻的O个数为 。已知阿伏加德罗常数的值为NA,则KIO3的密度为 (列式表示) g·cm-3。 (5)若KIO3晶胞中处于左下角顶角的K原子的坐标参数为(0,0,0),位于下底面面心位置的O原子的坐标参数为(12,12,0),在KIO3晶胞结构的另一种表示中,I处于各顶角位置,设左下角顶角的I原子的坐标参数为(0,0,0),则K原子的坐标参数为 。 答案:(1)N 球形 K原子的半径比较大而且价电子数较少,其存在的金属键的强度没有Cr中金属键的强度高 (2)K+的核电荷数较大,原子核对最外层电子的吸引力较大 (3)三角锥形 sp3 (4)12 2.14×1023a3NA (5)(12,12,12) 解析:(1)基态K原子的核外电子排布为1s22s22p63s23p64s1,所以核外电子占据的最高能层为N,K原子最外层4s轨道电子云轮廓为球形,由于K原子的半径比较大而且价电子数较少,其存在的金属键的强度没有Cr中金属键的强度高,所以其熔、沸点较低。 (2)具有相同的电子构型的离子,由于K+的核电荷数较大,原子核对最外层电子的吸引力较大,因此r(K+)小于r(Cl-)。 (3)IO3-中心原子I的孤电子对数为12×(7+1-3×2)=1,价层电子对数为1+3=4,所以IO3-的立体构型为三角锥形,中心原子I原子的杂化形式为sp3。 (4)K在晶胞的顶角位置,为8个晶胞共有,在每个晶胞中与K相邻的O有3个,O在晶胞的面心位置,为2个晶胞共有,所以与K紧邻的O共有3×82=12个,1个KIO3晶胞的质量为39×1+127×1+16×3NAg=214NAg,该晶胞的边长为anm,则该晶胞的密度=214NAg÷(a×10-7cm)3=2.14×1023a3NAg·cm-3。 (5)K原子的坐标参数为(0,0,0),位于下底面面心位置的O原子的坐标参数为(12,12,0),若I处于各顶角位置,则K原子处于体心,设左下角顶角的I原子的坐标参数为(0,0,0),则K原子的坐标参数为(12,12,12)。查看更多