湖北省鄂州市部分高中联考协作体2019-2020学年高二上学期期中考试化学试题
高二化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 P-31 S-32 Cl-35.5 Fe-56
Cu-64
一、选择题(本题共 16 小题,每小题 3 分,共 48 分。在每小题给出的四个选项中,只有一
项符合要求)
1.下列加横线的字所指代物质的主要成分与其他三项不同的是( )
A. 儿童散学归来早,忙趁东风放纸鸢 B. 黑发不知勤学早,白首方悔读书迟
C. 散入珠帘湿罗幕,狐裘不暖锦衾薄 D. 绚丽丝绸云涌动,霓裳歌舞美仙姿
【答案】A
【解析】
【详解】纸鸢的主要成分是人造纤维;头发的主要成分是蛋白质;狐裘的主要成分是蛋白质;
丝绸的主要成分是蛋白质;故以上物质的主要成分与其他三项不同的是纸鸢,答案为 A。
2.设 NA 为阿伏伽德罗常数的值,下列说法正确的是( )
A. 密闭容器中 2molSO2 和 1molO2 催化反应后分子数为 2NA
B. 标准状况下,5.6LCO2 气体中含有的氧原子数目为 0.5NA
C. 1mol 重水与 1mol 水中中子数比为 2:1
D. 标准状况下,2.24LN2 和 O2 的混合气体中分子数为 0.2NA
【答案】B
【解析】
【详解】A、SO2 与 O2 的反应为 2SO2+O2 2SO3,因该反应为可逆反应,故反应结束分子物质
的量介于 2mol 至 3mol 之间,故 A 错误;
B、标准状况下,5.6LCO2 气体的物质的量为 5.6L
22.4L/mol
=0.25mol,含有的氧原子数目为 0.25
NA×2=0.5NA,故 B 正确;
C、1 个重水分子中中子数为 10 个,1 个水分子中中子数为 8 个,故相同物质的量的重水与水
分子中中子数目比例为 5:4,故 C 错误;
D、标准状况下,N2 和 O2 不会发生化学反应,2.24L 气体的物质的量为 2.24L
22.4L/mol
=0.1mol,
故混合气体中分子总数为 0.1NA,故 D 错误。
【点睛】气体摩尔体积不单单适用于单一气体,同时还适用于混合气体;在适用气体摩尔体
积时,需注意该物质所处的环境以及在该环境下是否为气体。
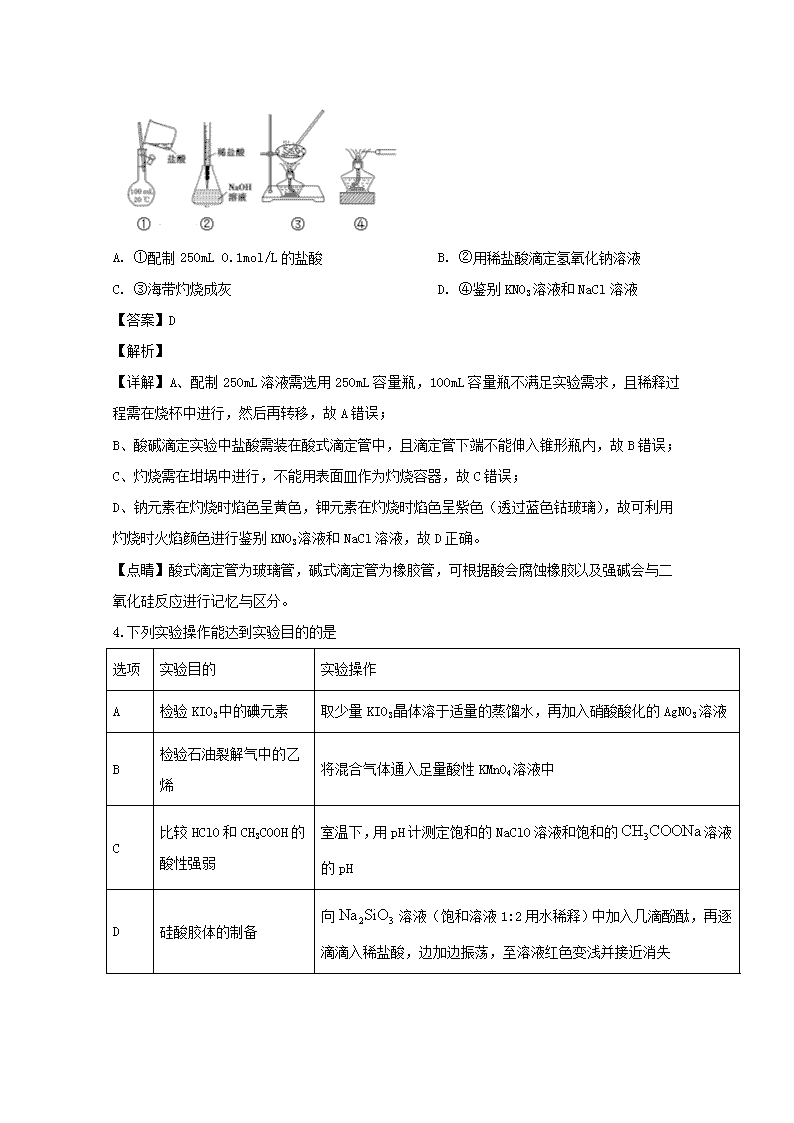
3.用下列装置进行实验,能达到实验目的的是( )
A. ①配制 250mL 0.1mol/L 的盐酸 B. ②用稀盐酸滴定氢氧化钠溶液
C. ③海带灼烧成灰 D. ④鉴别 KNO3 溶液和 NaCl 溶液
【答案】D
【解析】
【详解】A、配制 250mL 溶液需选用 250mL 容量瓶,100mL 容量瓶不满足实验需求,且稀释过
程需在烧杯中进行,然后再转移,故 A 错误;
B、酸碱滴定实验中盐酸需装在酸式滴定管中,且滴定管下端不能伸入锥形瓶内,故 B 错误;
C、灼烧需在坩埚中进行,不能用表面皿作为灼烧容器,故 C 错误;
D、钠元素在灼烧时焰色呈黄色,钾元素在灼烧时焰色呈紫色(透过蓝色钴玻璃),故可利用
灼烧时火焰颜色进行鉴别 KNO3 溶液和 NaCl 溶液,故 D 正确。
【点睛】酸式滴定管为玻璃管,碱式滴定管为橡胶管,可根据酸会腐蚀橡胶以及强碱会与二
氧化硅反应进行记忆与区分。
4.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 检验 KIO3 中的碘元素 取少量 KIO3 晶体溶于适量的蒸馏水,再加入硝酸酸化的 AgNO3 溶液
B
检验石油裂解气中的乙
烯
将混合气体通入足量酸性 KMnO4 溶液中
C
比较 HClO 和 CH3COOH 的
酸性强弱
室温下,用 pH 计测定饱和的 NaClO 溶液和饱和的 3CH COONa 溶液
的 pH
D 硅酸胶体的制备
向 2 3Na SiO 溶液(饱和溶液 1:2 用水稀释)中加入几滴酚酞,再逐
滴滴入稀盐酸,边加边振荡,至溶液红色变浅并接近消失
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A. 氯酸钾与硝酸银不反应,则不能检验 KClO3 中的氯元素,应先加热使氯酸钾分解,
再检验氯元素,故 A 不能达到实验目的;
B. 石油裂解气是一种复杂的混合气体,它除了主要含有乙烯、丙烯、丁二烯等不饱和烃外,
还含有甲烷、乙烷、氢气、硫化氢等,丙烯、丁二烯、硫化氢气体都可使酸性高锰酸钾溶液,
故 B 不能达到实验目的;
C. 用 pH 值测定,要保证两个溶液浓度相同,不同溶质的溶解度不同,其饱和溶液的浓度也
不同,不能进行酸性比较,故 C 不能达到实验目的 ;
D. 用硅酸钠溶液和盐酸可制备硅酸胶体,为防止在电解质作用下胶体沉聚,用酚酞做指示剂,
来防止盐酸过量,故 D 能达到实验目的;
答案选 D。
5.有一化学平衡 mA(g)+nB(g) pC(g)+qD(g),如图表示的是 A 的转化率与压强、温度的
关系。下列叙述正确的是( )
A. 正反应是吸热反应;m+n
p+q
C. 正反应是放热反应;m+np+q
【答案】D
【解析】
【分析】
采取“定一议二”原则分析,根据等压线,由温度对 A 的转化率影响,判断升高温度平衡移
动方向,确定反应吸热与放热;
作垂直横轴的线,温度相同,比较压强对 A 的转化率的影响,判断增大压强平衡移动方向,
确定 m+n 与 p+q 的大小关系;
【详解】由图可知,压强相同时,温度越高 A 的转化率越大,说明升高温度平衡向正反应移
动,故正反应为吸热反应,
作垂直横轴的线,由图可知,温度相同,压强越大 A 的转化率越大,增大压强平衡向正反应
移动,故正反应为气体物质的量减小的反应,即 m+n>p+q,
综上所述,D 项符合题意,故选 D。
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在漂白液中:Ag+、K+、NO3
-、SO3
2-
B. K+、Na+、Br-、AlO2
-在溶液中能大量共存,通入过量的 CO2 后仍能大量共存
C.
+
-
c(H )
c(OH )
=1012 的溶液中,NH4
+、Ca2+、Cl-、NO3
-
D. 由水电离的 c(H+)=1×10-10mol/L 的溶液中:K+、Na+、HCO3
-、AlO2
-
【答案】C
【解析】
【详解】A、漂白液中含有 H+、Cl-、ClO-等,Cl-与 Ag+会生成难溶物 AgCl,H+和 ClO- 均会与
SO3
2-反应,故 A 不符合题意;
B、K+、Na+、Br-、AlO2
-在溶液中不发生化学反应,能大量共存,通入 CO2 后会发生化学反应:
2AlO2
-+CO2+3H2O=2Al(OH)3↓+CO3
2-(少量 CO2)、CO3
2-+CO2+H2O=2HCO3
-(过量 CO2),通入
CO2 后不能大量共存,故 B 不符合题意;
C、根据
+
-
c(H )
c(OH )
=1012 可知,该溶液呈酸性,这几种离子之间不反应且和氢离子也不反应,所
以能大量共存,故 C 符合题意;
D、常温下,由水电离的 c(H+)=1×10-10mol/L 的溶液可能呈酸性,也可能呈碱性,HCO3
-与 H+、
OH-均会发生反应、AlO2
-不能与 H+大量共存,故 D 不符合题意。
【点睛】注意明确离子不能大量共存的一般情况:(1)能发生复分解反应的离子之间不能大
量共存;(2)能发生氧化还原反应的离子之间大量共存;(3)能发生络合反应的离子之间大
量共存(如 Fe3+和 SCN-等);(4)还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来
判断溶液中是否有大量的 H+或 OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉
产生氢气”;是“可能”共存,还是“一定”共存等。需注意:含有大量 NO3
-的溶液中,加入
铝粉,产生氢气,溶液不能为酸性,因为硝酸与铝反应不会产生氢气。
7.2019 年 10 月 9 日,瑞典皇家科学院在斯德哥尔摩宣布 2019 年度诺贝尔化学奖授予在锂离
子电池的发展方面做出贡献的科学家。锂电池作为最主要的便携式能量源,影响着我们生活
的方方面面。锂空气电池放电的工作原理如图所示。下列叙述正确的是( )
A. 电池放电时负极电极方程式为 O2+2H2O+4e-=4OH-
B. 放电时电子由 B 极向 A 极移动
C. 电解液 a,b 之间可采用阴离子交换膜
D. 电解液 b 可能为稀 LiOH 溶液
【答案】D
【解析】
【分析】
锂空气电池属于原电池,锂电极作为原电池的负极发生氧化反应,通入空气的一极作为原电
池正极,根据其工作原理图可知,锂失去电子后生成锂离子并迁移至电解液 b,以 LiOH 的形
式进行回收,故电池的空气电极生成为 OH-并结合负极迁移过来的锂离子,以此进行解答本题。
【详解】A、由上述分析可知,电池放电时负极的电极反应式为:Li-e-=Li+,故 A 错误;
B、放电时电极 A 为负极,电极 B 为正极,电子由 A 极向 B 极移动,故 B 错误;
C、由上述分析可知,离子交换膜应采用阳离子交换膜,故 C 错误;
D、由上述分析可知,电解液 b 可以为稀 LiOH 溶液,故 D 正确。
8.能正确表达下列反应的离子方程式的为( )
A. 向 FeI2 溶液中通入少量的氯气:Cl2+2Fe2+=2Fe3++2Cl-
B. 光导纤维遇碱性土壤“短路”:SiO2+2OH-=SiO3
2-+H2O
C. 电解 MgCl2 溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
D. 向明矾溶液中加入 Ba(OH)2 使 Al3+刚好沉淀完全:Al3++3OH-=Al(OH)3↓
【答案】B
【解析】
【详解】A、I-的还原性强于 Fe2+,根据氧化还原反应的强弱规律,氯气先与 I-反应,故 A 错
误;
B、光导纤维中主要成分为二氧化硅,碱性土壤中含有大量碱性物质,其反应为:
SiO2+2OH-=SiO3
2-+H2O,故 B 正确;
C、电解 MgCl2 溶液的离子方程式为:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑,故 C 错误;
D、以 KAl(SO4)2 为 1mol,当 Al3+刚好沉淀完全,加入 Ba(OH)2 的物质的量为 1.5mol,其反应的
离子方程式为:2Al3++6OH-+3SO4
2-+3Ba2+=3BaSO4↓+2Al(OH)3↓,故 D 错误。
【点睛】配比型离子反应方程式:当一种反应物中有两种或两种以上组成离子参与反应时,
因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成
离子不能恰好完全反应(有剩余或不足)而跟用量有关。书写方法为“少定多变”法
(1)“少定”就是把相对量较少的物质定为“1 mol”,若少量物质有两种或两种以上离子
参加反应,则参加反应的离子的物质的量之比与原物质组成比相符;
(2)“多变”就是过量的反应物,其离子的化学计量数根据反应实际需求量来确定,不受化
学式中的比例制约,是可变的。
9.a,b,c,d 为核电荷数依次增大的短周期主族元素。a 的简单气态氢化物可使湿润的红色
石蕊试纸变蓝,a 与 b 同周期,b 的单质能与水反应置换水中的氧,b 与 d 同主族,c 原子的
半径在短周期主族元素中最大。下列说法正确的是( )
A. a 的氧化物的水化物是强酸
B. 简单离子的半径:ab>c,d 对应简单离子的电子层数较 a、b、c 多一层,其半径最大,故简单离子的半径:
d> a>b>c,故 B 错误;
C、F 和 Cl 同主族,对应单质的氧化性 F2>Cl2,故 C 正确;
D、c 为 Na,在空气中燃烧产物为 Na2O2,阳离子与阴离子个数比为 2:1,故 D 错误。
10.室温下向 10ml0.2mol/L 的 H2A 溶液中加入 0.2mol/LNaOH 溶液,溶液 pH 的变化曲线如图所
示。下列说法正确的是( )
A. b 点溶液中离子浓度的大小:c(H2A)>c(A2-)
B. 加水稀释 c 点溶液,水电离出的 c(H+)·c(OH-)不变
C. a 点的溶液可以用钢瓶贮存
D. c 点溶液中存在:c(Na+)>2c(A2-)+c(HA-)
【答案】D
【解析】
【分析】
由题干可知,a 点对应的溶质为 NaHA,其溶液呈酸性,由此可知 HA-的电离程度大于其水解程
度,c 点对应溶质为 Na2A,由此进行解答本题。
【详解】A、根据电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),b 点溶液呈中性,
c(H+)=c(OH-),故 c(Na+) =2c(A2-)+c(HA-),a 点溶质为 NaHA,存在物料守恒:c(Na+) =c(A2
-)+c(HA-)+c(H2A),由 a→b 的过程中,加入了 Na+,故 b 点 c(Na+) >c(A2-)+c(HA-)+c(H2A),
即 2c(A2-)+c(HA-) >c(A2-)+c(HA-)+c(H2A),由此可知 c(A2-)> c(H2A),故 A 错误;
B、c 点的溶质为 Na2A,加水稀释过程中,A2-离子水解程度增大,促进水的电离,水电离出的
c(H+)·c(OH-)增大,故 B 错误;
C、a 点溶液呈酸性,不能用钢瓶贮存,故 C 错误;
D、c 点溶液中存在电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),其溶液呈碱性,故
c(H+)2c(A2-)+c(HA-),故 D 正确。
11.已知 1g 氢气完全燃烧生成液态水时放出热量 143kJ,18g 水蒸气变成液态水放出 44kJ 的
热量。其他相关数据如下表:
化学键 O=O H—H H—O(g)
1 mol 化学键断裂时
需要吸收的能量/kJ
496 x 463
则表中 x 为( )
A. 920 B. 557 C. 436 D. 188
【答案】C
【解析】
【详解】1g 氢气完全燃烧生成液态水时放出热量 143kJ,故 2mol 氢气燃烧生成 2mol 液态水
时放出热量为 2mol 2g
g
/mol
1
×143kJ=572kJ,18g 水蒸气变成液态水放出 44kJ 的热量,2mol
液态水变为气态水吸收的热量为 2mol 18g
g
/mol
18
×44kJ=88kJ,故 2mol 氢气燃烧生成 2mol
气 态 水 时 放 出 热 量 为 572kJ−88kJ=484kJ , 故 热 化 学 方 程 式 为 2H2(g)+O2(g)=2H2O(g)
H=−484kJ/mol,所以 2xkJ/mol+496kJ/mol−4×463kJ/mol=−484kJ/mol,解得 x=436,故选
C。
12.对于 H2(g)+I2(g) 2HI(g),ΔH<0,根据如图,下列说法错误的是( )
A. t2 时可能使用了催化剂 B. t3 时可能采取减小反应体系压强的措
施
C. t5 时采取升温的措施 D. 反应在 t6 时刻,HI 体积分数最大
【答案】D
【解析】
【分析】
该可逆反应为气体等体积反应,该变压强或加入催化剂能够该变其化学反应速率,但平衡不
会移动;该反应正向为放热反应,升高温度化学反应速率增加,平衡逆向移动,降温化学反
应速率降低,平衡正向移动,然后结合图像进行分析。
【详解】A、t2 时化学反应速率加快,平衡未发生移动,可能是加入了催化剂,故 A 不符合题
意;
B、t3 时化学反应速率降低,由上述分析可知,其采取的措施可能是减小反应体系压强,故 B
不符合题意;
C、t5 时正逆化学反应速率均加快,且逆反应速率大于正反应速率,即平衡逆向移动,由此可
知,t5 时采取升温的措施,故 C 不符合题意;
D、由 t1~t6 整个过程来看,平衡逆向移动,因此 t6 时刻对应 HI 体积分数最小,故 D 符合题
意。
13.已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
下列结论正确的是( )
A. 碳的燃烧热为ΔH=-221kJ/mol
B. 1molC(s)和 0.5molO2(g)所具有的能量高于 1molCO(g)所具有的能量
C. 稀硫酸与稀 NaOH 溶液反应放出的热量为 57.3kJ/mol
D. 稀醋酸与稀 NaOH 溶液反应生成 1mol 水,放出的热量大于 57.3kJ
【答案】B
【解析】
【详解】A、碳的燃烧热是指 1mol 碳完全燃烧生成的稳定的氧化物 CO2 放出的热量,从
2C(s)+O2(g)=2CO(g) ΔH=-221kJ/mol 可知 1mol 碳不完全燃烧生成 CO 放出 110.5kJ,由
题干数据无法计算碳的燃烧热,故 A 错误;
B、由反应①可知:C(s)+ 1
2
O2(g)=CO(g) ΔH=-110.5kJ/mol,该反应放热,即 1molC(s)
和 0.5molO2(g)所具有的能量高于 1molCO(g)所具有的能量,故 B 正确;
C、未告知酸与碱的量,无法确定其酸碱中和放出的热量,故 C 错误;
D、醋酸为弱酸,其电离过程需要吸收能量,因此稀醋酸与稀 NaOH 溶液反应生成 1mol 水,放
出的热量小于 57.3kJ,故 D 错误。
14.工业生产硫酸接触室发生如下化学反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol
-1。一定温度下,向甲、乙、丙三个容积均为 2L 的恒容密闭容器中投入 SO2(g)和 O2(g),其起
始物质的量及 SO2 的平衡转化率如表所示,下列判断中,正确的是( )
甲 乙 丙
起始物质的量
n(SO2)/mol 0.6 1.2 1.2
n(O2)/mol 0.36 0.36 0.72
SO2 的平衡转化率 80% α1 α2
A. 甲→乙,平衡向正反应方向移动,α(O2)增大,放出的热量为 47.18kJ
B. 平衡时,丙中 c(SO2)是甲中的 2 倍
C. 平衡时,SO2 的转化率:α2>80%>α1
D. 该温度下,平衡常数 K=400
【答案】C
【解析】
【详解】A、乙相对于甲,SO2 浓度增加,平衡正向移动,O2 转化率增加,
甲容器中: 2SO2(g)+O2(g) 2SO3(g)
起始(mol) 0.6 0.36 0
转化(mol) 0.48 0.24 0.48
平衡(mol) 0.12 0.12 0.48
其放出的热量= 0.48 196.62
=47.18kJ,由甲→乙,因氧气浓度降低了,增加的 0.6molSO2 转
化将会降低,其放出的热量一定小于 47.18kJ,故 A 错误;
B、丙相对于甲,反应物浓度增加一倍,相当于增大一倍压强,平衡正向移动,平衡时丙中 c(SO2)
小于甲中 2c(SO2),故 B 错误;
C、由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化
率减小,乙、丙可知二氧化硫浓度相同,氧气浓度增大,二氧化硫转化率增大,则平衡时,
SO2 的转化率:α1<80%<α2,故 C 正确;
D、甲容器中:2SO2(g)+O2(g) 2SO3(g)
起始(mol/L) 0.3 0.18 0
转化(mol/L) 0.24 0.12 0.24
平衡(mol/L) 0.06 0.06 0.24
K=
2
2
0.24
0.06 0.06
= 800
3
,故 D 错误。
【点睛】对于等效平衡或平衡移动,可通过构建“虚拟状态”进行分析,也可以根据该变条
件的瞬间分析相关数据的变化,然后根据平衡移动原理进行分析。
15.下列性质中,可以证明 CH3COOH 是弱电解质的是( )
A. 醋酸的导电能力比盐酸的弱
B. 0.1mol/L的醋酸溶液中,c(H+)=0.1mol/L
C. 10ml0.1mol/L 的醋酸溶液恰好与 10ml0.1mol/L 的 NaOH 溶液完全反应
D. 醋酸钠的水溶液显碱性
【答案】D
【解析】
【详解】A、由于未告知醋酸和盐酸是否为同浓度,不能根据其溶液导电能力判断其电离程度,
故 A 错误;
B、若 0.1mol/L 的醋酸溶液中,c(H+)=0.1mol/L,则醋酸为强电解质,故 B 错误;
C、10ml0.1mol/L 的醋酸溶液恰好与 10ml0.1mol/L 的 NaOH 溶液完全反应只能说明醋酸为一元
酸,不能证明醋酸为弱电解质,故 C 错误;
D、醋酸钠溶液呈碱性的原因是因为醋酸根离子的水解,根据“有弱才水解”可知,醋酸为弱
电解质,故 D 正确。
16.常温下,下列有关叙述正确的是( )
A. Na2CO3 溶液中:c(Na+)=2[c(CO3
2-)+c(HCO3
-)]
B. pH 相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4 溶液中,c(NH4
+)大小顺序①>②>③
C. NaY 溶液的 pH=8,c(Na+)-c(Y-)=9.9×10-7mol/L
D. 向 0.1mol/L 的氨水中加入少量的硫酸铵固体,溶液中
-
3 2
c(OH )
c(NH H O) 增大
【答案】C
【解析】
【详解】A、Na2CO3 溶液中的物料守恒为:c(Na+)=2[c(CO3
2-)+c(HCO3
-)+c(H2CO3)],故 A 错误;
B、pH 相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4 三种溶液中,NH4HSO4 电离出 H+,NH4
+浓度最小,
NH4NO3 和(NH4)2SO4 水解程度相同,正确顺序为①=②>③,故 B 错误;
C、NaY 溶液的 pH=8 可知,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,NaY 溶液中电荷守恒:c(Na+)
+c(H+)=c(Y-)+c(OH-),即 c(Na+)- c(Y-)= c(OH-)- c(H+)=
10-6mol/L-10-8mol/L=9.9×10-7mol/L,故 C 正确;
D、氨水中加入少量的硫酸铵固体,c(NH4
+)增大,且温度不变,则 Kb 不变,故
-
3 2
c(OH )
c(NH H O) =
b
+
4
K
c NH 减小,故 D 错误。
二、非选择题(本大题共 4 小题,共 52 分)
17.在一定条件下发生反应:4NO2(g)+O2(g) 2N2O5(g) ΔH<0,T1 时,向体积为 2L 的恒容密
闭容器中通入 NO2 和 O2,部分实验数据如表所示。
时间/s 0 5 10 15
c(NO2)/(mol·L-1) 4.00 2.52 2.00 c3
c(O2)/(mol·L-1) 1.00 c1 c2 0.50
(1)0~10s 内 N2O5 的平均反应速率为__ ,此温度下的平衡常数为___。
(2)其他条件不变,将容器体积压缩一半,则重新达到平衡时 c(N2O5)___2.00mol·L-1(填
“>、<或=”,下同)
(3)假设温度 T1 时平衡常数为 K1,温度 T2 时平衡常数为 K2,若 K1 (4). > (5). AC (6).
增加 O2 浓度、降低温度、增大压强、及时分离 N2O5 (7). ﹣746.5kJ/mol (8). 低温
【解析】
【详解】(1) 4NO2(g)+O2(g) 2N2O5(g)
起始(mol/L) 4 1 0
10s 内转化(mol/L) 2 0.5 1
10s 末(mol/L) 2 0.5 1
故用 N2O5 表示平均化学反应速率 Δcν= Δt
=1mol/L
10s
=0.1mol·L-1·s-1;由 10s~15s 内氧气浓度
不变可知,该反应在 10s 末已经处于平衡状态,故该反应平衡常数 K=
2
4
1
2 0.5
=0.125;
(2)将容器体积压缩一半,压缩瞬间,c(N2O5)=2mol/L,压强增大,化学平衡正向移动,重
新达到平衡时,c(N2O5)> 2mol/L;
(3)该反应正向为放热反应,升高温度,平衡逆向移动,平衡常数减小,由此可知,T1>T2;
(4)A、容器内有颜色的气体为 NO2,若容器内混合气体的颜色不再改变,则说明 NO2 浓度不
变,可证明该反应处于平衡状态,故 A 正确;
B、该反应在任意时刻均存在每消耗 2molN2O5 会生成 1molO2,故不能说明该反应处于平衡状态,
故 B 错误;
C、混合气体的总质量不变,因反应前后气体的物质的量不相等,在反应未达到平衡时,气体
的物质的量会发生变化,由 mM = n
—
可知,当混合气体的平均摩尔质量不再变化时,即反应达
到平衡,故 C 正确;
D、混合气体的总质量不变,容器体积恒定,其密度不会发生改变,故不能判断该反应是否处
于平衡状态,故 D 错误;
(5)NO2 作为反应物,若要提高其转化率,可通过增加 O2 浓度、降低温度、增大压强、及时
分离 N2O5 使反应正向移动达到目的;
(6)令①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol−1
②2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol−1
③C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol−1
将反应③×2-①-②可得 2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ/mol;该反应为熵减反
应( Δ S<0), Δ H<0,当 Δ G= Δ H-TΔ S<0 时,该条件有利于反应的自发,由此可知,利于该
反应自发进行的条件是低温。
【点睛】本题的(2)问需注意,当体积压缩一半时,各物质浓度在那一瞬间都会增加一倍,
然后再考虑压强对平衡的影响。
18.I、烟道气中的 NOx 是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答
下列问题:
将 vL 气样通入适量酸化的 H2O2 溶液中,使 NOx 完全被氧化成 NO3
-,加水稀释至 100.00mL。量
取 20.00mL 该溶液,加入 v1mLc1mol·L-1 FeSO4 标准溶液(过量),充分反应后,用 c2mol·L-1
K2Cr2O7 标准溶液滴定剩余的 Fe2+,终点时消耗 v2mL。
(1)NO 被 H2O2 氧化为 NO3
-的离子方程式为___。
(2)加水稀释到 100.00ml 所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;
滴定操作使用的玻璃仪器主要有____。
(3)滴定过程中发生下列反应:
3Fe2++NO3
-+4H+=NO↑+3Fe3++2H2O
Cr2O7
2-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中 NOx 折合成 NO2 的含量为___mg/L。
(4)下列操作会使滴定结果偏高的是____
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4 标准溶液部分变质
II、常温下,用酚酞作指示剂,用 0.10mol·L-1 NaOH 溶液分别滴定 20.00mL 浓度均为
0.10mol·L-1 的 CH3COOH 溶液和 HCN 溶液所得滴定曲线如图。
(已知:CH3COOH、 HCN 的电离平衡常数分别为 1.75×10-5、6.4×10-10)
(1)图___(a 或 b)是 NaOH 溶液滴定 HCN 溶液的 pH 变化的曲线,判断的理由是___。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:____。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:____。
【答案】 (1). 2NO+3H2O2=2H++2NO3
-+2H2O (2). 100mL 容量瓶 (3). 锥形瓶、酸
式滴定管 (4). 1 1 2 2230 (c v -6c v )
3v
(5). CD (6). a (7). 由 CH3COOH、 HCN
的电离平衡常数可知,HCN 的酸性弱于 CH3COOH,浓度相同的两种酸,HCN 的 pH 高于 CH3COOH
的 pH 值 (8). c(Na+)=c(CH3COO-)>c(H+)=c(OH-) (9). = (10). ④③②
【解析】
【分析】
I、(1)NO 与过氧化氢在酸性溶液中发生氧化还原反应生成硝酸和水;
(2)100.00mL 溶液的稀释配制实验中主要仪器为量筒、烧杯、玻璃杯、100mL 容量瓶、胶头
滴管;本滴定实验操作主要用到铁架台、酸式滴定管、锥形瓶等;
(3)根据滴定剩余 Fe2+时,消耗的 K2Cr2O7 的物质的量计算剩余 Fe2+,然后根据总 Fe2+与剩余
Fe2+计算与 NO3−反应的 Fe2+物质的量,然后计算 100mL 溶液中总 NO3−的量,最终根据氮守恒计
算出 NO2 含量;
(4)根据滴定过程中操作对 K2Cr2O7 的量的影响进行分析;
II、(1)根据同浓度酸对应的电离程度[即电离平衡常数]进行分析;
(2)根据电荷守恒以及溶液呈中性进行分析;
(3)根据起始两种酸的物质的量以及物料守恒分析;
(4)根据酸碱中和过程中溶质的变化对水的电离的影响进行分析。
【详解】(1)NO 与过氧化氢在酸性溶液中发生氧化还原反应,反应的离子方程式为:2NO+
3H2O2=2H++2NO3
-+2H2O,
(2)100.00mL 溶液的稀释配制实验中主要仪器为量筒、烧杯、玻璃杯、100mL 容量瓶、胶头
滴管;本滴定实验操作主要用到铁架台、酸式滴定管、锥形瓶、其中玻璃仪器为酸式滴定管、
锥形瓶;
(3)根据题干方程式可列出关系式(以下关系式计算均按照 25mL NO3−溶液计算):
故 100mLNO3−溶液中 NO3
-总量为:
-3 -3
1 1 2 2c v 10 -6 c v
3
10 ×5mol
= -3 -3
1 1 2 2c v 10 -6 c v 15 0
3
mol,根据氮元素守恒,二氧化氮的总质量
-3 -3
1 1 2 2c v 10 -6 c v 15 0
3
mol×46g/mol= -3 -3
1 1 2 2c v 10 -23
3
6 c v 00 1 g=
1 1 2 2c v -6 c230
3
v mg,故 vL 气样中 NOx 折合成 NO2 的含量为
1 1 2 2c v -230
3
c
v
6 v
mg/L= 1 1 2 2c v -230 c× 6 v
3v
mg/L;
(4)A、滴定管未洗涤,K2Cr2O7 读数将会增大,所计算剩余 Fe2+偏大,导致计算 Fe2+与 NO3−溶
液反应的 Fe2+偏小,从而计算出 NO3−数值偏小,导致结果偏低,故 A 错误;
B、锥形瓶内有水不影响滴定实验,对结果无影响,故 B 错误;
C、滴定管滴定前读数正确,滴定后俯视读数,导致 K2Cr2O7 读数将会增小,与 A 同理分析可知
结果偏大,故 C 正确;
D、FeSO4 标准溶液部分变质,将会导致消耗的 K2Cr2O7 偏小,同理可知结果偏大,故 D 正确;
II、由二者的电离平衡常数可知,酸性:CH3COOH >HCN;
(1)浓度相同的两种酸,HCN 的 pH 高于 CH3COOH 的 pH 值,故 a 为 NaOH 溶液滴定 HCN 溶液的
pH 变化的曲线;
(2)点③存在电荷平衡:c(Na+)+ c(H+)= c(OH-)+ c(CH3COO-),因此时溶液呈中性,故 c(H
+)=c(OH-),可得 c(Na+)=c(CH3COO-),因 Na+、CH3COO-相较于 H+、OH-高很多,由此可知溶
液中离子浓度大小关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(3)因起始两种酸的物质的量相等,故 c(CH3COO-)+ c(CH3COOH)=c(CN-)+c(HCN),由此可知
c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH);
(4)从②~④的过程中,溶液中一直在发生酸碱中和,酸对于水的电离程度逐渐减小,故水
的电离程度由大到小的顺序是④③②。
19.氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的
工业制备原理为 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫
代硫酸钠,并检测氰化钠废水处理后的排放情况。
I、实验室通过如图所用的装置制备 Na2S2O3
(1)仪器 A 的名称___,使用前注意的事项___。
(2)b 装置的作用是___。
(3)装置 a 中发生反应的化学方程式____。
(4)反应开始后,c 中先有淡黄色浑浊产生,此浑浊物为___(填化学式);反应后剩余的 SO2
全部被 d 中的氢氧化钠溶液吸收,若恰好生成酸式盐,反应后的溶液呈___(“酸”或“碱”)
性,原因是___。
II、已知:废水中氰化钠的最高排放标准为 0.50mg/L。
(1)向氰化钠溶液中通入少量 CO2 能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、
②Na2CO3、③NaHCO3 三种溶液 pH 值由大到小的顺序(用序号表示):___。
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN 与 NaClO 反应,生成
NaOCN 和 NaCl;第二步,NaOCN 与 NaClO 反应,生成 Na2CO3、CO2、NaCl 和 N2。某工厂含氰废
水中 NaCN 的含量为 1.47mg/L,处理 10m3 这样的废水,理论上需要 5mol/LNaClO 溶液___L 处
理后才可以进行排放。
【答案】 (1). 分液漏斗 (2). 检验是否漏液 (3). 作安全瓶,防止倒吸 (4).
Na2SO3+H2SO4=Na2SO3+SO2↑+H2O (5). S (6). 酸 (7). HSO3
-的电离大于水解 (8).
②①③ (9). 0.15
【解析】
【详解】I、(1)仪器 A 的名称是分液漏斗;分液漏斗使用前需要注意检查是否漏液,避免发
生实验安全事故;
(2)根据装置图和气体压强变化,装置 b 能作安全瓶,防止倒吸;
(3)a 装置制备二氧化硫,其反应方程式为:Na2SO3+H2SO4=Na2SO3+SO2↑+H2O;
(4)二氧化硫与硫化钠在溶液中反应得到 S,硫与亚硫酸钠反应得到 Na2S2O3,c 中先有浑浊产
生,后又变澄清,此浑浊物为 S;该酸式盐为 NaHSO3,因 HSO3
-的电离大于水解,因此溶液呈
酸性;
II、(1)根据强酸制弱酸的规律可知,酸性由大到小顺序为:H2CO3>HCN>HCO3
-,根据越弱越水
解,浓度相同①NaCN、②Na2CO3、③NaHCO3 三种溶液 pH 值由大到小的顺序为:②①③;
(2)根据第一步和第二步的总反应可知,整个反应中氧化剂为 NaClO,还原剂为 NaCN,C 由
+2 价升高到+4 价,N 元素化合价从-3 价升高到 0 价,即 1molNaCN 失去 5mol 电子,1mol 次氯
酸钠得到 2mol 电子,根据得失电子守恒可列出关系式:
理论上需要 5mol/LNaClO 溶液为 0.75mol
5mol/L
=0.15L。
20.火电厂粉煤灰的主要成分为 SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2 等。某研究小组对其进行
综合处理的流程如图所示:
已知:①“酸浸”后钛主要以 TiOSO4 的形式存在,强电解质 TiOSO4 在溶液中仅能电离出 SO4
2-
和 TiO2+,TiO2+在 80℃左右水解生成 TiO2·xH2O。
②已知 FeSO4 在不同温度下的溶解度和析出晶体的组成如下表:
回答下列问题:
(1)加快“酸浸”速率的措施有哪些?写出一条即可___,滤渣 1 的主要成分为___(填化学
式)。
(2)“反应”时加入铁粉的作用为___(用离子方程式表示)。
(3)“结晶”时,若要获得 FeSO4·7H2O,则对溶液进行的操作是:蒸发浓缩,___,过滤,
洗涤,干燥。
(4)“水解”反应的离子方程式为____。
(5)实验室用 MgCl2·6H2O 制备 MgCl2 固体,在加热的同时要不断通入___(填化学式,下同)
若不通入该物质,最终得到的产物中可能含有___。
【答案】 (1). 微热(或将煤灰放入石绒棉中) (2). SiO2 (3). 2Fe3++Fe=3Fe2+
(4). 冷却到 50℃以下结晶 (5). TiO2++(x+1)H2O TiO2·xH2O+2H+ (6). HCl (7).
MgO 或 Mg(OH)Cl
【解析】
【分析】
粉煤灰的主要成分为 SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2 等,加入硫酸酸溶过滤得到滤渣 1
和滤液,氧化铝溶解生成硫酸铝,氧化亚铁溶解生成硫酸亚铁,氧化铁溶解生成硫酸铁,氧
化镁溶解生成硫酸镁,“酸浸”后钛主要以 TiOSO4 形式存在,滤渣为 SiO2,加入铁粉还原铁
离子生成亚铁离子,结晶析出硫酸亚铁晶体,过滤,得到滤液 1 含硫酸铝、硫酸镁、TiOSO4、
少量硫酸亚铁,水解过滤,TiOSO4 生成 TiO2⋅ xH2O,经酸洗水洗干燥和灼烧后得到 TiO2,滤液
2 中含硫酸铝和硫酸镁、少量硫酸亚铁,加入过氧化氢氧化亚铁离子为铁离子,调节溶液 pH
使铝离子和铁离子全部沉淀,过滤得到滤渣 2 为氢氧化铁和氢氧化铝沉淀,滤液 3 含硫酸镁,
据此分析。
【详解】(1)该反应为固液反应,若要加快“酸浸”的速率,可通过加热提高化学反应速率,
也可将煤灰放入石绒棉中,增大反应接触面积,提高化学反应速率;由上述分析可知,滤渣
主要为 SiO2;
(2)因需要将 Fe3+转化为 Fe2+以 FeSO4·7H2O 结晶除去,故加入铁粉的目的是将三价铁转化为
二价铁,其离子反应方程式为:2Fe3++Fe=3Fe2+;
(3)由题干表格可知,FeSO4 在 50℃以下主要析出晶体为 FeSO4·7H2O,若要获得 FeSO4·7H2O,
则对溶液进行的操作是:蒸发浓缩,冷却到 50℃以下结晶,过滤,洗涤,干燥;
(4)水解过程中,TiOSO4 生成 TiO2⋅ xH2O,因“强电解质 TiOSO4 在溶液中仅能电离出 SO4
2-和
TiO2+,TiO2+在 80℃左右水解生成 TiO2·xH2O”,故该反应的离子方程式为:
TiO2++(x+1)H2O TiO2·xH2O+2H+;
(5)MgCl2·6H2O 制备 MgCl2 固体,在加热过程中,MgCl2 中 Mg2+水解程度增大,生成的 HCl 随
着浓度增加会溢出,导致最终所得固体中含有 MgO 或 Mg(OH)Cl,因此在加热的同时要不断通
入 HCl 气体,以此抑制 MgCl2 的水解,从而获得 MgCl2 固体。