- 2021-08-23 发布 |
- 37.5 KB |
- 26页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习原电池化学电源课件(26张PPT)
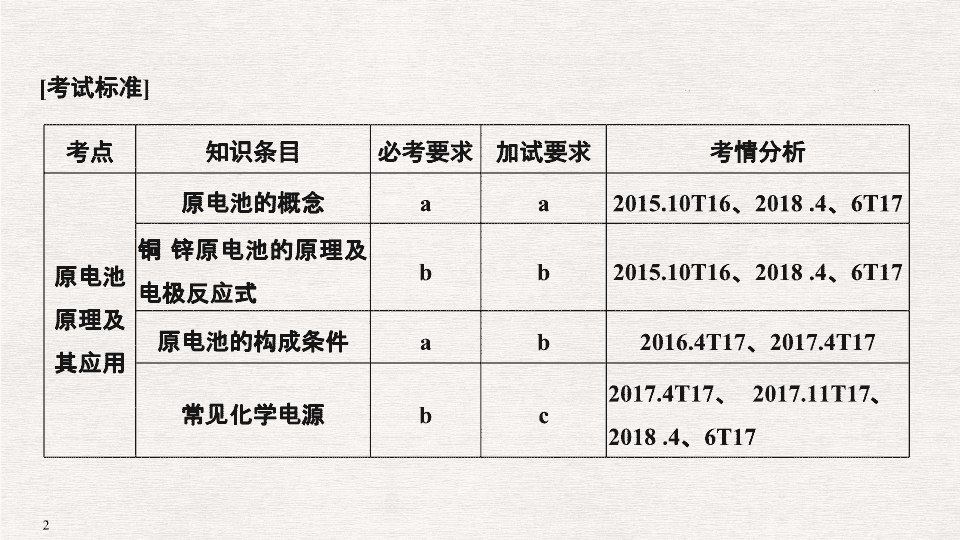
原电池 化学电源 [ 考试标准 ] 考点 知识条目 必考要求 加试要求 考情分析 原电池原理及其应用 原电池的概念 a a 2015.10T16 、 2018 .4 、 6T17 铜 锌原电池的原理及电极反应式 b b 2015.10T16 、 2018 .4 、 6T17 原电池的构成条件 a b 2016.4T17 、 2017.4T17 常见化学电源 b c 2017.4T17 、 2017.11T17 、 2018 .4 、 6T17 考点一:原电池的工作原理 1. ( 2018· 浙江余姚中学) 银锌电池是一种常见化学电源,其反应原理: Zn + Ag 2 O + H 2 O===Zn ( OH ) 2 + 2Ag ,其工作示意图如下。下列说法不正确的是( ) A.K + 向正极移动 B.Ag 2 O 电极发生还原反应 C.Zn 电极的电极反应式: Zn - 2e - + 2OH - === Zn ( OH ) 2 D. 放电前后电解质溶液的碱性保持不变 解析 根据总反应,锌失电子发生氧化反应,所以锌电极是负极、 Ag 2 O 电极是正极;阳离子向正极移动,故 A 正确; Ag 2 O 电极是正极,正极发生还原反应,故 B 正确; Zn 电极是负极,负极失电子发生氧化反应, Zn 电极的电极反应式: Zn - 2e - + 2OH - ===Zn ( OH ) 2 ,故 C 正确;根据总反应 Zn + Ag 2 O + H 2 O===Zn ( OH ) 2 + 2Ag ,放电过程消耗水,氢氧化钾浓度增大,碱性增强,故 D 错误。 答案 D 考点二:原电池正、负极及产物判断 2. 某电池以 K 2 FeO 4 和 Zn 为电极材料, KOH 溶液为电解质溶液。下列说法正确的是( ) 答案 A 考点三:原电池的构成条件及设计 3. ( 2017· 浙江湖州高一期末) 如图是某同学学习原电池后整理的学习笔记,错误的是( ) A. ① 电子流动方向 B. ② 电流方向 C. ③ 电极反应 D. ④ 溶液中离子移动方向 解析 A. 锌为负极,铜为正极,电子由锌片流向铜片,故 A 正确; B. 电流与电子运动方向相反,则电流由铜片经导线流向锌片,故 B 错误; C.H + 在铜片上得电子被还原生成 H 2 逸出,故 C 正确; D. 原电池工作时,阴离子移向负极,阳离子移向正极,故 D 正确。 答案 B 考点四:盐桥的作用 4. ( 2015· 浙江衢州质量检测) 某兴趣小组同学利用氧化还原反应: 2KMnO 4 + 10FeSO 4 + 8H 2 SO 4 ===2MnSO 4 + 5Fe 2 ( SO 4 ) 3 + K 2 SO 4 + 8H 2 O 设计如下原电池,盐桥中装有用饱和 Na 2 SO 4 溶液浸泡过的琼脂。下列说法正确的是( ) 答案 A 考点五:离子交换膜的应用 5. ( 2018· 浙江嘉兴一中高一期中) 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时, AgCl ( s ) ===Ag ( s )+ Cl ( AgCl ) [Cl ( AgCl )表示生成的氯原子吸附在氯化银表面 ] ,接着 Cl ( AgCl )+ e - ―→ Cl - ( aq ),若将光源移除,电池会立即恢复至初始状态。下列说法正确的是( ) A. 光照时,电流由铂流向银 B. 光照时, Pt 电极发生的反应为 2Cl - + 2e - ===Cl 2 C. 光照时, Cl - 向 Ag 电极移动 D. 光照时,电池总反应: AgCl ( s )+ Cu + ( aq ) === Ag ( s )+ Cu 2 + ( aq )+ Cl - ( aq ) 解析 该装置中氯原子在银电极上得电子发生还原反应,所以银作正极、铂作负极。 A. 光照时,电流从正极银流向负极铂,故 A 错误; B. 光照时, Pt 电极作负极,负极上亚铜离子失电子发生氧化反应,电极反应式为: Cu + ( aq )- e - === Cu 2 + ( aq ),故 B 错误; C. 光照时,该装置是原电池,银作正极,铂作负极,电解质中氯离子向负极铂移动,故 C 错误; D. 光照时,正极上氯原子得电子发生还原反应,负极上亚铜离子失电子,所以电池反应式为 AgCl ( s )+ Cu + ( aq ) ===Ag ( s )+ Cu 2 + ( aq )+ Cl - ( aq ),故 D 正确;故选 D 。 答案 D 考点六:新型电源 6. ( 2018· 金华十校高二) 一种锂铜可充电电池,工作原理如下图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片( Li + 交换膜)隔开。下列说法不正确的是( ) A. 陶瓷片允许 Li + 通过,不允许水分子通过 B. 放电时, N 极为电池的正极 C. 充电时,阳极反应为: Cu - 2e - ===Cu 2 + D. 充电时,接线柱 A 应与外接电源的正极相连 解析 A. 非水系电解液和水系电解液被锂离子固体电解质陶瓷片( Li + 交换膜)隔开,则陶瓷片允许 Li + 通过,不允许水分子通过,故 A 正确; B. 放电时,金属锂是负极,发生失电子的氧化反应, M 是负极, N 为电池的正极,故 B 正确; C. 充电时,阳极反应和放电时的正极反应互为逆过程,电极反应为: Cu - 2e - ===Cu 2 + ,故 C 正确; D. 充电时,接线柱 A 应与 M 极相连, M 是负极,所以 A 外接电源的负极,故 D 错误;故选 D 。 答案 D 考点七:电极反应式书写 7. ( 2016· 课标全国 Ⅱ , 11 ) MgAgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( ) A. 负极反应式为 Mg - 2e - ===Mg 2 + B. 正极反应式为 Ag + + e - ===Ag C. 电池放电时 Cl - 由正极向负极迁移 D. 负极会发生副反应 Mg + 2H 2 O===Mg ( OH ) 2 + H 2 ↑ 解析 根据题意, Mg 海水 AgCl 电池总反应式为 Mg + 2AgCl===MgCl 2 + 2Ag 。 A 项,负极反应式为 Mg - 2e - ===Mg 2 + ,正确; B 项,正极反应式为 2AgCl + 2e - ===2Cl - + 2Ag ,错误; C 项,对原电池来说,阴离子由正极移向负极,正确; D 项,由于镁是活泼金属,则负极会发生副反应 Mg + 2H 2 O===Mg ( OH ) 2 + H 2 ↑ ,正确。 答案 B 易错点一 不能正确理解原电池的工作原理 原电池工作原理示意图 [ 易错训练 1] ( 2018· 浙江杭州十四中高三) 某原电池装置如图所示,电池总反应为 2Ag + Cl 2 ===2AgCl 。下列说法正确的是( ) A. 正极反应为 AgCl + e - ===Ag + Cl - B. 放电时,交换膜右侧溶液中有大量白色沉淀生成 C. 若用 NaCl 溶液代替盐酸,则电池总反应随之改变 D. 当电路中转移 0.01 mol e - 时,交换膜左侧溶液中约减少 0.02 mol 离子 解析 根据电池总反应为 2Ag + Cl 2 ===2AgCl 可知, Ag 失电子作负极失电子,氯气在正极上得电子生成氯离子。 A. 正极上氯气得电子生成氯离子,其电极反应为: Cl 2 + 2e - ===2Cl - ,故 A 错误; B. 放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故 B 错误; C. 根据电池总反应为 2Ag + Cl 2 ===2AgCl 可知,用 NaCl 溶液代替盐酸,电池的总反应不变,故 C 错误; D. 放电时,当电路中转移 0.01 mol e - 时,交换膜左侧会有 0.01 mol 氢离子通过阳离子交换膜向正极移动,同时会有 0.01 mol Ag 失去 0.01 mol 电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少 0.01 mol ,则交换膜左侧溶液中约减少 0.02 mol 离子,故 D 正确。 答案 D 易错点二 对原电池结构、电极反应认识不清 1. 误认为原电池中负极材料一定比正极材料活泼。其实不一定,如 Mg 和 Al 用导线相连放在 NaOH 溶液中形成原电池时,铝作负极。 2. 误认为原电池质量增加的一极一定为原电池的正极。其实不一定,如铅蓄电池的负极,在工作时,电极由 Pb 转变为 PbSO 4 ,质量增加。 3. 误认为原电池的负极一定参加反应。其实不一定,如氢氧燃料电池的负极本身不参加反应,通入的燃料发生反应。 [ 易错训练 2] ( 2018· 暨阳联合考试) 用原电池原理可以处理硫酸工业产生的 SO 2 尾气。现将 SO 2 通入如图装置(电极均为惰性材料)进行实验。下列说法不正确的是( ) 答案 B 易错点三 不能正确区分原电池和电解池 图 1 中无外接电源,其中必有一个装置是原电池装置(相当于发电装置),为电解池装置提供电能,其中两个电极活泼性差异大者为原电池装置,如图 1 中左边为原电池装置,右边为电解池装置。图 2 中有外接电源,两烧杯均作电解池,且串联电解,通过两池的电子数目相等。 [ 易错训练 3] ( 2017· 温州十校联合模拟) 乙醛酸( HOOC - CHO )是有机合成的重要中间体。某同学组装了下图所示的电化学装置,电极材料 Ⅰ ~ Ⅳ 均为石墨,左池为氢氧燃料电池,右池为用 “ 双极室成对电解法 ” 生产乙醛酸,关闭 K 后,两极室均可产生乙醛酸,其中乙二醛与 Ⅲ 电极的产物反应生成乙醛酸。下列说法不正确的是( ) A. 电极 Ⅱ 上的电极反应式: O 2 + 4e - + 2H 2 O===4OH - B. 电极 Ⅳ 上的电极反应式: HOOC—COOH + 2e - + 2H + ===HOOC - CHO + H 2 O C. 乙二醛与 Ⅲ 电极的产物反应生成乙醛酸的化学方程式: Cl 2 + OHC - CHO + H 2 O===2HCl + HOOC - CHO D. 若有 2 mol H + 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为 1 mol 解析 A. 根据题意,乙二醛与 Ⅲ 电极的产物反应生成乙醛酸,则 Ⅲ 电极是阳极,则电极 Ⅱ 是燃料电池的正极,正极的电极反应式: O 2 + 4e - + 2H 2 O===4OH - , A 项正确; B. 根据上述分析,电极 Ⅳ 是电解池的阴极,关闭 K 后,两极室均可产生乙醛酸,则电极 Ⅳ 上的电极反应式: HOOC - COOH + 2e - + 2H + ===HOOC - CHO + H 2 O , B 项正确; C. 根据上述分析,电极 Ⅲ 是阳极,电极反应为 2Cl - - 2e - ===Cl 2 ↑ ,乙二醛与氯气反应生成乙醛酸,反应的化学方程式为 Cl 2 + OHC - CHO + H 2 O===2HCl + HOOC - CHO , C 项正确; D. 因为两极室均可产生乙醛酸,若有 2 mol H + 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为 2 mol , D 项错误。选 D 。 答案 D查看更多