- 2021-08-23 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北省保定市2019-2020学年高二上学期第三次月考化学试卷
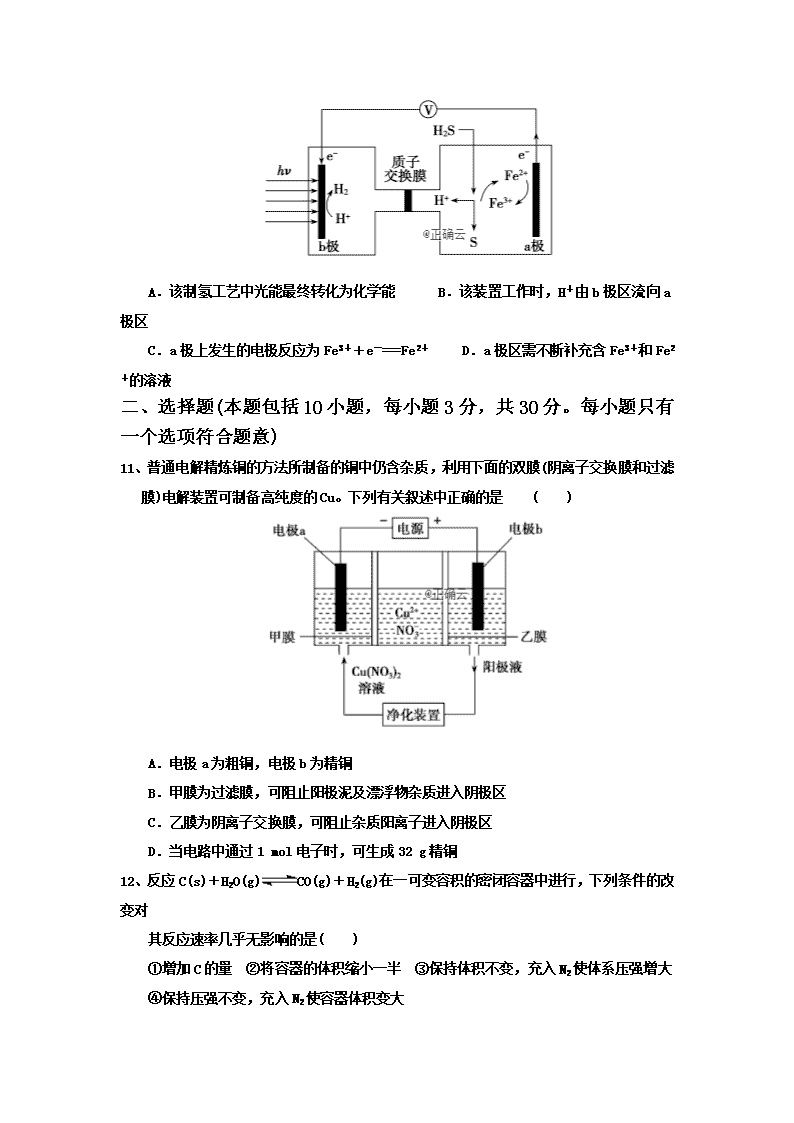
化学试题 可能用到的相对原子质量: H-1 O-16 C-12 Cu-64 一、 选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意) 1、下列说法不正确的是( ) A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行 B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可单独作为反应自发性的 判据 D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 2、在2A+B 3C+4D反应中,表示该反应速率最快的是 ( ) A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s) C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·min) 3、10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( ) A.K2SO4 B.H2SO4 C.CuSO4 D.Na2CO3 4、 如图所示,向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应: 2NO(g)+O2(g)2NO2(g)。下列情况不能说明反应已达到平衡状态的是( ) A.容器体积不再改变 B.混合气体的颜色不再改变 C.混合气体的密度不再改变 D.NO与O2的物质的量的比值不再改变 5、下列有关热化学方程式的叙述,正确的是( ) A.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热 B.由N2O4(g)2NO2(g) ΔH=-56.9 kJ·mol-1,可知将1 mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9 kJ C.由:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ D.已知101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则1 mol碳完全燃烧放出的热量大于110.5 kJ 6、勒夏特列原理是自然界一条重要的基本原理。下列事实能用勒夏特列原理解释的是( ) A.NO2气体受压缩后,颜色先变深后变浅 B.对2HI(g)H2(g)+I2(g)平衡体系加压,颜色迅速变深 C.合成氨工业采用高温、高压工艺提高氨的产率 D.配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化 7、合成氨所需的氢气可用煤和水做原料经多步反应制得,其中的一步反应为 CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是( ) A.增大压强 B.降低温度 C.增大CO的浓度 D.更换催化剂 8、利用下图装置进行实验,开始时,a、b两处液面相平, 密封好,放置一段时间。下列说法不正确的是( ) A.a管发生吸氧腐蚀,b管发生析氢腐蚀 B.一段时间后,a管液面高于b管液面 C.a处溶液的pH增大,b处溶液的pH减小 D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+ 9、已知化学反应A2(g)+B2(g)===2AB(g) ΔH=+100 kJ·mol-1的能量变化如图所示,判断 下列叙述中正确的是( ) A.加入催化剂,该反应的反应热ΔH将减小 B.每形成2 mol A—B键,将吸收b kJ能量 C.每生成2分子AB吸收(a-b)kJ能量 D.该反应正反应的活化能大于100 kJ·mol-1 10、我国最近在太阳能光电催化—化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法中正确的是( ) A.该制氢工艺中光能最终转化为化学能 B.该装置工作时,H+由b极区流向a极区 C.a极上发生的电极反应为Fe3++e-===Fe2+ D.a极区需不断补充含Fe3+和Fe2+的溶液 一、 选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意) 11、普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述中正确的是 ( ) A.电极a为粗铜,电极b为精铜 B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 D.当电路中通过1 mol电子时,可生成32 g精铜 12、反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对 其反应速率几乎无影响的是( ) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大 A.①④ B.②③ C.①③ D.②④ 13、在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的标准燃烧热分别为-393.5 kJ·mol-1、-285.8 kJ·mol-1、-870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( ) A.-488.3 kJ·mol-1 B.488.3 kJ·mol-1 C.-191 kJ·mol-1 D.191 kJ·mol-1 14、根据右图,下列判断中正确的是( ) A.烧杯a中的溶液pH降低 B.烧杯b中发生氧化反应 C.烧杯a中发生的反应为2H++2e-===H2↑ D.烧杯b中发生的反应为2Cl--2e-===Cl2↑ 15、在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。不正确的是( ) c/(mol·L-1) T/K 0.600 0.500 0.400 0.300 318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50 a 4.50 b 2.16 1.80 1.44 1.08 A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变 C.b<318.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同 16、2SO2(g)+O2(g)2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反 应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是( ) A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 B.500 ℃、101 kPa下,将1 mol SO2(g)和0.5 mol O2(g)置于密闭容器中充分反应生成SO3(g)放热a kJ,其热化学方程式为2SO2(g)+O2(g)2SO3(g)ΔH=-2a kJ·mol-1 C.该反应中,反应物的总键能小于生成物的总键能 D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热 17、一种新型可逆电池的工作原理如图所示。放电时总反应为: Al+3Cn(AlCl4)+4AlCl===4Al2Cl+3Cn(Cn表示石墨)。下列说法中正确的是( ) A.放电时负极反应为2Al-6e-+7Cl-===Al2Cl B.放电时AlCl移向正极 C.充电时阳极反应为AlCl-e-+Cn===Cn(AlCl4) D.电路中每转移3 mol电子,最多有1 mol Cn(AlCl4)被还原 18、利用反应:6NO2+8NH3===7N2+12H2O构成电池,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( ) A.电流从右侧电极经过负载后流向左侧电极 B.为使电池持续放电,离子交换膜选用阴离子交换膜 C.电极A反应式为2NH3-6e-===N2+6H+ D.当有4.48 L NO2(标准状况)被处理时,转移电子为0.8 mol 19、液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( ) A.电子从左侧电极经过负载后流向右侧电极 B.负极发生的电极反应式:N2H4+4OH--4e-===N2+4H2O C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 20、500 mL KNO3和Cu(NO3)2的混合溶液中c(NO)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( ) A.原混合溶液中c(K+)为0.2 mol·L-1 B.上述电解过程中共转移0.2 mol电子 C.电解得到的Cu的物质的量为0.05 mol D.电解后溶液中c(H+)为0.2 mol·L-1 三、填空题(本题包括5小题,共50分) 21、甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为 CO(g)+2H2(g)CH3OH(g) ΔH=-99 kJ·mol-1。 (1)关于该反应的下列说法中,错误的是________。 A.消耗CO和消耗CH3OH的速率相等时,说明该反应达到平衡状态 B.升高温度,正反应速率减小,逆反应速率增大 C.使用催化剂,可以提高CO的转化率 D.增大压强,该反应的化学平衡常数不变 (2)在某温度时,将1.0 mol CO与2.0 mol H2充入2 L的空钢瓶中,发生上述反应,在第5 min时达到化学平衡状态,此时甲醇的物质的量分数为10%。甲醇浓度的变化状况如图所示。 ①从反应开始到5 min时,生成甲醇的平均速率为________________。 ②1 min时的v正(CH3OH)________4 min时v逆(CH3OH)(填“大于”“小于”或“等于”)。 ③若将钢瓶换成同容积的绝热钢瓶,重复上述实验,平衡时甲醇的物质的量分数________0.1(填“>”“<”或“=”)。 22、N2与H2反应生成NH3的过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1 mol N2和3 mol H2,使反应N2+3H22NH3达到平衡,测得反应放出热量为Q1。 填写下列空白: (1) Q1 92 kJ。 (2) b曲线是 时的能量变化曲线。 (3)上述条件下达到平衡时H2的转化率为 。 (4)在温度体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则2Q1与Q2的关系为 。 23、(1)以NO2、O2、熔融NaNO3组成的燃料电池 装置如图,在使用过程中石墨Ⅰ电极反应生成 一种氧化物Y,则该电极反应式为 __________________________________。 (2)燃料电池是将燃料能源的化学能直接转化 为电能的“能量转化器”。目前已经使用的二甲醚(CH3OCH3)燃料电池X极电极反应为O2+2H2O+4e-===4OH-,则X是________(填“正极”或“负极”),发生________(填“氧化”或“还原”)反应。该电池的电解质显________(填“酸性”“碱性”或“中性”),另一极的电极反应为____________________。标准状况下,有44.8 L O2完全反应,则电路中转移________mol电子,消耗________g二甲醚。 24、某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有_____________________________________________ ________________________________________________________________________。 (2)硫酸铜溶液可以加快氢气生成速率的原因是______________________________________。 (3)要加快上述实验中气体产生的速率,还可采取的措施有_____________________(答两种)。 (4)为了进一步探究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。 实验 混合溶液 A B C D E F 4 mol·L-1 H2SO4/mL 30 V1 V2 V3 V4 V5 饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20 H2O/mL V7 V8 V9 V10 10 0 ①请完成此实验设计,其中:V1=________,V6=______,V9=________。 ②该同学最后得出的结论为当加入少量CuSO4溶液,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:________________________________________________________________________。 25、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示: t/℃ 700 800 830 1 000 1 200 K 0.6 0.9 1.0 1.7 2.6 回答下列问题: (1)该反应的化学平衡常数表达式为K=________。 (2)该反应为________(填“吸热”或“放热”)反应。 (3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2 O),试判断此时的温度为____________℃。 (4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K________(填“大于”“小于”或“等于”)1.0。 (5)830 ℃时,容器中的化学反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________(填“向正反应方向”、“向逆反应方向”或“不”)移动。 化学答案 一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意) 1—5 C B A D D 6—10 A B C D A 二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意) 11—15 D C A B D 16—20 B C C D A 三、填空题(本题包括5小题,共50分) 21、(共8分,每空2分) (1)BC (2)①0.025 mol·L-1·min-1 ②大于 ③< 22、(共8分,每空2分) (1)< (2)加入催化剂 (3)Q1/92 (4)Q2>2Q1 23、(共14分,每空2分) (1)NO2+NO3——-e-===N2O5 (2)正极 还原 碱性 CH3OCH3-12e-+16OH-===2CO32-+11H2O 8 24、(共11分,除说明外,每空2分) (1)(每空1分)Zn+CuSO4===ZnSO4+Cu, Zn+H2SO4===ZnSO4+H2↑ (2)CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了H2产生的速率 (3)升高反应温度,适当增加硫酸的浓度,增大锌粒的表面积等(答两种即可) (4)①30 10 17.5 (每空1分) ②当加入一定量的CuSO4溶液后,生成的单质Cu会沉积在Zn的表面,减少了Zn与硫酸溶液的接触面积 25、(共9分,除说明外,每空2分) (1) (1分) (2)吸热 (3)700 ℃ (4)等于 (5)不查看更多