- 2021-08-23 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】山西省晋中市和诚中学2019-2020学年高二下学期周练一
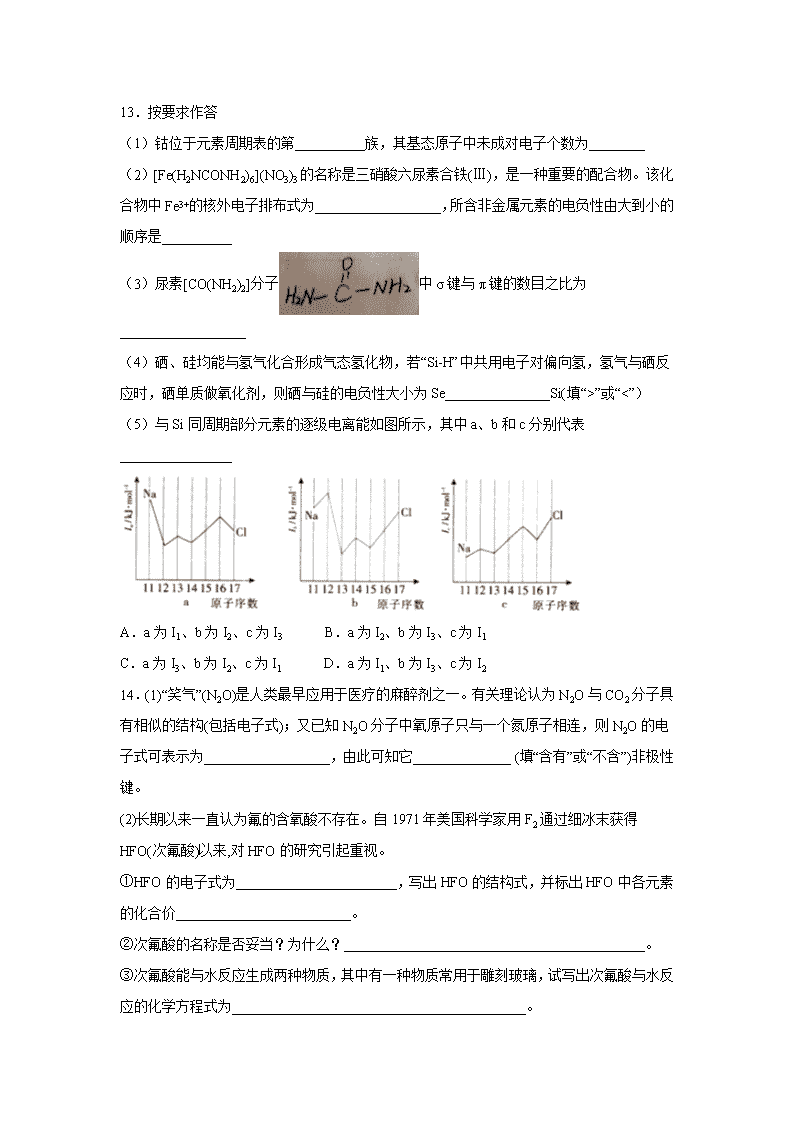
山西省晋中市和诚中学2019-2020学年高二下学期周练一 考试时间:50分钟 满分:100分 相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 一、 单选题 (每个5分,共60分) 1.第三周期元素中,微粒半径最大的是( ) A.Na+ B.Al3+ C.S2- D.Cl- 2.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ,②1s22s22p63s23p3,③1s22s22p3,④1s22s22p5,则下列有关比较中正确的是( ) A.原子半径:④>③>②>① B.第一电离能:④>③>②>① C.电负性:④>③>②>① D.最高正化合价:④>③=②>① 3.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( ) A.Y原子的价层电子排布式为3s23p5 B.稳定性:Y的氢化物>Z的氢化物 C.第一电离能:Y<Z D.X、Y两元素形成的化合物为离子化合物 4.X、Y为两种元素的原子,X-与Y2+ 具有相同的电子层结构,由此可知( ) A.X的原子半径大于Y的原子半径 B.X的电负性大于Y的电负性 C.X- 的离子半径小于Y2+ 的离子半径 D.X的第一电离能小于Y的第一电离能 5.下列原子的价电子排布中,对应元素第一电离能最大的是( ) A.3s23p1 B.3s23p2 C.3s23p3 D.3s23p4 6.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( ) A.X与Y形成化合物时,X显负价,Y显正价 B.第一电离能Y一定小于X C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性 D.气态氢化物的稳定性:HmY小于HnX 7.以下有关元素性质的说法不正确的是( ) A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是① B.具有下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ D.某元素气态基态离子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+ 8.最近科学家研制出一种新的分子,它具有类似白磷状结构,且分子中每个原子都满足8电子稳定结构,化学式为N4,下列说法正确的是( ) A.N4是一种新型化合物 B.N4和N2互为同素异形体 C.N4分子和N2一样含有N≡N D.N4中含极性共价键 9.下列化学式及结构式中,从成键情况看不合理的是( ) A.CH3N, B.CH4Si, C.CH2SO, D.CH4S, 10.有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是( ) A.D原子的简化电子排布式为[Ar]3s23p4 B.B、C两元素的第一电离能大小关系为B>C C.用电子式表示AD2的形成过程为 D.由B60分子形成的晶体与A60相似,分子中总键能:B60>A60 11.下列各组微粒,不能互称为等电子体的是( ) A.NO2、NO2+、NO2﹣ B.CO2、N2O、N3﹣ C.CO32﹣、NO3﹣、SO3 D.N2、CO、CN﹣ 12.在以下性质的比较中,正确的是( ) A.微粒半径: B.共价键的键能: C.分子中的键角: D.共价键的键长: 二、填空题(每空2分,共40分) 13.按要求作答 (1)钴位于元素周期表的第__________族,其基态原子中未成对电子个数为________ (2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__________________,所含非金属元素的电负性由大到小的顺序是__________ (3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__________________ (4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se_______________Si(填“>”或“<”) (5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表________________ A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1 C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2 14.(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为__________________,由此可知它______________ (填“含有”或“不含”)非极性键。 (2)长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对HFO的研究引起重视。 ①HFO的电子式为_______________________,写出HFO的结构式,并标出HFO中各元素的化合价_________________________。 ②次氟酸的名称是否妥当?为什么?___________________________________________。 ③次氟酸能与水反应生成两种物质,其中有一种物质常用于雕刻玻璃,试写出次氟酸与水反应的化学方程式为__________________________________________。 15.X、Y、Z、W、E、F、G七种元素为周期表中原子序数依次增大的前四周期元素。6X的一种核素能用于测定文物的年代;Y元素最高价氧化物对应水化物能与其常见氢化物反应生成盐M;Z原子核外成对电子数是未成对电子数的3倍;W的原子半径在同周期主族元素中最大;E的基态原子的所有电子位于四个能级且每个能级均全充满;F的电负性在同周期中最大;G的基态原子N层只有一个电子,内层电子全部排满。请回等下列问题: (用X、Y、Z、W、E、F、G所对应的元素符号表示) (1)写山F的基态原子的核外电子排布式:________________ (2)Y、Z、W的电负性由大到小的顺序为_______________ (3)以下可以表示X的基态原子的原子轨道表示式的是______________ A. B. C. (4)下图可以表示F的氢化物中电子云重叠方式的是_________ A. B. C. D. (5)基态E原子核外存在_______种运动状态不同的电子。 (6)G元素位于周期表中的_______区,基态原子价电子排布式为__________ 【参考答案】 1.C 2.B 3.C 4.B 5.C 6.B 7.D 8.B 9.B 10.A 11.A 12.B 13.VIII 3 [Ar]3d5或1s22s22p63s23p63d5 O>N>C>H 7:1 > B 14. 含有 不妥当 因HFO中氟元素显负一价 HFO+H2O=H2O2+HF 15. 1s22s22p63s23p5或[Ne]3s23p5 O>N>Na A B 12 ds 3d104s1查看更多