- 2021-08-23 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学一、二轮衔接专题整合(十三) 常用仪器与基本操作作业
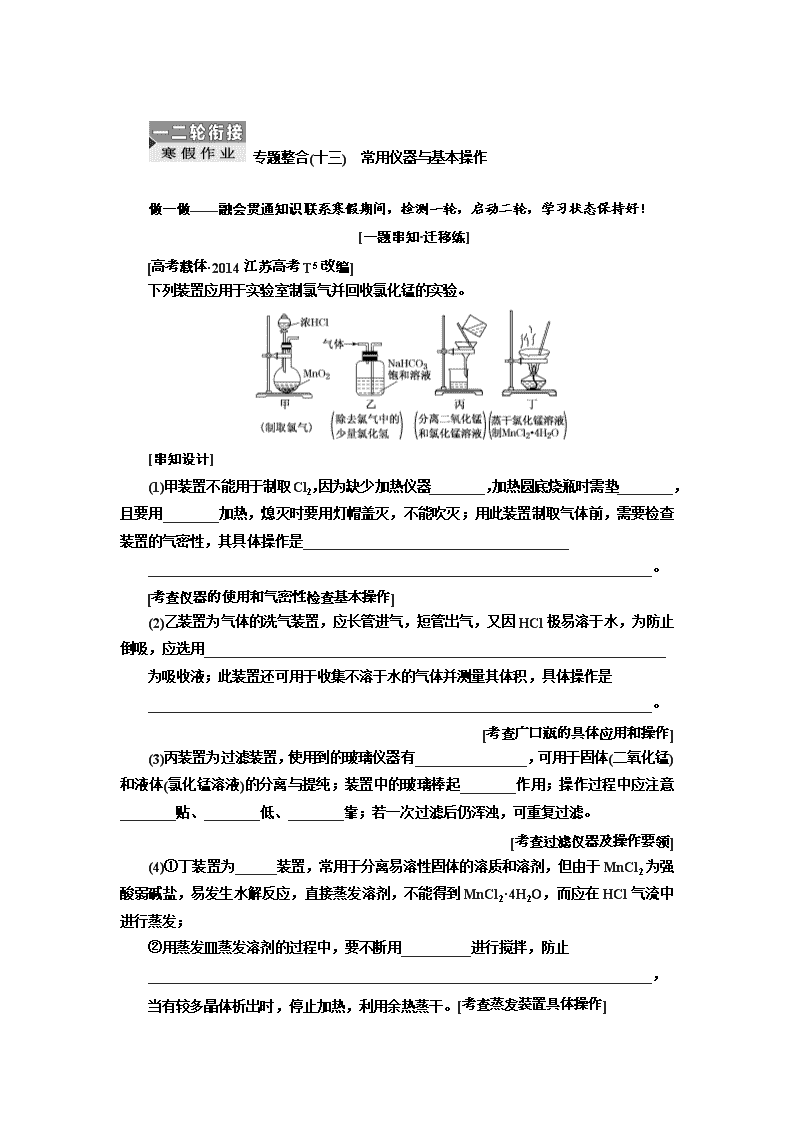
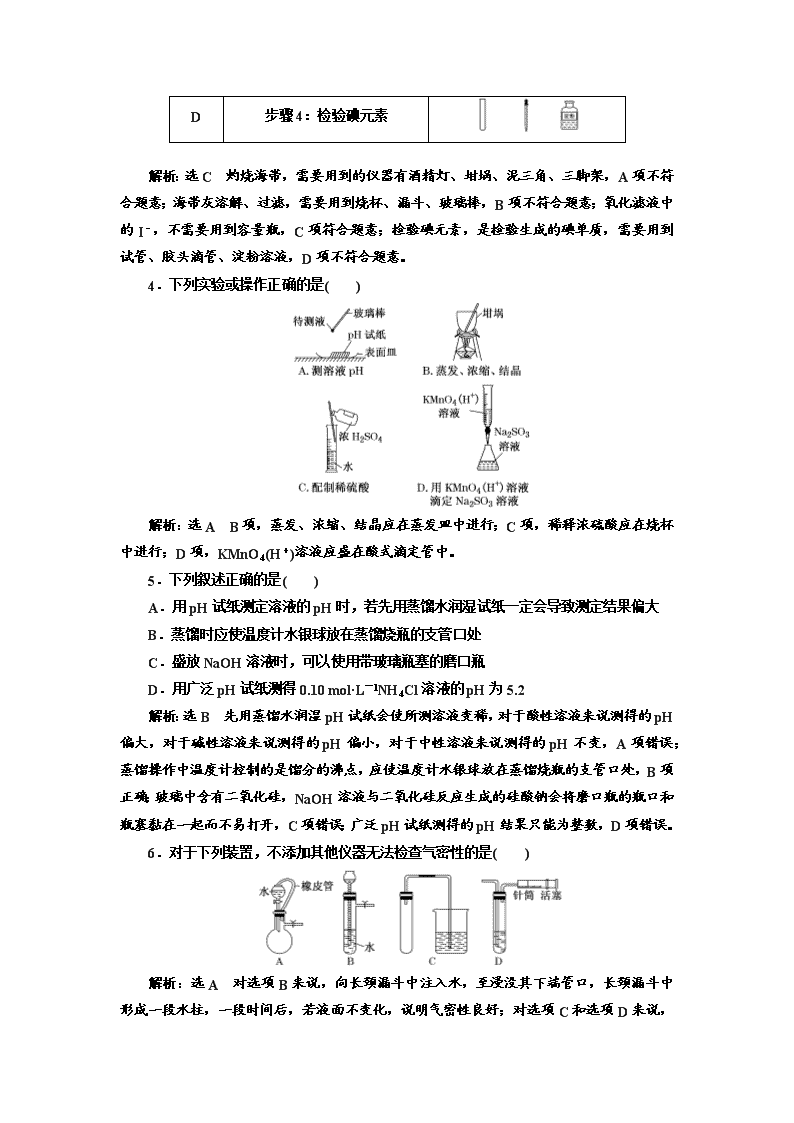
专题整合(十三) 常用仪器与基本操作 做一做——融会贯通知识联系寒假期间,检测一轮,启动二轮,学习状态保持好! [一题串知·迁移练] 下列装置应用于实验室制氯气并回收氯化锰的实验。 [串知设计] (1)甲装置不能用于制取Cl2,因为缺少加热仪器________,加热圆底烧瓶时需垫________,且要用________加热,熄灭时要用灯帽盖灭,不能吹灭;用此装置制取气体前,需要检查装置的气密性,其具体操作是______________________________________ ________________________________________________________________________。 (2)乙装置为气体的洗气装置,应长管进气,短管出气,又因HCl极易溶于水,为防止倒吸,应选用__________________________________________________________________ 为吸收液;此装置还可用于收集不溶于水的气体并测量其体积,具体操作是 ________________________________________________________________________。 (3)丙装置为过滤装置,使用到的玻璃仪器有________________,可用于固体(二氧化锰)和液体(氯化锰溶液)的分离与提纯;装置中的玻璃棒起________作用;操作过程中应注意________贴、________低、________靠;若一次过滤后仍浑浊,可重复过滤。 (4)①丁装置为______装置,常用于分离易溶性固体的溶质和溶剂,但由于MnCl2为强酸弱碱盐,易发生水解反应,直接蒸发溶剂,不能得到MnCl2·4H2O,而应在HCl气流中进行蒸发; ②用蒸发皿蒸发溶剂的过程中,要不断用__________进行搅拌,防止 ________________________________________________________________________, 当有较多晶体析出时,停止加热,利用余热蒸干。 答案:(1)酒精灯 石棉网 外焰 连接导管并将导气管末端伸入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中有气泡产生,停止微热,冷却后导气管末端形成一段水柱,且保持一段时间不下降,则说明气密性良好 (2)饱和食盐水 洗气瓶内充满水,短管进气,长管排水即可 (3)烧杯、玻璃棒、漏斗 引流 一 二 三 (4)①蒸发 ②玻璃棒 局部过热导致液体或晶体飞溅 [保分题目·综合练] 1.海带提碘实验中不需要的仪器是( ) 解析:选C 海带提碘实验中,首先应在坩埚中灼烧海带,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入硫酸和过氧化氢,发生氧化还原反应生成碘,然后加入石油醚发生萃取,将萃取液蒸馏得到碘,涉及的操作有灼烧、溶解、过滤、萃取、分液、蒸馏等,不需要的仪器为容量瓶。 2.下列仪器使用正确的是( ) A.使食盐水中NaCl结晶析出时,常用到的仪器有坩埚、酒精灯、玻璃棒、泥三角 B.蒸馏时,应使温度计水银球插入液面以下 C.容量瓶使用前应先检漏再用待装液润洗 D.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 解析:选D 使食盐水中NaCl晶体析出的方法通常是蒸发结晶,使用的容器应是蒸发皿而不是坩埚,A错;蒸馏时,应使温度计水银球在蒸馏烧瓶支管口处,B错;容量瓶使用前不能用待装液润洗,C错;分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出,D正确。 3.用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到的是( ) 选项 实验步骤 实验用品 A 步骤1:将海带灼烧灰化 B 步骤2:将海带灰溶解、过滤 C 步骤3:氧化滤液中的I- D 步骤4:检验碘元素 解析:选C 灼烧海带,需要用到的仪器有酒精灯、坩埚、泥三角、三脚架,A项不符合题意;海带灰溶解、过滤,需要用到烧杯、漏斗、玻璃棒,B项不符合题意;氧化滤液中的I-,不需要用到容量瓶,C项符合题意;检验碘元素,是检验生成的碘单质,需要用到试管、胶头滴管、淀粉溶液,D项不符合题意。 4.下列实验或操作正确的是( ) 解析:选A B项,蒸发、浓缩、结晶应在蒸发皿中进行;C项,稀释浓硫酸应在烧杯中进行;D项,KMnO4(H+)溶液应盛在酸式滴定管中。 5.下列叙述正确的是( ) A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏大 B.蒸馏时应使温度计水银球放在蒸馏烧瓶的支管口处 C.盛放NaOH溶液时,可以使用带玻璃瓶塞的磨口瓶 D.用广泛pH试纸测得0.10 mol·L-1NH4Cl溶液的pH为5.2 解析:选B 先用蒸馏水润湿pH试纸会使所测溶液变稀,对于酸性溶液来说测得的pH偏大,对于碱性溶液来说测得的pH偏小,对于中性溶液来说测得的pH不变,A项错误;蒸馏操作中温度计控制的是馏分的沸点,应使温度计水银球放在蒸馏烧瓶的支管口处,B项正确;玻璃中含有二氧化硅,NaOH溶液与二氧化硅反应生成的硅酸钠会将磨口瓶的瓶口和瓶塞黏在一起而不易打开,C项错误;广泛pH试纸测得的pH结果只能为整数,D项错误。 6.对于下列装置,不添加其他仪器无法检查气密性的是( ) 解析:选A 对选项B来说,向长颈漏斗中注入水,至浸没其下端管口,长颈漏斗中形成一段水柱,一段时间后,若液面不变化,说明气密性良好;对选项C和选项D 来说,被检查的部分属于一个密封体系,能检验其气密性;对选项A来说,分液漏斗与烧瓶用橡皮管连接,气体压强相等,在不添加其他仪器的情况下无法检查气密性。 7.下列有关实验的操作正确的是( ) 选项 实验 操作 A 制备Fe(OH)3胶体 煮沸盛在小烧杯中的25 mL蒸馏水,加入5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色 B 配制250 mL 0.1 mol·L-1NaOH溶液 称取1.0 g NaOH 固体放入250 mL容量瓶中,加水至离刻度线1~2 cm处,改用胶头滴管滴入蒸馏水到刻度线 C 氢气还原氧化铜 用酒精灯加热盛有灼热的氧化铜的反应管并通入氢气,固体完全变红后,先停止通氢气,然后停止加热 D 除去NaBr溶液中少量的NaI 在溶液中滴入少量AgNO3溶液至不再产生黄色沉淀,然后过滤 解析:选A Fe(OH)3胶体的制法为煮沸盛在小烧杯中的25 mL蒸馏水,加入5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色即可得到,所以该操作正确,故A正确;容量瓶不能溶解或稀释试剂,应该先将NaOH固体在烧杯中溶解,等NaOH溶液温度恢复到室温后,再转移到容量瓶中,故B错误;氢气还原CuO时,应该先通氢气再加热,反应结束时先停止加热,后停止通氢气,故C错误;NaBr、NaI都可以和硝酸银反应生成沉淀,应该用溴水除去NaI,然后再用萃取、分液方法除去碘即可,故D错误。 8.下列有关实验的叙述正确的是( ) A.可用碱式滴定管量取12.85 mL的KMnO4溶液 B.实验室蒸馏石油可用图甲所示实验装置 C.取用金属钠或钾时,没用完的钠或钾要放回原瓶 D.配制500 mL 0.4 mol·L-1 NaCl溶液,必要的仪器如图乙所示 解析:选C A项KMnO4溶液具有强氧化性,不能用碱式滴定管量取;B项图甲中温度计水银球应位于蒸馏烧瓶支管口处;D项不需要分液漏斗,而需要容量瓶。 9.实验室中需要配制0.2 mol·L-1CuSO4溶液500 mL,以下配制操作正确的是( ) A.称取16.0 g CuSO4固体,溶于500 mL蒸馏水 B.称取25.0 g 胆矾,溶于500 mL蒸馏水 C.量取2 mol·L-1CuSO4溶液50 mL于一只250 mL 烧杯中,加适量蒸馏水稀释,冷却到室温后转移(包括洗涤)到一只500 mL容量瓶中,并继续加水定容到刻度线,摇匀 D.量取2 mol·L-1CuSO4溶液50 mL于一只500 mL容量瓶中,加适量蒸馏水稀释至刻度线,摇匀 解析:选C 称取16.0 g CuSO4固体,溶于500 mL蒸馏水,与称取25.0 g 胆矾,溶于500 mL蒸馏水,溶液体积均不等于500 mL,溶液浓度均不等于0.2 mol·L-1,故A、B错误;依据溶液稀释过程中溶质的物质的量不变得:2 mol·L-1×0.050 L=0.2 mol·L-1×0.5 L,所以所得溶液浓度为0.2 mol·L-1,故C正确;不能在容量瓶中稀释浓溶液,故D错误。 10.实验室模拟从海水中制备NaOH溶液,其流程如下: 下列有关说法正确的是( ) A.步骤一用到的仪器有坩埚、三脚架和泥三角 B.步骤二添加NaOH的目的是除去Ca2+ C.步骤二的过滤操作是在加入盐酸之后 D.步骤三最后一步总反应为2NaCl+2H2O2NaOH+Cl2↑+H2↑ 解析:选D 步骤一是海水经蒸发结晶得到粗盐,蒸发结晶需要的仪器有酒精灯、蒸发皿、玻璃棒、铁架台,A项错误;步骤二添加NaOH的目的是除去Mg2+,B项错误;应在步骤二的过滤操作之后加入盐酸,以防止生成的碳酸钙、氢氧化镁等沉淀溶解,C项错误;步骤三最后一步为电解精盐的饱和溶液,总反应为2NaCl+2H2O2NaOH+H2↑+Cl2↑,D项正确。 看一看——主干知识牢记心间寒假自修,平时浏览,考前温故,基础知识何时都不能丢! 1.四类常用仪器 (1)用作容器或反应器的仪器 (2)用于分离、提纯和干燥的仪器 (3)常用计量仪器 (4)其他仪器 2.十大基本操作 (1)测定溶液pH的操作 将一小块pH试纸放在洁净的表面皿上,用清洁干燥的玻璃棒蘸取少量待测液点到pH试纸中央,待变色稳定后再和标准比色卡对照,读出对应的pH。 (2)沉淀剂是否过量的判断 ①静置,向上层清液中继续滴加少量沉淀剂,若无沉淀产生,则证明沉淀剂已过量,否则沉淀剂不过量。 ②静置,取上层清液适量于另一洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,若产生沉淀,证明沉淀剂已过量,否则沉淀剂不过量。 (3)洗涤沉淀的操作 把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置,使蒸馏水滤出,重复2~3次即可。 (4)判断沉淀是否洗净的操作 取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已经洗净。 (5)装置气密性检查 ①简易装置:将导气管一端放入水中(液封气体),用手捂热试管,观察现象:若导管口有气泡冒出,冷却到室温后,导管口有一段稳定的水柱,表明装置气密性良好。 ② 有长颈漏斗的装置如图:用止水夹关闭烧瓶右侧的导气管,向长颈漏斗中加入适量水,使液面没过导管口,长颈漏斗中会形成一段液柱,停止加水,过一段时间后,若漏斗中的液柱无变化,则装置气密性良好。 (6)气体验满和检验的操作 ①氧气验满:将带火星的木条平放在集气瓶口,若木条复燃,则说明收集的氧气已满。 ②可燃性气体(如氢气)的验纯:用排水法收集一小试管的气体,用大拇指摁住管口移近火焰,放开手指,若听到尖锐的爆鸣声,则气体不纯;若听到轻微的“噗”的一声,则气体纯净。 ③二氧化碳验满:将燃着的木条平放在集气瓶口,若火焰熄灭,则气体已满。 ④氨气验满:将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝说明气体已满。 ⑤氯气验满:用湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝说明气体已满。 (7)萃取分液操作 关闭分液漏斗活塞,将混合液倒入分液漏斗中,塞上塞子,用右手心顶住塞子,左手握住活塞部分,将分液漏斗倒置,充分振荡、静置、分层,在漏斗下面放一个小烧杯,先打开上口塞子再打开分液漏斗活塞,使下层液体从下口沿烧杯壁流下,上层液体从上口倒出。 (8)浓H2SO4稀释操作 将浓H2SO4沿烧杯壁缓缓注入水中,并用玻璃棒不断搅拌。 (9)粗盐的提纯 ①实验室提纯粗盐的实验操作依次为取样、溶解、沉淀、过滤、蒸发结晶、过滤、烘干。 ②若过滤时发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中液面高出滤纸边缘、玻璃棒靠在单层滤纸一边弄破滤纸。 (10)从某物质稀溶液中结晶的实验操作 ①溶解度受温度影响较小的:蒸发→结晶→过滤。 ②溶解度受温度影响较大或带结晶水的:蒸发浓缩→冷却结晶→过滤。 3.图示操作规范 (1)向容器内加固体药品 (2)向容器内加液体药品 (3)气体的溶解与吸收 ①溶解度不大气体的吸收 ②易溶气体的吸收(以氨气吸收为例)查看更多