- 2021-08-23 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
吉林省长春市第二十九中学2020届高三上学期期中考试化学试卷
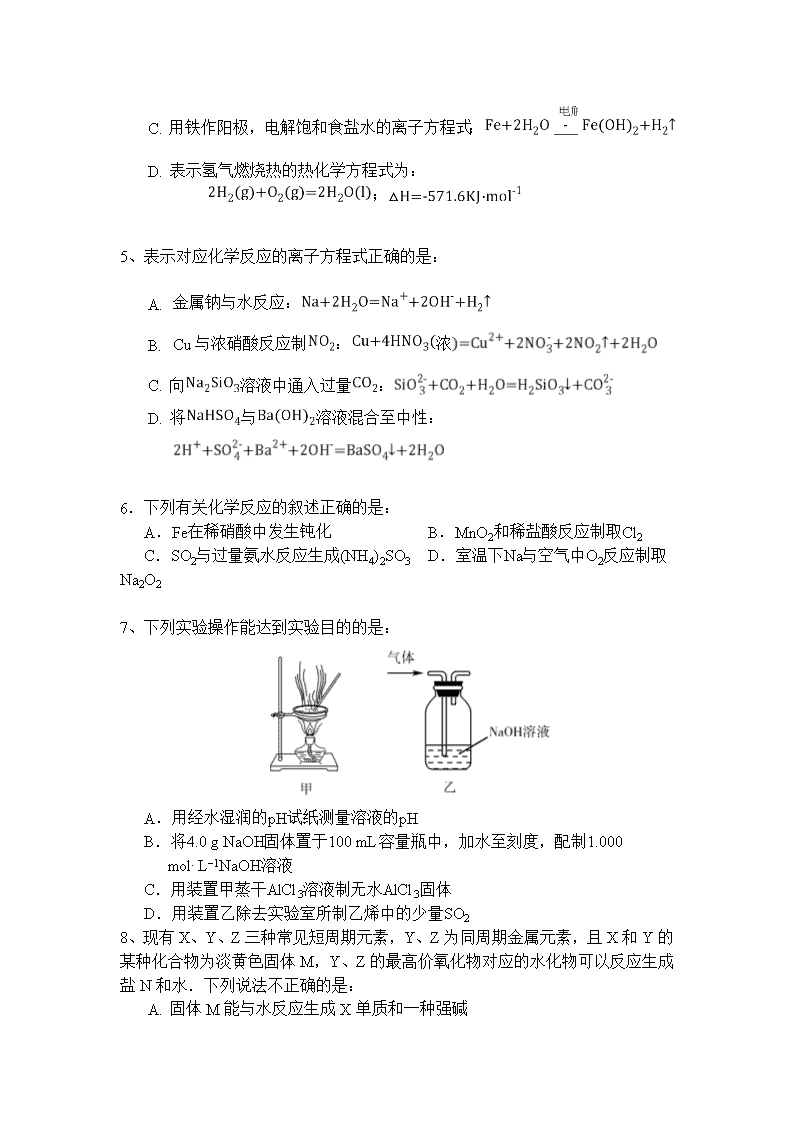
化学试卷 答题时间:80 分钟 满分:100分 可能用到的相对原子质量: H:1 N:14 O:16 Ti:48 Fe:56 一、 选择题:(共14小题。每小题有1个正确选项,每小题3分,共42分) 1. 化学与生产、生活、科技、环境等密切相关,下列说法正确的是: A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 B. 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 C. 石油的分馏、煤的干馏、石油的裂解都是化学变化 D. 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 2、反应NH4Cl+NaNO2NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是: A.H2O的电子式: B.N2的结构式:N=N C.Na+的结构示意图: D.中子数为18的氯原子: 3、表示阿伏加德罗常数的值.下列说法正确的是: A. 一定条件下,与足量充分反应,生成分子数为N B. 氨基中含有的电子数为0.7NA C. 克中含有的共用电子对数为0.1NA D. 常温常压下,16克和混合气体含有的氧原子数为NA 4、 化学用语是学习化学的工具和基础.下列有关化学用语的使用正确的是: A. 食醋呈酸性的原因是: B. 纯碱溶液呈碱性的原因是: C. 用铁作阳极,电解饱和食盐水的离子方程式: D. 表示氢气燃烧热的热化学方程式为: ; 5、表示对应化学反应的离子方程式正确的是: A. 金属钠与水反应: B. Cu与浓硝酸反应制:浓 C. 向溶液中通入过量: D. 将与溶液混合至中性: 6.下列有关化学反应的叙述正确的是: A.Fe在稀硝酸中发生钝化 B.MnO2和稀盐酸反应制取Cl2 C.SO2与过量氨水反应生成(NH4)2SO3 D.室温下Na与空气中O2反应制取Na2O2 7、下列实验操作能达到实验目的的是: A.用经水湿润的pH试纸测量溶液的pH B.将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L−1NaOH溶液 C.用装置甲蒸干AlCl3溶液制无水AlCl3固体 D.用装置乙除去实验室所制乙烯中的少量SO2 8、现有X、Y、Z三种常见短周期元素,Y、Z为同周期金属元素,且X和Y的某种化合物为淡黄色固体M,Y、Z 的最高价氧化物对应的水化物可以反应生成盐N和水.下列说法不正确的是: A. 固体M能与水反应生成X单质和一种强碱 B. Z单质的薄片在酒精灯上加热能熔化,但不滴落 C. Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 D. M和N中均含有离子键和共价键 9、用滴有氯化钠溶液的湿润的滤纸分别做甲、乙两个实验,下列判断正确的: 甲 乙 A.a极上发生还原反应 B.铁片腐蚀速率:乙>甲 C.d为阴极,发生的反应为:Fe-2e-=Fe2+ D.b极上发生的反应为:O2+2H2O+4e-=4OH- 10、常温下,下列各组离子在指定溶液中一定能大量共存的是: A.无色溶液中:Na+、NH4+、Cu2+、SO42- B.=1×10-12的溶液中:K+、Na+、CO32-、NO3- C.与铝反应产生大量氢气的溶液:Na+、NH4+、HCO3-、Cl-、 D.酸性溶液中:Na+、ClO-、I-、K+ 11.在给定条件下,下列选项所示的物质间转化均能实现的是: A.NaCl(aq)Cl2(g)FeCl2(s) B.MgCl2(aq)Mg(OH)2(s)MgO (s) C.S(s)SO3(g)H2SO4(aq) D.N2(g)NH3(g)Na2CO3(s) 12、一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为:NiO2+Fe+2H2OFe(OH)2+Ni(OH)2.下列有关该电池的说法中正确的是: A. 放电时电解质溶液显强酸性 B. 充电时阳板反应为 C. 放电时正极附近溶液pH减小 D. 充电时阴极附近溶液的碱性保持不变 13、下列根据实验操作和现象所得出的结论错误的是: 选项 实验操作 实验现象 结论 A 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 出现白色沉淀 溶液X不一定含有SO42- B 向FeCl3+3KSCNFe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl 体系颜色无变化 KCl不能使该平衡移动 C 向浓度均为0. 1 mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 出现黄色沉淀 Ksp(AgCl)>Ksp(AgI) D 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 均有固体析出 蛋白质均发生变性 14、常温下,有下列四种溶液: ① ② ③ ④ 0.1mol/L盐酸 pH=3盐酸 0.1mol/L氨水 pH=11氨水 下列说法正确的是: A. 由水电离出的:①>③ B. ③稀释到原来的100倍后,pH与④相同 C. ①与③混合,若溶液PH=7,则V(盐酸)>V(氨水) D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为: c(NH4+)>c(OH-)>c(Cl-)>c(H+) 二、填空题(本题共4道大题,共58分) 15、(共14分)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: 2SO2(g)+ O2(g)2SO3 △H =-190 kJ·mol﹣1 (1)(3分)该反应的平衡常数表达式________,该反应450℃时的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。 (2)(4分)在一个固定容积为5L的密闭容器中充入和,半分钟后达到平衡,测得容器中含,则________mol/(L min)若继续通入 0.20mol SO 2 和 0.10mol O 2 ,则平衡 ___________________ 移动(填 “ 向正反应方向 ” 、 “ 向逆反应方向 ” 或 “ 不 ” ) (3)(2分)请写出提高转化率的两种方法________________、________________。 (4)(3分)工业上用氨水吸收尾气,最终得到化肥,溶液中与之比________2:1(填“>”、“<”或“=”),用离子方程式解释原因____ ____。 (5)(2分)将与的混合气体持续通入一定量的NaOH溶液中,产物中某离子的物质的量浓度与通入气体的体积有如图所示关系,该离子是________________。 16、 (共14分)研究NOx、SO2、CO等大气污染气体的处理具有重要意义。 (1)(2分)氮元素在周期表中的位置是__ ____; NH3的电子式是____ __。 (2)(2分)NO2可用水吸收,相应的化学反应方程式为: __ ____。 (3)(2分)NO也可直接用活性铁粉转化为N2。 已知:N2(g)+O2(g)=2NO(g)△H1 4Fe(s)+3O2(g)=2Fe2O3(s)△H2 则6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g)△H=__ ____(用“△H1”、“△H2”表示)。 (4)(2分)对于反应N2(g)+O2(g)2NO(g),在恒温恒容条件下,向密闭容器中加入等物质的N2和O2.下列方法中可以说明可逆反应已达平衡状态的是___ ___。 a.容器内压强不再变化 b.混合气体密度不再变化 c.混合气体的平均相对分子质量不再变化 d.NO的质量分数不再变化 (5)(4分)用氨气作原料可制备重要燃料--肼(N2H4)。 ①通常在催化剂存在下,用次氯酸钠与氨反应可制备肼。该反应的化学方程式是____ __。 ②如图为肼燃料电池示意图,其负极的电极反应式是: ___ ___。 (6)(2分)SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下: 则NaHSO3与 Cr2O72-反应时,物质的量之比为__________。 17、(15分)氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下: (1)(1分)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。 (2)(6分)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O28Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为 ,每产生32 g Fe2O3,转移电子的数目为 。该步骤不能使用陶瓷容器,原因是 。 (3)(2分)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作: _________ (4)(4分)操作I,硫磺在与铬酸钠的反应中转化为硫代硫酸钠(Na2S2O3),反应的离子方程式为 。滤渣中除Al(OH)3外还有__________(填化学式)。 (5)(2分)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为 ,才能使铬离子沉淀完全。(已知溶液中离子浓度小于1.0×10-5mol/L 认为沉淀完全,Cr(OH)3的溶度积常数为1.0×10-32。) 18、(共15分)氮及其氮族元素形成许多种物质。 (1)(2分)基态P原子中,电子占据的最高能级符号为______,基态N原子核外有______种运动状态不同的电子。 (2)(3分)HCN的结构式为____ __;其中心C原子的杂化类型为____ __。氮、磷、氢三种元素的电负性由大到小的顺序为 (用元素符号表示)。 (3)(2分)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为 。 (4)(8分)已知TiN、KC1、MgO、CaO这四种晶体的结构与NaCl晶体结构相似。 ①下表给出了三种晶体的晶格能数据, 晶体 NaCl KCl CaO 晶格能(kJ•mol-1) 786 715 3401 根据数据判断,该四种晶体TiN、KC1、MgO、CaO的熔点从高到低的顺序 为 。 ②TiN晶体中一个Ti3+最近的N3-围成的几何体是 ;一个Ti3+最近的Ti3+是______个。 ③若TiN晶体的密度是ρg•cm-3,则晶胞内最近的两个钛离子间的距离为 cm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA)。 化学试卷 选择题答案((共14小题。每小题3分,共42分) 题号 1 2 3 4 5 6 7 8 9 10 答案 B A D C D C D C D B 题号 11 12 13 14 答案 B B D D查看更多