- 2021-08-23 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习 离子反应 课件(20张)(全国通用)
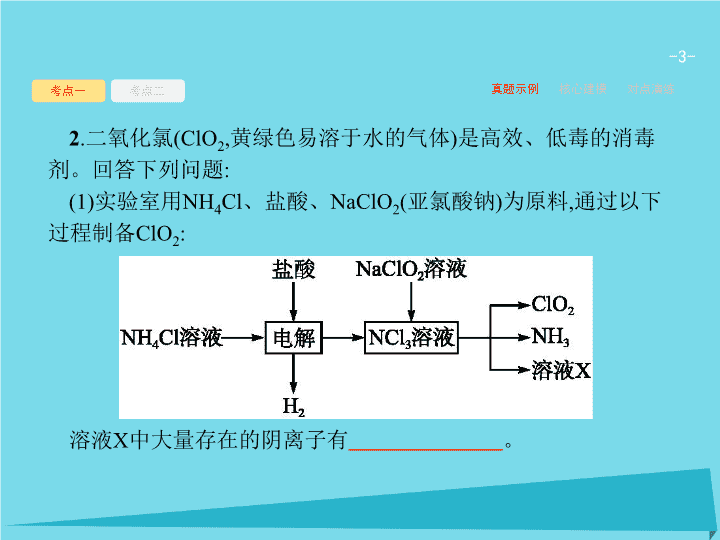
第 2 讲 离子反应 - 2 - 考点一 考点二 真题示例 核心建模 对点演练 考点一 离子方程式的书写及判断 1 . 酸性锌锰干电池是一种一次性电池 , 外壳为金属锌 , 中间是石墨棒 , 其周围是由碳粉、 MnO 2 、 ZnCl 2 和 NH 4 Cl 等组成的糊状填充物。该电池放电过程产生 MnOOH 。电池反应的离子方程式为 。 Zn+2MnO 2 +2H + ==Zn 2+ +2MnOOH 解析 : 该电池的正极发生还原反应 ,MnO 2 被还原生成 MnOOH ; 负极锌被氧化生成 Zn 2+ , 电池总反应式为 Zn+2MnO 2 +2H + ==Zn 2+ +2MnOOH 。 - 3 - 考点一 考点二 真题示例 核心建模 对点演练 2 . 二氧化氯 (ClO 2 , 黄绿色易溶于水的气体 ) 是高效、低毒的消毒剂。回答下列问题 : (1) 实验室用 NH 4 Cl 、盐酸、 NaClO 2 ( 亚氯酸钠 ) 为原料 , 通过以下过程制备 ClO 2 : 溶液 X 中大量存在的阴离子有 。 - 4 - 考点一 考点二 真题示例 核心建模 对点演练 (2) 用右图装置可以测定混合气中 ClO 2 的含量 : Ⅰ . 在锥形瓶中加入足量的碘化钾 , 用 50 mL 水溶解后 , 再加入 3 mL 稀硫酸 ; Ⅱ . 在玻璃液封装置中加入水 , 使液面没过玻璃液封管的管口 ; Ⅲ . 将一定量的混合气体通入锥形瓶中吸收 ; Ⅳ . 将玻璃液封装置中的水倒入锥形瓶中 ; Ⅴ . 用 0.100 0 mol·L -1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液 ( ), 指示剂显示终点时共用去 20.00 mL 硫代硫酸钠溶液。在此过程中 : 锥形瓶内 ClO 2 与碘化钾反应的离子方程式为 。 - 5 - 考点一 考点二 真题示例 核心建模 对点演练 答案 : (1) ② Cl - 、 OH - (2)2ClO 2 +10I - +8H + ==5I 2 +4H 2 O+2Cl - 解析 : (1) ② 在 NCl 3 溶液中加入 NaClO 2 , 可生成 ClO 2 、 NH 3 和 X, 发生反应为 NCl 3 +6NaClO 2 +3H 2 O==6ClO 2 +NH 3 +3NaOH+3NaCl, 溶液 X 中大量存在的阴离子有 Cl - 、 OH - 。 (2) 由题目信息可知 ,ClO 2 通入锥形瓶与酸性碘化钾溶液反应 , 氧化 I - 为 I 2 , 自身被还原为 Cl - , 同时生成水 , 反应离子方程式为 2ClO 2 +10I - +8H + ==5I 2 +4H 2 O+2Cl - 。 - 6 - 考点一 考点二 真题示例 核心建模 对点演练 1 . 离子方程式书写的基本规律要求 (1) 合事实 : 离子反应要符合客观事实 , 不可臆造产物及反应。 (2) 式正确 : 化学式与离子符号书写正确合理。 (3) 号实际 :“==”“↑”“↓” 等符号符合实际。 (4) 三守恒 : 两边各元素原子数、电荷数必须守恒 , 氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等。 (5) 明类型 : 依据离子反应原理 , 分清类型 , 总结方法技巧。 (6) 细检查 : 结合书写离子方程式过程中易出现的错误 , 细心检查。 - 7 - 2 . 正确书写、判断离子方程式的四个关键点 考点一 考点二 真题示例 核心建模 对点演练 - 8 - 考点一 考点二 真题示例 核心建模 对点演练 方法技巧 “ 少定多变 ” 法突破酸式盐与碱反应离子方程式的书写、判断 (1)“ 少定 ” 就是把相对量较少的物质定为 “1 mol”, 若少量物质有两种或两种以上离子参加反应 , 则参加反应的离子的物质的量之比与原物质组成比相符。 (2)“ 多变 ” 就是过量的反应物 , 其离子的化学计量数根据反应实际需求量来确定 , 不受化学式中的比例制约 , 是可变的。如少量 NaHCO 3 与足量 Ca(OH) 2 溶液的反应 : - 9 - 考点一 考点二 真题示例 核心建模 对点演练 D 解析 : H 2 S 是弱酸 , 不能拆开 ,A 错误。三价铁离子能氧化碘离子 ,B 错误。应该析出碳酸氢钠沉淀 ,C 错误。加入过量的 Ba(OH) 2 溶液 , 铝离子生成偏铝酸根离子 ,D 正确。 - 10 - 考点一 考点二 真题示例 核心建模 对点演练 B - 11 - 真题示例 核心建模 对点演练 考点一 考点二 考点二 离子的共存、检验与推断 1 .(2016 课标全国 Ⅱ ,12) 某白色粉末由两种物质组成 , 为鉴别其成分进行如下实验 : ① 取少量样品加入足量水仍有部分固体未溶解 ; 再加入足量稀盐酸 , 有气泡产生 , 固体全部溶解 ; ② 取少量样品加入足量稀硫酸有气泡产生 , 振荡后仍有固体存在。 该白色粉末可能为 ( ) A.NaHCO 3 、 Al(OH) 3 B.AgCl 、 NaHCO 3 C.Na 2 SO 3 、 BaCO 3 D.Na 2 CO 3 、 CuSO 4 C - 12 - 真题示例 核心建模 对点演练 考点一 考点二 解析 : NaHCO 3 可溶 ,Al(OH) 3 不溶 , 加足量稀盐酸时 ,NaHCO 3 与盐酸反应放出 CO 2 气体 , 而 Al(OH) 3 完全溶解。向样品中加入足量稀硫酸时 , 有气泡产生 , 且固体全部溶解 , 不符合实验 ② ,A 项不符合题意。 AgCl 不溶于盐酸 , 不符合实验 ① ,B 项不符合题意。 C 项中两物质符合实验 ① 现象 , 加入足量水后有固体物质 (BaCO 3 不溶 ), 再加入稀盐酸 , 产生 SO 2 和 CO 2 气体 , 固体全部溶解 ; 也符合实验 ② 现象 , 加入足量稀硫酸产生 SO 2 气体 , 并生成 BaSO 4 沉淀 ,C 项符合题意。 D 项中两物质符合实验 ① 现象 , 加入足量水后的固体物质为 CuCO 3 , 再加入稀盐酸 , 产生 CO 2 气体 , 固体全部溶解 ; 但不符合实验 ② 的现象 , 加足量稀硫酸振荡后无固体存在 ,D 项不符合题意。 - 13 - 真题示例 核心建模 对点演练 考点一 考点二 × × × - 14 - 真题示例 核心建模 对点演练 考点一 考点二 - 15 - 真题示例 核心建模 对点演练 考点一 考点二 - 16 - 真题示例 核心建模 对点演练 考点一 考点二 2 . 解答离子推断题的原则 (2) 互斥性原则 : 在肯定某些离子存在的同时 , 结合离子共存规律 , 否定一些离子的存在 ( 要注意题目中的隐含条件 , 如 : 酸性、碱性、指示剂的颜色变化、与铝反应产生 H 2 、水的电离情况等 ) 。 (3) 电中性原则 : 溶液呈电中性 , 一定既有阳离子 , 又有阴离子 , 且溶液中正电荷总数与负电荷总数相等 ( 这一原则可帮助我们确定一些隐含的离子 ) 。 (4) 进出性原则 : 通常是在实验过程中使用 , 是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。 - 17 - 真题示例 核心建模 对点演练 考点一 考点二 方法技巧 离子推断常见解题思路 离子推断题将离子共存、离子检验设定在一个可能的离子组中 , 要求通过多重推断 , 确定某些离子肯定存在 , 某些离子肯定不存在 , 某些离子不能确定是否存在 , 有的最后还设置一个探究问题或者一个计算题。其一般解题思路如下所示 : 根据实验操作和反应现象 , 判断一定含有的离子 → 根据能否大量共存 , 判断一定不含有的离子 → 根据电荷守恒 , 判断还含有的离子或可能含有的离子 - 18 - 考点一 考点二 真题示例 核心建模 对点演练 C - 19 - 考点一 考点二 真题示例 核心建模 对点演练 D 解析 : 二氧化碳与硅酸根离子反应生成硅酸沉淀 , 与碳酸根离子反应生成碳酸氢根离子 , 不能大量共存 ,A 错误。高锰酸根离子有颜色 ,B 错误。酸性溶液中 ClO - 、 I - 不能大量共存 ,C 错误。溶液为酸性 , 四种离子均不反应 ,D 正确。 - 20 - 考点一 考点二 真题示例 核心建模 对点演练 答案 解析 解析 关闭 答案 解析 关闭查看更多