- 2021-08-23 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】山西省运城市2019-2020学年高二上学期期末调研测试试题
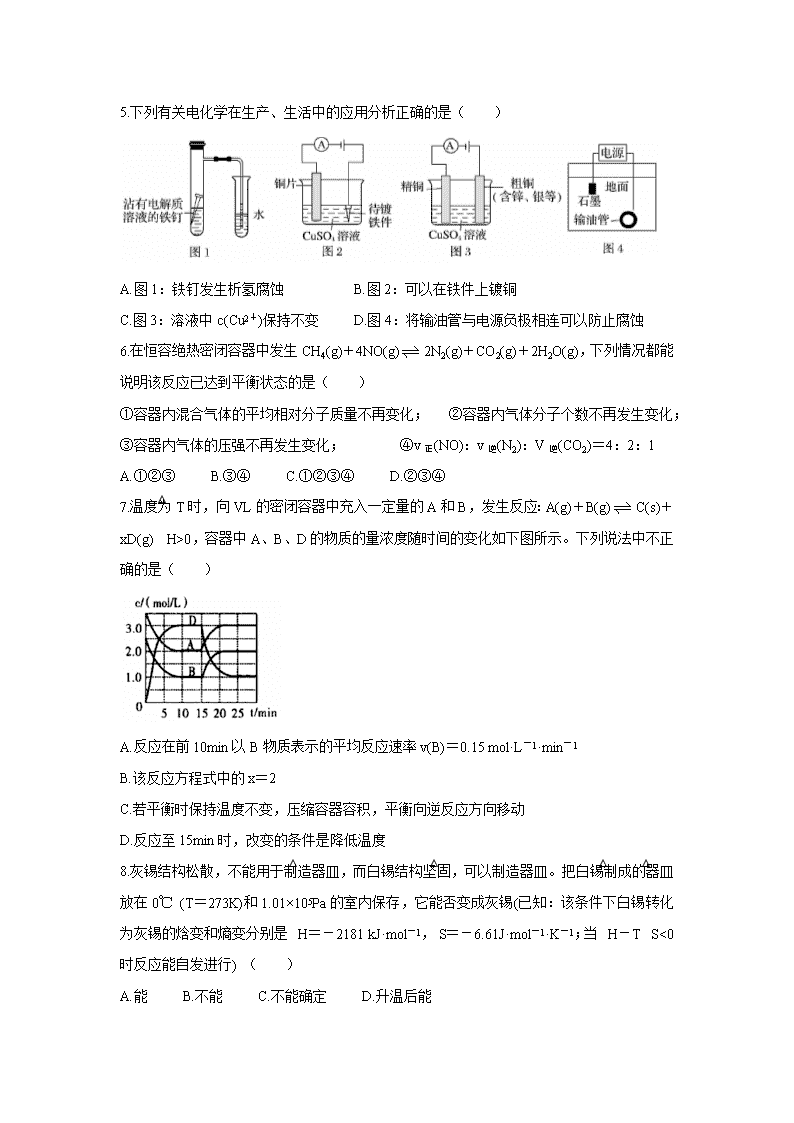
山西省运城市2019-2020学年高二上学期期末调研测试试题 本试题满分100分,考试时间90分钟。答案一律写在答题卡上。 注意事项 1.答题前,考生务必先将自己的姓名、准考证号填写在答题卡上,认真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡的指定位置上。 2.答题时使用0.5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚 3.请按照题号在各题的答题区域(黑色线框)内作答,超出答题区域书写的答案无效。 4.保持卡面清洁,不折叠,不破损。 可能用到的相对原子质量:H1 O16 Na23 S32 Cl35.5 K39 Cr52 Fe56 Cu64 Ag108 第I卷(选择题 共54分) 一、选择题(本题包括18个小题,每小题3分,共54分;每小题只有一个选项符合题意) 1.“建设大美运城”要求人们出行和化工生产做到“绿色、低碳”。下列做法不可取的是( ) A.推广共享公共工具 B.大力开发化石能源 C.推广使用新型能源 D.推广使用电子货币 2.下列属于水解的离子方程式且书写正确的是( ) A.HCO3-+H2OH3O++CO32- B.Fe3++3H2OFe(OH)3↓+3H+ C.SO32-+2H2OH2SO3+2OH- D.CH3COO-+H2OCH3COOH+OH- 3.下列说法正确的是( ) A.用NaOH溶液调节pH除去NH4Cl溶液中的FeCl3 B.洗涤油污常用热的碳酸钠溶液 C.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 D.将AlCl3溶液和Na2SO3溶液分别加热蒸干、灼烧后,所得固体为Al2O3和Na2SO3 4.下列关于热化学反应的描述中正确的是( ) A.HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol B.碳与二氧化碳的反应既是吸热反应,又是化合反应. C.热化学方程式中化学计量数可表示分子个数 D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 5.下列有关电化学在生产、生活中的应用分析正确的是( ) A.图1:铁钉发生析氢腐蚀 B.图2:可以在铁件上镀铜 C.图3:溶液中c(Cu2+)保持不变 D.图4:将输油管与电源负极相连可以防止腐蚀 6.在恒容绝热密闭容器中发生CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( ) ①容器内混合气体的平均相对分子质量不再变化; ②容器内气体分子个数不再发生变化; ③容器内气体的压强不再发生变化; ④v正(NO):v逆(N2):V逆(CO2)=4:2:1 A.①②③ B.③④ C.①②③④ D.②③④ 7.温度为T时,向VL的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示。下列说法中不正确的是( ) A.反应在前10min以B物质表示的平均反应速率v(B)=0.15 mol·L-1·min-1 B.该反应方程式中的x=2 C.若平衡时保持温度不变,压缩容器容积,平衡向逆反应方向移动 D.反应至15min时,改变的条件是降低温度 8.灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。把白锡制成的器皿放在0℃ (T=273K)和1.01×105Pa的室内保存,它能否变成灰锡(已知:该条件下白锡转化为灰锡的焓变和熵变分别是△H=-2181 kJ·mol-1,△S=-6.61J·mol-1·K-1;当△H-T△S<0时反应能自发进行) ( ) A.能 B.不能 C.不能确定 D.升温后能 9.在一定体积的密闭容器中,进行如下化学反应:2X(g)+Y(s)Z(g)+W(g),若其化学平衡常数K和温度t的关系如下表 下列叙述不正确的是( ) A..上述反应的正反应是吸热反应 B.该反应的化学平衡常数表达式为K= C.若在1L的密闭容器中通入X和Y各0.3mol,5min后温度升高到800℃,此时测得X为0.1mol,该反应达到平衡状态 D.混合气体的密度保持不变可作为该反应达到平衡的标志之一 10.下列事实不能证明HNO2是弱电解质的是( ) ①滴入酚酞,NaNO2溶液显红色 ②用HNO2溶液做导电实验,灯泡很暗 ③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强 ④0.1 mol·L-1 HNO2溶液的pH=2 ⑤HNO2与CaCO3反应放出CO2气体 ⑥e(H+)=0.1 mol·L-1的HNO2溶液稀释至1000倍,pH<4 A.②⑤ B.①⑤ C.③⑥ D.③④ 11.已知:2H2O(l)=2H2(g)+O2(g) △H=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下: 过程I:2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2 kJ/mol 过程II:…… 下列说法不正确的是( ) A.过程I中每消耗232gFe3O4转移2mol电子: B.过程II热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9 kJ/mol C.过程I、II中能量转化的形式依次是:太阳能→化学能→热能 D.过程I中正反应的活化能大于逆反应的活化能 12.碱性联氨燃料电池具有能量密度较高和无污染等特点,其工作原理如下图所示,下列说法不正确的是( ) A.负极反应:N2H4-4e-=4H++N2↑ B.通入氧气的电极为正极 C.电池工作时OH-向负极移动 D.该电池工作一段时间后,电解质溶液碱性不变(不考虑电解质溶液的体积变化) 13.草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( ) A.V(NaOH)=0时,c(H+)>1×10-7mol/L B.V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) C.V(NaOH)=10mL时,溶液的pH为9,则10-9=10-5-2c(H2C2O4)-c(HC2O4-) D.V(NaOH)>10mL时,可能存在c(OH-)>c(Na+)>c(C2O42-) 14.根据相应的图象(图象编号与选项一一对应),判断下列相关说法正确的是( ) A.t0时改变某一条件后如图所示,则改变的条件一定是加入催化剂 B.反应达到平衡时,外界条件对平衡的影响如图所示,则正反应为放热反应 C.从加入反应物开始,物质的百分含量与温度的关系如图所示,则该反应的正反应为放热反应 D.反应速率随反应条件的变化如图所示,则该反应的正反应为放热反应,A、B、C一定均为气体,D为固体或液体 15.下列溶液中有关物质的量浓度关系不正确的是( ) A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)查看更多