- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
云南省曲靖市会泽县茚旺高级中学2020届高三上学期11月月考化学试卷
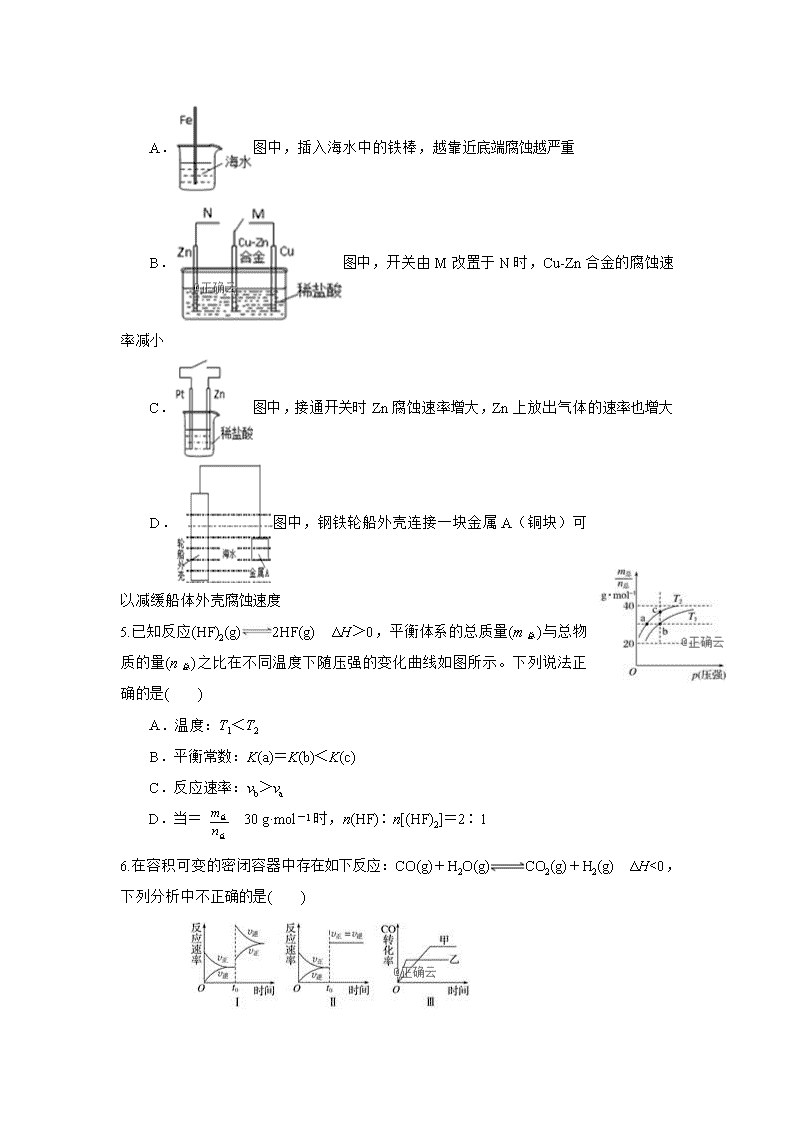
高三化学半月考试卷 一.单选题(共16小题,每小题3.0分,共48分) 1.《中华人民共和国旅游法》经2013年4月25日十二届全国人大常委会第2次会议通过。旅游在现代更成为一种时尚。“即食即热型快餐”适用于外出旅行时使用。其内层是用铝箔包裹的并加工好的真空包装食品,外层则是分别包装的两包化学物质。使用时拉动预留在外的拉线使这两种化学物质反应,放出的热量便可对食品进行加热,这两种化学物质最合适的选择是 ( ) A.浓硫酸和水 B.生石灰和水 C.熟石灰和水 D.氯化钠和水 2.已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ/mol 2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ/mol则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH的( ) A.+519.4 kJ/mol B.+259.7 kJ/mol C.-259.7 kJ/mol D.-519.4 kJ/mol 3.在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄露入潮湿的土壤中,并与金属管道或铁轨形成回路时.就会引起后者的腐蚀.原理简化如图所示.则下列有关说法不正确的是( ) A.原理图可理解为两个串联电解装置 B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 C.溶液中铁丝左端电极反应式为:Fe﹣2e﹣═Fe2+ D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) 4.下列与金属腐蚀有关的说法正确的是( ) A.图中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 C.图中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 D.图中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度 5.已知反应(HF)2(g)2HF(g) ΔH>0,平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( ) A.温度:T1<T2 B.平衡常数:K(a)=K(b)<K(c) C.反应速率:vb>va D.当=30 g·mol-1时,n(HF)∶n[(HF)2]=2∶1 6.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( ) A. 图Ⅰ研究的是t0时升高温度对反应速率的影响 B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响 C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 7.恒温恒容条件下,发生化学反应H2(g)+I2(g)2HI(g),下列选项中不能作为达到平衡的标志的是( ) A.混合气体颜色不再变化 B.单位时间内生成nmol氢气的同时生成nmol碘蒸气 C.若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化 D.2v(H2)正=v(HI)逆 8.在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)⇌2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( ) A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03 C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5% 9.NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( ) A.NO2在石墨I附近发生氧化反应 B.该电池放电时NO3﹣向石墨I电极迁移 C.石墨Ⅱ附近发生的反应:O2+4e﹣+2N2O5=4 NO3﹣ D.相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 10.白磷与氧可发生如下反应:P4+5O2==P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 A.(4a+5d-4c-12b) kJ·mol-1 B.(4c+12b-4a-5d)kJ·mol-1 C.(4c+12b-6a-5d) kJ·mol-1 D.(6a+5d-4c-12b) kJ·mol-1 11.下列有关电化学原理的说法正确的是( ) A. 电解法冶炼铝时,阳极反应为:2O2 —— 4e— =O2↑ B.用电解法精炼铜,阳极反应为:Cu2++2e— =Cu C.钢铁在中性条件下被腐蚀,正极反应为:2H2O+2e— =H2↑+2OH— D.铝﹣空气燃料电池以KOH为电解液时,负极反应为:Al﹣3e﹣=Al3+ 12.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) +2B(g)xC(g) ΔH=-192 kJ•mol —1,向M、N中都通入1 mol A和2 mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( ) A. 若x=3,达到平衡后A的体积分数关系为φ(M)>φ(N) B. 若x>3,达到平衡后B的转化率关系为α(M)>α(N) C. 若x<3,C的平衡浓度关系为c(M)>c(N) D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 13.一定条件下存在反应:H2(g)+ I2(g)2HI(g) ΔH<0,现有三个相同的体积均为1 L 的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 mol HI(g),在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( ) A.容器Ⅰ、Ⅱ中正反应速率相同 B.容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数 C.容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色浅 D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 14.据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是 ( ) A.电池放电时Na+从b极区移向a极区 B.电极b采用MnO2,MnO2既作电极材料又有催化作用 C.每消耗1 mol H2O2,转移的电子为1 mol D.该电池的正极反应为+8OH--8e-===+6H2O 15.下图是关于反应A2(g)+B2(g)2C(g)+D(g) ΔH<0的平衡移动图像,影响平衡移动的原因可能是( ) A. 升高温度,同时加压 B. 压强不变,降低温度 C. 压强、温度不变,充入一些与之不反应的惰性气体 D. 温度 、压强不变,充入一些A2(g) 16.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1) 下列说法正确的是( ) A. 2c1>c3 B.a+b=92.4 C. 2p1查看更多