- 2021-08-23 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省自贡市富顺县第二中学2019-2020学年高二上学期期中考试化学试卷
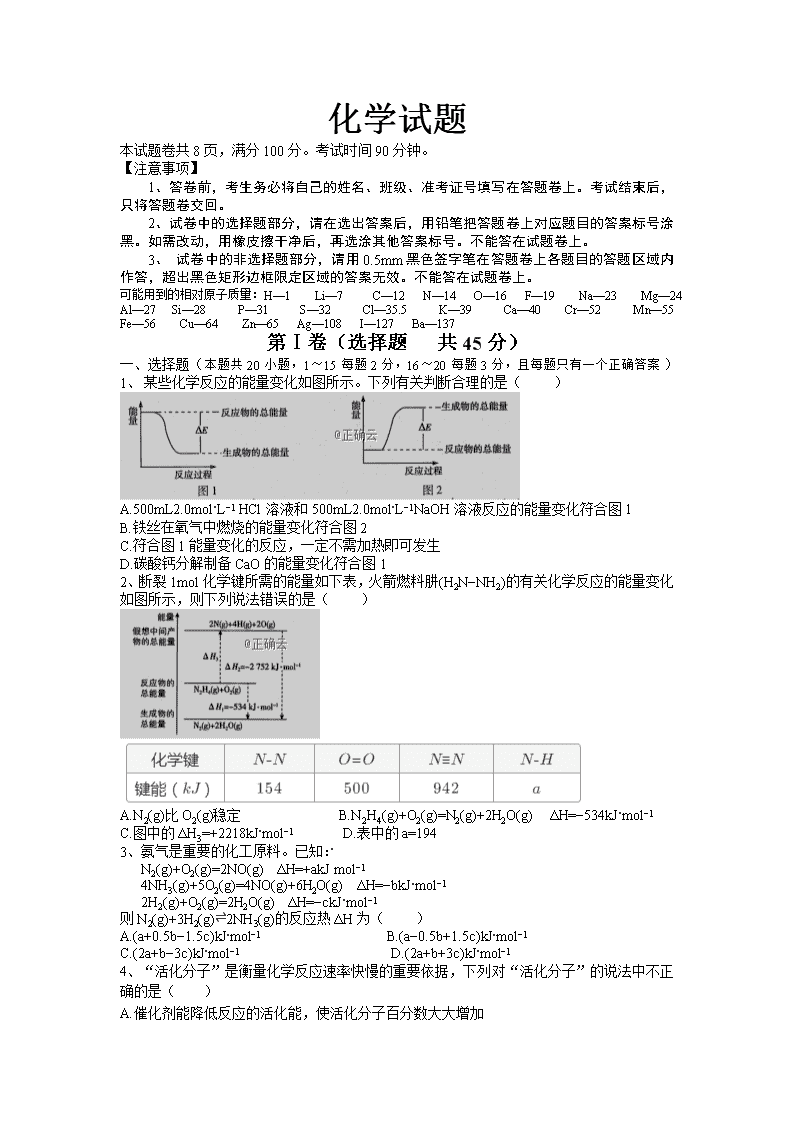
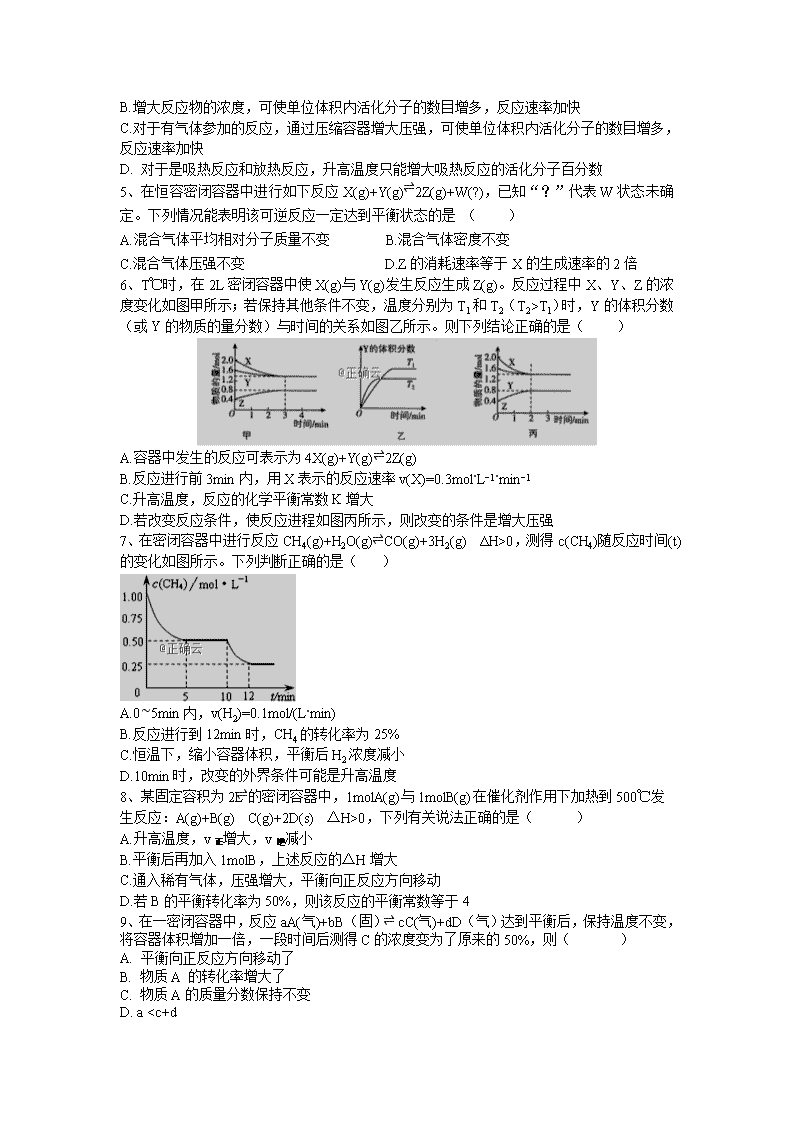
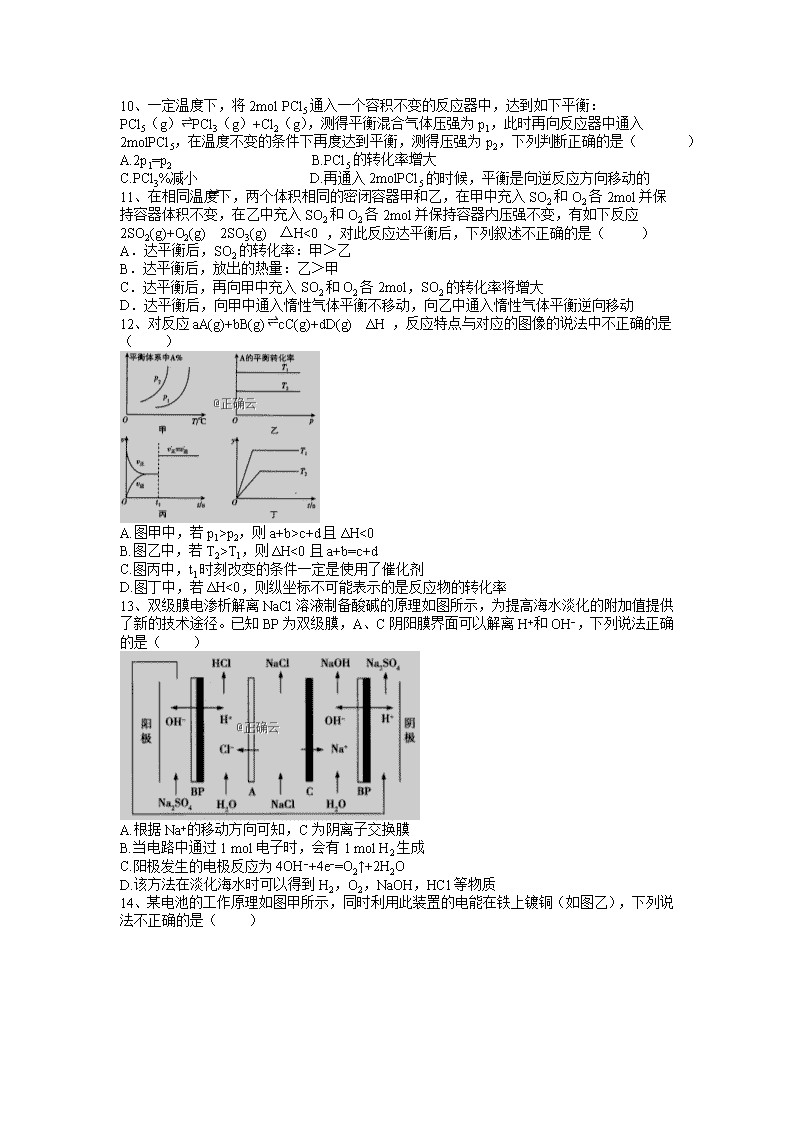
化学试题 本试题卷共8页,满分100分。考试时间90分钟。 【注意事项】 1、答卷前,考生务必将自己的姓名、班级、准考证号填写在答题卷上。考试结束后,只将答题卷交回。 2、试卷中的选择题部分,请在选出答案后,用铅笔把答题卷上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试题卷上。 3、 试卷中的非选择题部分,请用0.5mm黑色签字笔在答题卷上各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效。不能答在试题卷上。 可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 F—19 Na—23 Mg—24 Al—27 Si—28 P—31 S—32 Cl—35.5 K—39 Ca—40 Cr—52 Mn—55 Fe—56 Cu—64 Zn—65 Ag—108 I—127 Ba—137 第Ⅰ卷(选择题 共45分) 一、选择题(本题共20小题,1~15每题2分,16~20每题3分,且每题只有一个正确答案) 1、 某些化学反应的能量变化如图所示。下列有关判断合理的是( ) A.500mL2.0mol⋅L−1 HCl溶液和500mL2.0mol⋅L−1NaOH溶液反应的能量变化符合图1 B.铁丝在氧气中燃烧的能量变化符合图2 C.符合图1能量变化的反应,一定不需加热即可发生 D.碳酸钙分解制备CaO的能量变化符合图1 2、断裂1mol化学键所需的能量如下表,火箭燃料肼(H2N−NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( ) A.N2(g)比O2(g)稳定 B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=−534kJ⋅mol−1 C.图中的ΔH3=+2218kJ⋅mol−1 D.表中的a=194 3、氨气是重要的化工原料。已知: N2(g)+O2(g)=2NO(g) ΔH=+akJ⋅mol−1 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=−bkJ⋅mol−1 2H2(g)+O2(g)=2H2O(g) ΔH=−ckJ⋅mol−1 则N2(g)+3H2(g)⇌2NH3(g)的反应热ΔH为( ) A.(a+0.5b−1.5c)kJ⋅mol−1 B.(a−0.5b+1.5c)kJ⋅mol−1 C.(2a+b−3c)kJ⋅mol−1 D.(2a+b+3c)kJ⋅mol−1 4、“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( ) A.催化剂能降低反应的活化能,使活化分子百分数大大增加 B.增大反应物的浓度,可使单位体积内活化分子的数目增多,反应速率加快 C.对于有气体参加的反应,通过压缩容器增大压强,可使单位体积内活化分子的数目增多,反应速率加快 D. 对于是吸热反应和放热反应,升高温度只能增大吸热反应的活化分子百分数 5、在恒容密闭容器中进行如下反应X(g)+Y(g)⇌2Z(g)+W(?),已知“?”代表W状态未确定。下列情况能表明该可逆反应一定达到平衡状态的是 ( ) A.混合气体平均相对分子质量不变 B.混合气体密度不变 C.混合气体压强不变 D.Z的消耗速率等于X的生成速率的2倍 6、T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图乙所示。则下列结论正确的是( ) A.容器中发生的反应可表示为4X(g)+Y(g)⇌2Z(g) B.反应进行前3min内,用X表示的反应速率v(X)=0.3mol⋅L−1⋅min−1 C.升高温度,反应的化学平衡常数K增大 D.若改变反应条件,使反应进程如图丙所示,则改变的条件是增大压强 7、在密闭容器中进行反应CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( ) A.0∼5min内,v(H2)=0.1mol/(L⋅min) B.反应进行到12min时,CH4的转化率为25% C.恒温下,缩小容器体积,平衡后H2浓度减小 D.10min时,改变的外界条件可能是升高温度 8、某固定容积为2L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发 生反应:A(g)+B(g)⇌C(g)+2D(s) △H>0,下列有关说法正确的是( ) A.升高温度,v正增大,v逆减小 B.平衡后再加入1molB,上述反应的△H增大 C.通入稀有气体,压强增大,平衡向正反应方向移动 D.若B的平衡转化率为50%,则该反应的平衡常数等于4 9、在一密闭容器中,反应aA(气)+bB(固)⇌ cC(气)+dD(气)达到平衡后,保持温度不变,将容器体积增加一倍,一段时间后测得C的浓度变为了原来的50%,则( ) A. 平衡向正反应方向移动了 B. 物质A 的转化率增大了 C. 物质A的质量分数保持不变 D. a查看更多