2020年普通高等学校招生统一考试化学模拟卷7
2020年普通高等学校招生统一考试
化学卷(七)
(分值:100分,建议用时:90分钟)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 I 127 Na 23 Cu 64
一、选择题(本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生活、社会发展息息相关。下列说法错误的是 ( )
A.用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法,可提高空气质量
B.“山东疫苗案”涉及的疫苗因未冷藏储运而失效,这与蛋白质变性有关
C.2018年11月福建东港石化“碳九”泄露事件引发社会关注。“碳九”通常是指一系列含9个碳原子的碳氢化合物
D.有人称“一带一路”是“现代丝绸之路”。丝绸的主要成分是纤维素,属于天然高分子化合物
D [丝绸的主要成分是蛋白质,属于天然高分子化合物,D错误。]
2.(2019·江西名校模拟)短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是( )
A.X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B.Y、Q形成的化合物是强电解质
C.电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
D.W、X、Q三种元素都能形成多种氧化物
C [短周期W、X、Y、Z、Q五种元素的原子序数依次递增,已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,则W是C元素,Q是Cl元素;W和Z位于同一主族,则Z是Si元素;Y、Q形成一种共价化合物,Y的原子序数比Si小。
则Y只能是Al元素;X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E,则X是Na,2NaOH+H2O+Si===Na2SiO3+2H2↑,E是H2,据此解答。]
3.(2019·安阳模拟)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 L 0.5 mol·L-1葡萄糖溶液中O—H键数目为2.5NA
B.5.6 g铁与硝酸完全反应时转移的电子数目可能为0.25NA
C.0.1 mol苯与足量氢气反应后,破坏碳碳双键的数目为0.3NA
D.10 g KHCO3和CaCO3的固体混合物中含有的CO数目为0.1NA
B [1个葡萄糖分子中有5个O—H键,但水分中也含有O—H键,A错误;5.6 g铁与硝酸完全反应时产物可能完全为Fe2+,则转移的电子数为0.2 mol;若产物完全为Fe3+,则转移的电子数为0.3 mol,故实际转移的数目可能为0.25NA,B正确;苯分中不存在碳碳双键,C错误; KHCO3固体中含有K+和HCO,没有CO,D错误。]
4.四个课外活动小组为完成实验目的,均设计了两套实验装置(部分图中的夹持装置略去),其中一个活动小组设计的两套装置中,有一套装置存在原理错误,该活动小组是( )
A.锌粒和稀硫酸制取氢气
B.向下排空气法收集甲烷
C.制取氨气的发生装置
D.氯化氢气体的喷泉实验
C [CaO与浓氨水作用可产生NH3,属于固体+液体→气体,前一套装置可以,NH4Cl受热分解成NH3和HCl,NH3和HCl在试管口会重新化合成NH4Cl,NH4Cl直接受热分解不能制得NH3,后一套装置原理错误不能制得NH3,C符合题意。]
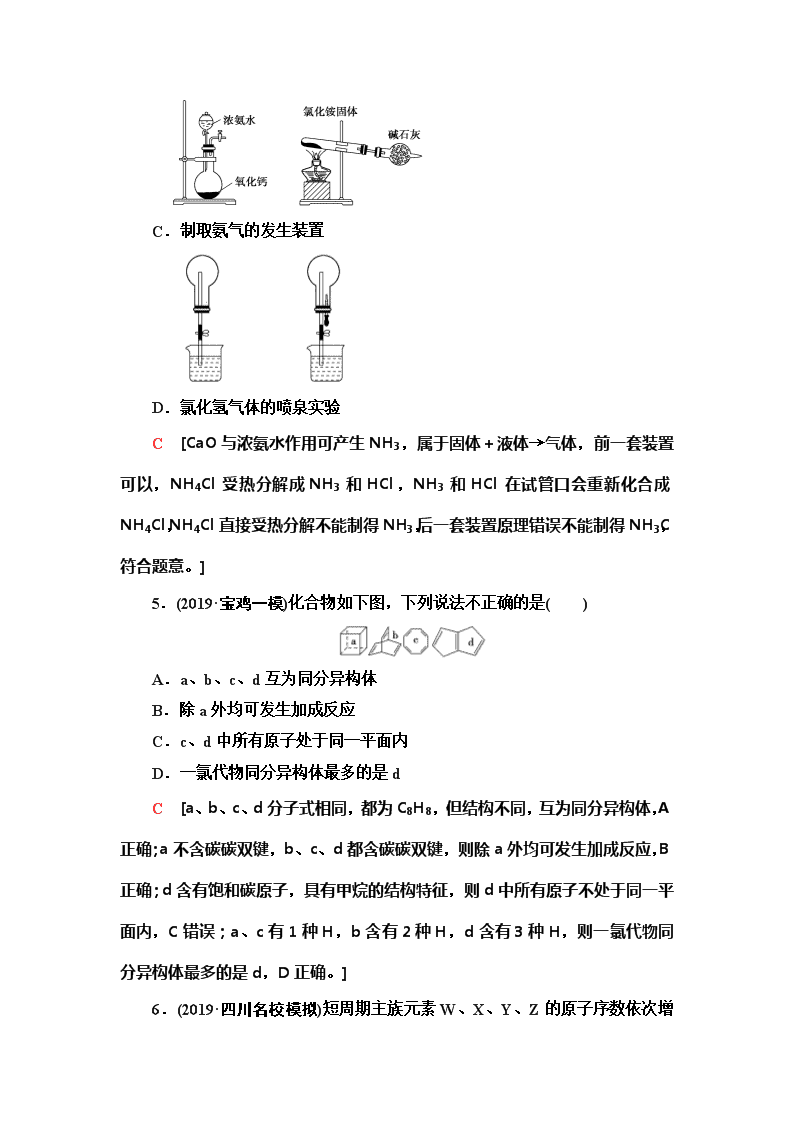
5.(2019·宝鸡一模)化合物如下图,下列说法不正确的是( )
A.a、b、c、d互为同分异构体
B.除a外均可发生加成反应
C.c、d中所有原子处于同一平面内
D.一氯代物同分异构体最多的是d
C [a、b、c、d分子式相同,都为C8H8,但结构不同,互为同分异构体,A正确;a不含碳碳双键,b、c、d都含碳碳双键,则除a外均可发生加成反应,B正确;d含有饱和碳原子,具有甲烷的结构特征,则d中所有原子不处于同一平面内,C错误;a、c有1种H,b含有2种H,d含有3种H,则一氯代物同分异构体最多的是d,D正确。]
6.(2019·四川名校模拟)短周期主族元素W、X、Y、Z的原子序数依次增加,X的质子数是W与Z的质子数之和的一半。m、n、p是由这些元素组成的二元化合物,r是元素Y的气体单质,n为淡黄色粉末,相关物质转化关系如图所示。室温下,0.01 mol·L-1 s溶液pH为12。下列说法正确的是 ( )
A.原子半径大小:W
c(B-)
B.水的电离程度:b=c>a
C.溶液中离子总物质的量:b>c>a
D.溶液中离子总浓度:a>b>c
[答案] B
10.海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
下列关于该流程中各步骤的说法中,错误的是( )
选项
步骤
采用装置
主要仪器
A
①
过滤装置
漏斗
B
②
分液装置
分液漏斗
C
③
蒸发装置
坩埚
D
④
蒸馏装置
蒸馏烧瓶
C [由流程可知,步骤①是分离固液混合物,其操作为过滤,需要漏斗、烧杯、玻璃棒等仪器;步骤②是分离互不相溶的液体混合物,操作为分液,
需要分液漏斗等仪器;步骤③是从溶液中得到固体,操作为蒸发,需要蒸发皿等仪器;步骤④是利用有机化合物沸点不同用蒸馏的方法得到甲苯,需要蒸馏烧瓶等仪器。故C错误。]
11.通过电解法分离NaHSO3与Na2SO3混合物,其装置如图。下列说法不正确的是( )
A.阳极的电极反应式为4OH--4e-===2H2O+O2↑
B.阳极区c(H+)增大,H+由a室经阳离子交换膜进入b室
C.外电路每转移0.2 mol电子,有0.2 mol Na+从b室进入c室
D.c室得到Na2SO3的原因是OH-+HSO===H2O+SO
C [通过电解法分离NaHSO3与Na2SO3混合物,根据装置图分析,电解池阳极发生的反应为物质失去电子,发生氧化反应,考虑到溶液是碱性,则阳极处OH-放电产生O2,阳极电极反应为4OH--4e-===2H2O+O2↑,阴极为物质得到电子,发生还原反应,考虑到溶液是碱性,则阴极反应式为2H2O+2e-===2OH-+H2↑, 据此分析判断。]
12.X、Y、Z、W是原子序数依次增大的四种短周期元素,Y元素原子的最外层电子数是内层电子数的2倍,Z是地壳中含量最高的元素,四种元素原子最外层电子数之和为12。A、B、C、D、E是由其中的2种或3种元素组成的化合物,F是由Z元素形成的单质。已知A+B===D+F,A+C===E+F。常温下,0.1 mol·L-1 D溶液的pH为13。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.A、C中所含的化学键类型相同
C.1.0 L 0.1 mol·L-1 E溶液中阴离子总的物质的量为 0.1 mol
D.1 mol A与足量B完全反应共转移1 mol电子
D [X、Y、Z、W是原子序数依次增大的四种短周期元素,Y元素原子的最外层电子数是内层电子数的2倍,Y为C;Z是地壳中含量最高的元素,Z为O;四种元素原子最外层电子数之和为12,则X和W最外层都是1个电子,
则W为Na;A、B、C、D、E是由其中的2种或3种元素组成的化合物,F是由Z元素形成的单质,F为氧气或臭氧;已知A+B===D+F,A+C===E+F,则A为过氧化钠,B、C分别为二氧化碳、水,常温下,0.1 mol D溶液的pH为13,则D为氢氧化钠,X为H,因此B为水,C为二氧化碳,E为碳酸钠。A项,同周期从左到右,原子半径逐渐减小,同主族从上到下,原子半径逐渐增大,因此原子半径:W>Y>Z>X,错误;B项,过氧化钠中含有离子键和非极性键,二氧化碳中只含有极性键,错误;C项,1.0 L 0.1 mol·L-1碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,阴离子总的物质的量大于0.1 mol,错误;D项,过氧化钠与水的反应,过氧化钠既是氧化剂又是还原剂,所以1 mol过氧化钠与足量水完全反应共转移1 mol电子,正确。]
13.(2019·湖南衡阳二联)常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知pKa=-lgKa。下列有关叙述错误的是( )
A.HA、HB两种酸中,HB的酸性弱于HA
B.b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
C.同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D.向HB溶液中加入NaOH溶液所得的混合溶液中=10(pH-pKa)
C [A项,a点lg =0,pH=4,即=1时,pH=4,Ka(HA)=10-4;b点lg =0,pH=5,即Ka(HB)=10-5,HB的酸性弱于HA,故A正确;B项,b点lg =0,=1,根据电荷守恒有c(Na+)+c(H+)=c(OH-)+c(B-),pH=5,则c(H+)>c(OH-),所以c(Na+)c(Na+)>c(H+)>c(OH-),故B正确;C项,
同浓度同体积的NaA和NaB溶液中,阴离子总数NaA大于NaB,故C错误;D项,===10(pH-pKa),故D正确。]
14.(2019·河南中原名校联考)一种电催化合成氨的装置如图所示。该装置工作时,下列说法正确的是( )
A.图中涉及的能量转化方式共有3种
B.两极产生的气体的物质的量之比是1∶1
C.电路中每通过1 mol电子,有1 mol H+迁移至a极
D.b极上发生的主要反应为N2+6H++6e-===2NH3
D [图中涉及的能量转化有太阳能→电能、风能→机械能→电能,电能→化学能等,A项错误;若不考虑H2,O2和NH3的物质的量之比为3∶4,B项错误;H+应向b极迁移,C项错误;b极上发生的反应为N2+6H++6e-===2NH3(主要)、2H++2e-===H2↑(次要),D项正确。]
15.(2019·厦门模拟)NA是阿伏加德罗常数的值。下列关于反应“C+2H2SO4(浓)CO2↑+2SO2↑+2H2O”的说法正确的是( )
A.1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
B.含0.2 mol H2SO4的浓硫酸与足量炭充分反应生成气体分子总数为0.3NA
C.生成SO2 4.48 L(标准状况下)时转移电子数为0.4NA
D.8.8 g CO2中共用电子数目为0.8 g NA
C [1 L pH=2的H2SO4溶液中含有的H+数目为0.01NA,A错误;浓硫酸反应一定时间后,其浓度变小到一定程度就不与炭反应了,故含0.2 mol H2SO4的浓硫酸不能完全反应,无法计算转移电子的数目,B错误;8.8 g CO2
的物质的量为0.2 mol,每个CO2分子中共用电子对为4对,则共用电子对数目为0.8NA,而不是共用电子数,D错误。]
二、非选择题(本题包括5小题,共55分)
16.(11分)(2019·成都模拟)砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:
________________________________________________________________
________________________________________________________________。
步骤Ⅰ:消耗反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:
(2)装置连接的顺序为a→__________(填接口字母顺序);M仪器的名称为__________,其在实验过程中的作用是
________________________________________________________________
________________________________________________________________。
(3)操作步骤为①连接装置并检查装置气密性,②装入药品,________________________________________________________________;
③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2 ,⑤取下D装置,……
步骤④中继续通入N2的目的是
________________________________________________________________
________________________________________________________________。
步骤Ⅱ:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00 mL溶液,取25.00 mL 用0.20 mol·L-1 Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O+I2===S4O+2I-。
(4)Na2S2O3标准液应装在________(填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是
________________________________________________________________
________________________________________________________________。
(5)滴定实验重复四次得到数据如下:
实验
①
②
③
④
消耗的标准液的体积/mL
18.37
20.05
19.95
20.00
①若实验开始时,向D 装置中加入10.00 g土壤样品和10.16 g I2(已知I2过量),则样品土壤中水的含量为________%(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________(填“偏高”“偏低”或“不变”)。
[解析] (2)装置A是制备二氧化硫气体,装置B中的碱石灰可以吸收尾气,并防止外界水蒸气加入装置,应该在整套装置的最后,D装置应该为二氧化硫与样品反应的装置,进入该装置的二氧化硫需要用浓硫酸(E)干燥,C装置为安全瓶,因此装置的顺序为ACEDB,接口顺序为d→e→i→h→g→f→b→(c);根据图示,M为长颈漏斗,在实验过程中,可以起到平衡内外气压,防止压强过大的作用。
(4)Na2S2O3水解显碱性,标准液应装在碱式滴定管中。
(5)①实验开始时,向D装置中加入10.00 g土壤样品和10.16 g I2(已知I2过量),n(I2)==0.04 mol,向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00 mL溶液,取25.00 mL 用0.20 mol·L-1 Na2S2O3标准液滴定剩余碘单质,根据实验数据可知,实验①的误差较大,删除该数值,②③④实验消耗Na2S2O3溶液的平均值= mL =20.00 mL,根据2S2O+I2===S4O+2I-,消耗碘单质物质的量=n(Na2S2O3)×× =×0.020 0 L×0.20 mol·L-1×10=0.02 mol,剩余I2物质的量=0.04 mol-0.02 mol=0.02 mol,即与二氧化硫反应的碘单质物质的量=0.04 mol-0.02 mol=0.02 mol,消耗水为0.04 mol,土壤样品中水的含量=×
100%=7.2%;②若Na2S2O3标准液已部分氧化变质,滴定过程中消耗的硫代硫酸钠溶液体积增大,测定剩余碘单质物质的量增大,则与二氧化硫反应的碘单质减少,反应的水的物质的量减小,计算得到水的含量偏低。
[答案] (1)SO2+I2+2H2O===H2SO4+2HI (2)d→e→i→h→g→f→b→(c) 长颈漏斗 平衡内外气压,防止压强过大 (3)打开弹簧夹,通入氮气 将装置中的SO2全部赶入B装置中吸收 (4)碱式 使所剩余的碘单质均进入滤液,测量结果更准确 (5)①7.2 ②偏低
17.(12分)(2019·淄博二模)用工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质为含Si、Fe3+、Cu、Cd等元素的化合物)为原料,制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:
已知常温下Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=7.4×10-14,Ksp[Fe(OH)3]=1.0×10-38。
(1)“碱浸”过程中PbSO4发生反应的离子方程式为
________________________________________________________________
________________________________________________________________,
气体A的化学式为______________________。
(2)“酸浸”过程中,在常温下应控制pH不低于________________________________________________________________。
(3)“沉降Ⅰ”中发生沉降反应的离子方程式为________________________________________________________________
________________________________________________________________。
(4)滤液D中溶质的主要成分为________。
(5)以1 t含锌元素10%的铅锌废渣制得活性氧化锌113.4 kg,依据以上数据能否计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由:
________________________________________________________________
________________________________________________________________。
(6)常温下NH3·H2O的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=5.6×10-11。该温度下某浓度的(NH4)2CO3溶液中c(NH)/c(NH3·H2O)=18。则溶液pH为________,c(HCO)/c(H2CO3)=________。
[解析] (1)已知:常温下Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=7.4×10-14,所以“碱浸”过程中PbSO4发生反应的离子方程式为PbSO4 (s) + CO(aq)===PbCO3(s)+SO(aq);“酸浸”后产生的气体为二氧化碳,化学式为CO2。
(2)“酸浸”过程中,若pH过低,酸性强,铁与酸反应生成的有关铁的化合物进入滤液中,再加碱时,会出现氢氧化铁沉淀,根据c(Fe3+)=1×10-5 mol·L-1时,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1.0×10-38,c(OH-)=10-11 mol·L-1,c(H+)=10-3 mol·L-1,pH=3,因此要想除去铁离子,在常温下应控制pH不低于3。
(4)由图知滤液B中含有的离子为Zn2+ 、NH、 CO,加硫酸调节溶液的pH=6.0~6.5出现Zn2(OH)2CO3,滤液为(NH4)2SO4。
(5)除去铜、镉的过程中添加了锌粉,最终ZnO中的锌元素不完全来自于铅锌废渣,无法计算铅锌废渣中锌元素的回收率,所以结论为不能。
(6)常温下NH3·H2O的电离常数Kb=1.8×10-5;则NH的水解平衡常数为1×10-14/1.8×10-5,溶液中存在:NH+H2ONH3·H2O+H+ 则c(NH3·H2O)×c(H+)/c(NH)=1×10-14/1.8×10-5,已知:c(NH)/c(NH3·H2O)=18,所以c(H+)=10-8 mol·L-1,则溶液pH为8;溶液中存在HCO+H2O H2CO3+OH-,碳酸的电离常数:Ka1=4.4×10-7,Ka2=5.6×10-11;可知Kh2=c(H2CO3)×c(OH-)/c(HCO)=1×10-14/4.4×10-7,又因为c(OH-)=10-6 mol·L-1,所以c(HCO)/c(H2CO3)=44。
[答案] (1)PbSO4(s)+CO(aq)===PbCO3(s)+SO(aq) CO2 (2)3 (3)2Pb2++2OH-+Cr2O===2PbCrO4↓+H2O (4)(NH4)2SO4 (5)不能,因为除去铜、镉的过程中添加了锌粉,最终ZnO中的锌元素不完全来自铅锌废渣,无法计算铅锌废渣中锌元素的回收率 (6)8 44
18.(10分)(2019·韶关模拟)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g)
ΔH3=-90.77 kJ·mol-1
回答下列问题:
(1)反应Ⅱ的ΔH2=________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是________(填“较低温度”“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃)
500
T
CO2的平衡转化率
60%
40%
①T________500 ℃(填“>”“<”“=”)。
②温度为500 ℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=________;该温度下,反应Ⅰ的平衡常数K=________。
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH-FeO+3H2↑,工作原理如图所示。电解一段时间后,c(OH-)降低的区域在________(填“阴极室”或“阳极室”)。该室发生的电极反应式为___________________________________________________________
________________________________________________________________。
[解析] (1)依据盖斯定律可得:Ⅱ=Ⅰ-Ⅲ,ΔH2=ΔH1-ΔH3=-49.58 kJ·mol-1+90.77 kJ·mol-1=+41.19 kJ·mol-1,反应Ⅱ为反应Ⅰ和反应Ⅲ的差,所以反应Ⅱ的平衡常数为K2=K1/K3。
(2)该反应的ΔS<0、ΔH<0,当较低温度时,反应Ⅲ能够自发进行。
(3)①反应Ⅰ的正反应是放热反应,所以升高温度二氧化碳的转化率减小,则温度越低转化率越大,即T高于500 ℃。
②CO2的变化量为1.5 mol×60%=0.9 mol
CO2(g)+ 3H2(g)CH3OH(g)+H2O(g)
初始量: 1.5 mol 3 mol 0 0
变化量: 0.9 mol 2.7 mol 0.9 mol 0.9 mol
平衡量: 0.6 mol 0.3 mol 0.9 mol 0.9 mol
v(H2)=(2.7 mol÷2 L)÷10 min=0.135 mol·L-1·min-1,K==200。
(4)该装置为电解池,阳极电极材料是Fe,铁在阳极失去电子,阳极的电极反应为Fe-6e-+8OH-===FeO+4H2O,由于阳极消耗了OH-,所以随着电解的进行c(OH-)会逐渐降低。
[答案] (1)+41.19 kJ·mol-1 K1/ K3 (2)较低温度 (3)①> ②0.135 mol·L-1·min-1 200 (4)阳极室 Fe-6e-+8OH-===FeO+4H2O
19.(10分)(2019·泸州模拟)钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式:[Ar]______, Co2+有________个未成对电子。
(2)Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO的中心原子的杂化形式为______, 空间构型为______。大π键可用符号Π表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为Π),则NO中大π键应表示为________。
(3)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是__________________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是_________________________________________
________________________________________________________________。
(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为________,铜原子的半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为________ g/cm3(列出计算式即可)。
[解析] (2)NO中心原子氮原子价层电子对数为=3,故杂化轨道数为3,所以氮原子的杂化方式为sp2杂化,空间构型为V形;NO中参与形成大π键的原子个数为3个,每个原子提供一个单电子,得电子数为1个,所以NO的大π键可以表示为Π。
(4) 由图可知, 距每个Cu最近的Cu有12个,即配位数为12; 晶胞中实际含有的Cu为4个,其质量为4×64 g/NA;已知铜原子的半径为a nm,由图可知,晶胞中面对角线长为4a nm,晶胞的棱长为2a nm,则晶胞的体积为(2a×10-7)3 cm3,所以有(2×10-7)3×ρ=4×64 g/NA,解得ρ= g/cm3。
[答案] (1)3d74s2 3 (2)sp2 V形 Π (3)①Cu
查看更多