- 2021-08-23 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高一化学必修二课件:1_2_1元素周期律第2课时
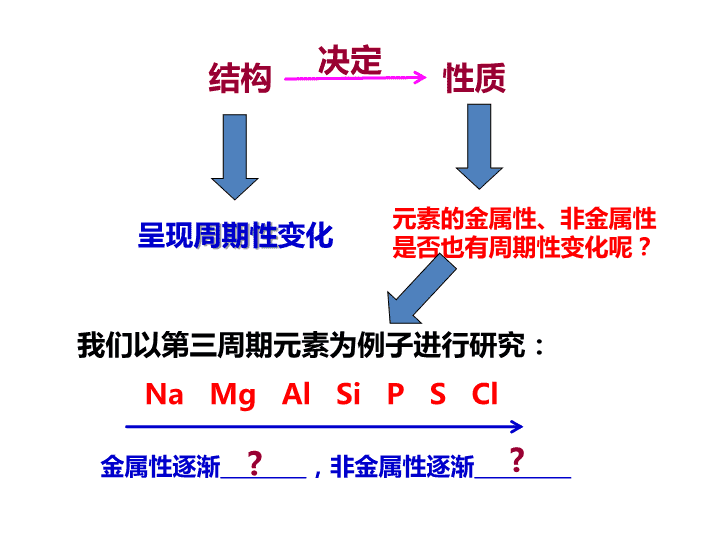
第二节 元素周期律 第2课时 通过上述探究,我们发现随着原子序数的递增,元素的______________________ 、__________________和__________________都呈现周期性变化。 原子最外层电子排布 原子半径 元素的化合价 上节课得出结论 课本第15页 决定 结构 性质 呈现 周期性 变化 元素的金属性、非金属性是否也有周期性变化呢? 我们以第三周期元素为例子进行研究: Na Mg Al Si P S Cl 金属性逐渐________,非金属性逐渐_________ ? ? 科学探究 (1) Mg与水的反应 现象 化学方程式 镁与冷水反应缓慢,加热时,反应变快,有大量气泡,滴入酚酞溶液变红色。 Mg+2H 2 O Mg(OH) 2 +H 2 ↑ 1.实验 (2) Mg、Al分别与盐酸的反应 Mg Al 现象 化学方程式 镁与盐酸 剧烈反应,有大量气泡。 Mg+2HCl=MgCl 2 +H 2 ↑ Al与盐酸 反应比较剧烈,有气泡。 2Al+6HCl=2AlCl 3 +3H 2 ↑ 1.实验 科学探究 (1) 回忆Na与水反应的现象,比较Na和Mg与水反应的难易程度。 Na与H 2 O反应比Mg与H 2 O反应 剧烈。 2.讨论 科学探究 (2) 比较镁和铝与盐酸反应的难易程度。 Mg与盐酸反应比Al与盐酸反应 剧烈。 (3) 比较钠、镁、铝的最高价氧化物对应的水化物(氢氧化物)碱性强弱。 NaOH > Mg(OH) 2 > Al(OH) 3 (4) 通过以上实验和讨论,你能推断出钠、镁、铝的金属性强弱吗? 2.讨论 科学探究 Na Mg Al 金属性逐渐_____________ 减弱 3.阅读 科学探究 Si P S Cl 非金属性逐渐_________ 增强 酸性比较: H 2 SiO 3 H 3 PO 4 H 2 SO 4 HClO 4 氢化物稳定性比较: SiH 4 PH 3 H 2 S HCl 4.通过以上对第三周期元素性质的比较,我们可以得出的结论: 科学探究 Na Mg Al Si P S Cl 金属性逐渐________,非金属性逐渐_________ 减弱 增强 课本第16页 通过大量事实,人们归纳出一条规律 : 元素的性质随着原子序数的递增而呈周期性的变化。这一规律叫做元素周期律。 元素的 原子半径 递变 原子半径依次减小 原子半径依次增大 失电子能力依次增强 失电子能力依次增强 非金属性依次增强 得电子能力依次增强 得电子能力依次增强 非金属性依次增强 金属性依次增强 金属性依次增强 原子半径依次增大 原子半径依次减小 元素的 性质递变 小结 非金属性依次增强 非金属性依次增强 金属性依次增强 金属性依次增强 元素的 性质递变 小结查看更多