- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年湖北省重点高中协作体高一上学期期中联考化学试卷
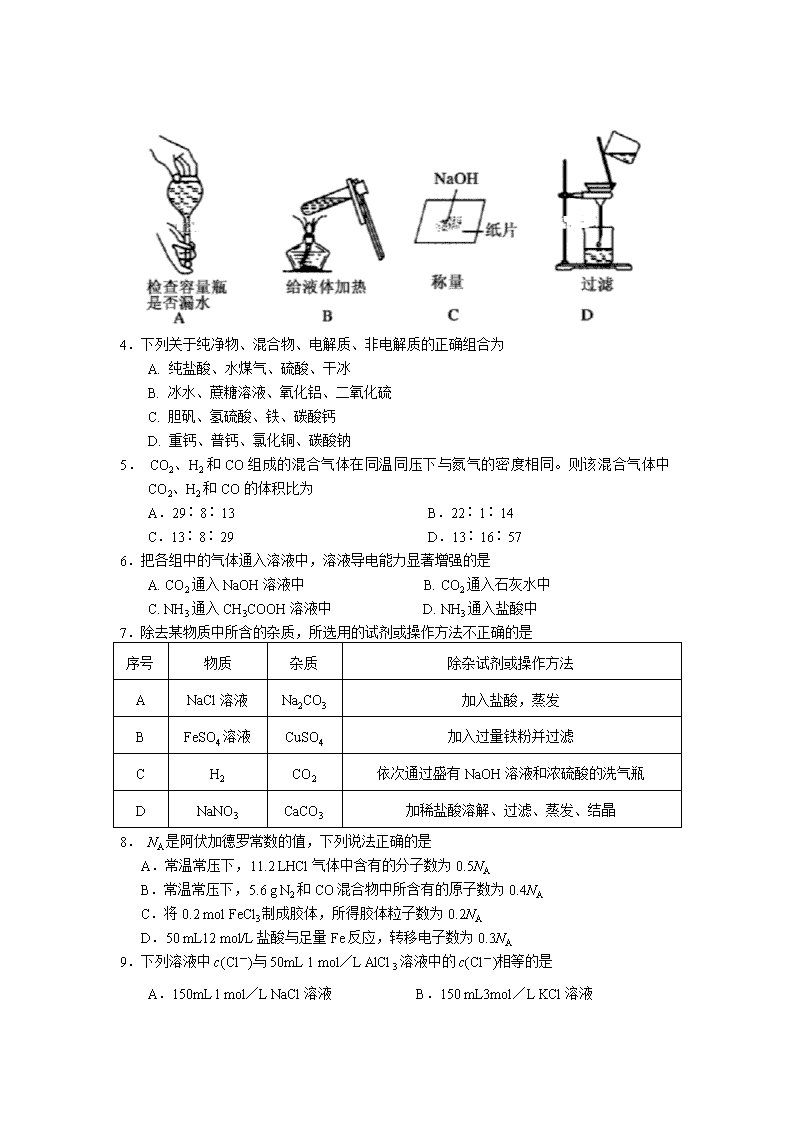
2018-2019学年湖北省重点高中协作体高一上学期期中联考化学试卷 考试时间:2018年11月14日上午10∶00—11∶30 试卷满分:100分 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共21题。试卷满分100分, 考试时间90分钟。 注意事项: 1.答题前,考生务必将自己的学校、姓名、考号、班级填写在答题卡指定位置。 2.第Ⅰ卷和第Ⅱ卷的答案均填写在答题卡内。 本卷可能用到的相对原子质量: H:1 C:12 N:14 O:16 Na:23 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Ag:108 Ba:137 第Ⅰ卷(选择题,共48分) 一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意) 1.清初《泉州府志》记载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。” 下列选项中,与文中“盖泥法”的原理相同的是 A.从地沟油中蒸馏出植物油 B.活性炭除去水中的红色墨汁 C.用结晶法除去KNO3中的NaCl D.用过滤法除去河水中泥沙 2.下列实验操作中,完全正确的一组是 ①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部 ②稀释浓硫酸时将水倒入浓硫酸中进行搅拌 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平放,用纸槽往试管里送入固体粉末,然后竖立试管 ⑤倾倒细口瓶里的液体时,瓶上的标签对着地面 ⑥将烧瓶放在桌上,再用力塞紧塞子 ⑦用坩埚钳夹取加热后的蒸发皿 ⑧将滴管垂直伸进试管内滴加液体 A.④⑤⑥⑧ B.①②⑤⑦ C.①③⑤⑦⑧ D.①④⑦ 3.下列实验操作正确的是 4.下列关于纯净物、混合物、电解质、非电解质的正确组合为 A. 纯盐酸、水煤气、硫酸、干冰 B. 冰水、蔗糖溶液、氧化铝、二氧化硫 C. 胆矾、氢硫酸、铁、碳酸钙 D. 重钙、普钙、氯化铜、碳酸钠 5. CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.13∶16∶57 6.把各组中的气体通入溶液中,溶液导电能力显著增强的是 A. CO2通入NaOH溶液中 B. CO2通入石灰水中 C. NH3通入CH3COOH溶液中 D. NH3通入盐酸中 7.除去某物质中所含的杂质,所选用的试剂或操作方法不正确的是 序号 物质 杂质 除杂试剂或操作方法 A NaCl溶液 Na2CO3 加入盐酸,蒸发 B FeSO4溶液 CuSO4 加入过量铁粉并过滤 C H2 CO2 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 D NaNO3 CaCO3 加稀盐酸溶解、过滤、蒸发、结晶 8. NA是阿伏加德罗常数的值,下列说法正确的是 A.常温常压下,11.2 LHCl气体中含有的分子数为0.5NA B.常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA C.将0.2 mol FeCl3制成胶体,所得胶体粒子数为0.2NA D.50 mL12 mol/L盐酸与足量Fe反应,转移电子数为0.3NA 9.下列溶液中c(Cl-)与50mL 1 mol/L AlCl3溶液中的c(Cl-)相等的是 A.150mL l mol/L NaCl溶液 B.150 mL3mol/L KCl溶液 C.75mL2 mol/L CaCl2溶液 D.75 mL l mol/L FeCl2溶液 10.在一个大试管里注入0.0l mol/L碘化钾溶液l0 mL,用胶头滴管滴入8~10滴相同浓度的硝酸银溶液,边滴加边振荡,即得碘化银胶体。下列说法正确的是 A.布朗运动是该胶体稳定的主要原因 B.提纯上述碘化银胶体,需要的实验用品有漏斗、滤纸、烧杯、玻璃棒等 C.用上述胶体做电泳实验,发现阳极附近颜色逐渐变深,说明该胶体粒子带负电荷 D.在上述碘化银胶体中快速滴加0.0l mol/L硝酸银溶液至l0mL,将得到更多的胶体 11.在某澄清透明的溶液中,下列各组离子中能大量共存的是 A.I-、NO、Fe2+、Na+ B.Ag+、NO、Cl-、K+ C.K+、Ba2+、OH-、SO D.Cu2+、NH、Br-、OH- 12.K2FeO4可用作水处理剂,它可由3Cl2 +2Fe(OH)3 +10KOH ===2K2FeO4 +6KCl +8H2O制得。下列说法不正确的是 A.氧化性:Fe(OH)3 >K2FeO4 B.Cl2是氧化剂,Fe(OH)3在反应中失去电子 C.上述反应的氧化剂与还原剂物质的量之比为3:2 D.每生成l mol氧化产物转移的电子的物质的量为3 mol 13.下列反应的离子方程式书写不正确的是 A.稀硫酸滴在铁片上:Fe+2H+ ===2Fe2+ +H2↑ B.铜片插入硝酸银溶液中: Cu+2Ag+ ===Cu2+ +2Ag C.碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO+OH-===CaCO3↓+H2O D.醋酸滴在石灰石上:CaCO3 + 2CH3COOH=== Ca2++2CH3COO-+CO2↑+H2O 14.下列说法正确的是 A.把100 mL3mol/LH2SO4跟100 mL H2O混合后,溶液中c(H+)为1.5 mol/L B.把100 mL 20% NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10% C.把200 mL3 mol/LBaCl2溶液跟100 mL3mol/LKCl溶液混合后,溶液中c(Cl-)仍然是3mol/L D.把100 g 20% NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% 15.在两个密闭容器甲、乙中,依次充入氧原子数目相同的O2、O3两种气体,若它们的温度和密度均相同。下列说法正确的是 A.气体体积:甲>乙 B.气体的压强:甲>乙 C.气体的分子数:甲<乙 D.气体的质量:甲<乙 16.向60mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表,下列有关说法正确的是 实验编号 1 2 3 4 5 BaCl2溶液体/ mL 0 30 60 100 120 沉淀质量/g 0 0.699 x 2.097 2.097 A.混合前,BaCl2溶液的物质的量浓度为0.05 mol/L B.混合前,Na2SO4溶液的物质的量浓度为0.30 mol/L C.实验3中沉淀的质量x为1.398g D.完全沉淀60mL Na2SO4溶液,消耗BaCl2溶液的体积为80mL 第Ⅱ卷(非选择题,共52分) 二、非选择题(本题包括5小题,共52分) 17.(10分)已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡 ⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题: (1)属于混合物的是 (填序号,下同),属于弱电解质的是 。 (2)上述物质中 与 在水溶液中可发生反应,且离子方程式为H++OH-===H2O。 (3)实验室制备少量Fe(OH)3胶体所用的物质有 ,反应的离子方程式为 。 (4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取) 的质量为 g,从配制好的溶液中取出300mL,其中含有SO的数目为 (设 NA为阿伏加德罗常数的值)。 18.(10分)按要求回答下列问题: (1)当H2O和H2O2分子个数比为1:1 时,原子总数之比为 ,电子数之比为 。 (2)V mLAl2(SO4)3溶液中含a gAl3+,取出 mL溶液稀释成V mL后,SO的物质的量浓度为 (用含a、V的代数式表示,化简到最简整数比)。 (3)在一定条件下,11.2 g单质R与0.3 molCl2完全反应,生成0.2 molRClx,则x= ,RClx 的摩尔质量为 。 19.(12分)实验室要配制80 mlL1.00 mol/LNaCl溶液,实验室现有含有少量碳酸钠的氯化钠固体。 Ⅰ.为了除去氯化钠样品中的杂质,某兴趣小组最初设计了如下方案进行实验: (1)沉淀A的化学式是 。 (2)在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。则固体物质B的成分为 (用化学式表示)。 (3)继续探究后又提出了新的方案:将混合物溶解,先滴加足量 (填试剂名称),再蒸发结晶,有关反应的离子方程式为 。 Ⅱ.配制溶液: (1)配制过程中需要使用的玻璃仪器除烧杯和玻璃棒外还有 。 (2)从所配溶液中取出10mL,与足量AgNO3溶液反应,经过滤、洗涤、干燥后得到白色沉淀1.50 g。则所配溶液的浓度 1.00 mol/L (填“>”、“<”或“=”),造成此误差的操作可能是 。 A.使用容量瓶前未干燥 B.用托盘天平称量氯化钠固体时将砝码错放在左盘 C.定容时俯视容量瓶的刻度线 D.定容后经震荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 20.(10分)Ⅰ.已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。 (1)已知0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为 。 (2)将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和 数目。 Ⅱ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。 (1)图中操作①为 ;操作③为 。 (2)试剂X为 (填化学式),操作②涉及的离子反应方程式为 。 21.(10分)有一包固体混合物粉末,其中可能含有Na2SO4、K2CO3、CuSO4、BaCl2、NaCl, 现按如下操作步骤进行实验: ①取部分固体混合物溶于水中,振荡,得无色透明溶液; ②取①所得溶液,滴加过量硝酸钡溶液,有白色沉淀产生; ③过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解。 根据上述实验事实,回答下列问题: (1)原固体混合物粉末中一定含有的物质是 ,一定不含有的物质是 ,可能含有的物质是 (以上空格均填写化学式)。 (2)写出步骤③中的离子方程式 。 (3)若要检验K2CO3中Cl-和SO是否除尽,选用的试剂及加入的先后次序是 (填字母)。 a.HCl、BaCl2、AgNO3 b.HNO3、Ba(NO3)2、AgNO3 c.AgNO3、HNO3、Ba(NO3)2 d.AgNO3、HCl、BaCl2 2018年秋季湖北省重点高中联考协作体期中考试 高一化学参考答案 第Ⅰ卷(选择题,每小题3分,共48分) 题 号 1 2 3 4 5 6 7 8 答 案 B D A B C C D B 题 号 9 10 11 12 13 14 15 16 答 案 B C A A C D B C 第 Ⅱ 卷(非选择题,共52分) 17.(共10分)(1)②⑦⑧(1分); ①(1分) (2)⑥与⑨ (1分) (3)①⑦(1分); Fe3++3H2O Fe(OH)3(胶体)+3H+ (2分) (4)25.0(2分); 0.03NA(2分) 18.(共10分)(1)3:4(2分); 5:9(2分) (2) mol/L(2分) (3)3 (2分); 162.5g/mol(2分) 19.(共12分)Ⅰ.(1)CaCO3 (1分) (2)NaCl、CaCl2(2分) (3)盐酸(1分); CO32-+2H+===H2O+CO2↑(2分) Ⅱ.(1)100mL容量瓶、胶头滴管(2分) (2)>(2分); C(2分) 20.(共10分)Ⅰ.(1)CO2 (2分) (2)(3分) Ⅱ.(1)过滤(1分) ; 冷却结晶(1分) (2)Fe(1分) ; Fe + 2H+ = Fe2+ + H2↑(2分) 21.(共10分)(1)K2CO3 、Na2SO4(2分); CuSO4、BaCl2(2分); NaCl(2分) (2)BaCO3+2H+===Ba2++CO2↑+H2O(2分) (3)b(2分)查看更多