- 2021-08-23 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省永安市第三中学2019-2020学年高二下学期期初综合检测试化学试题
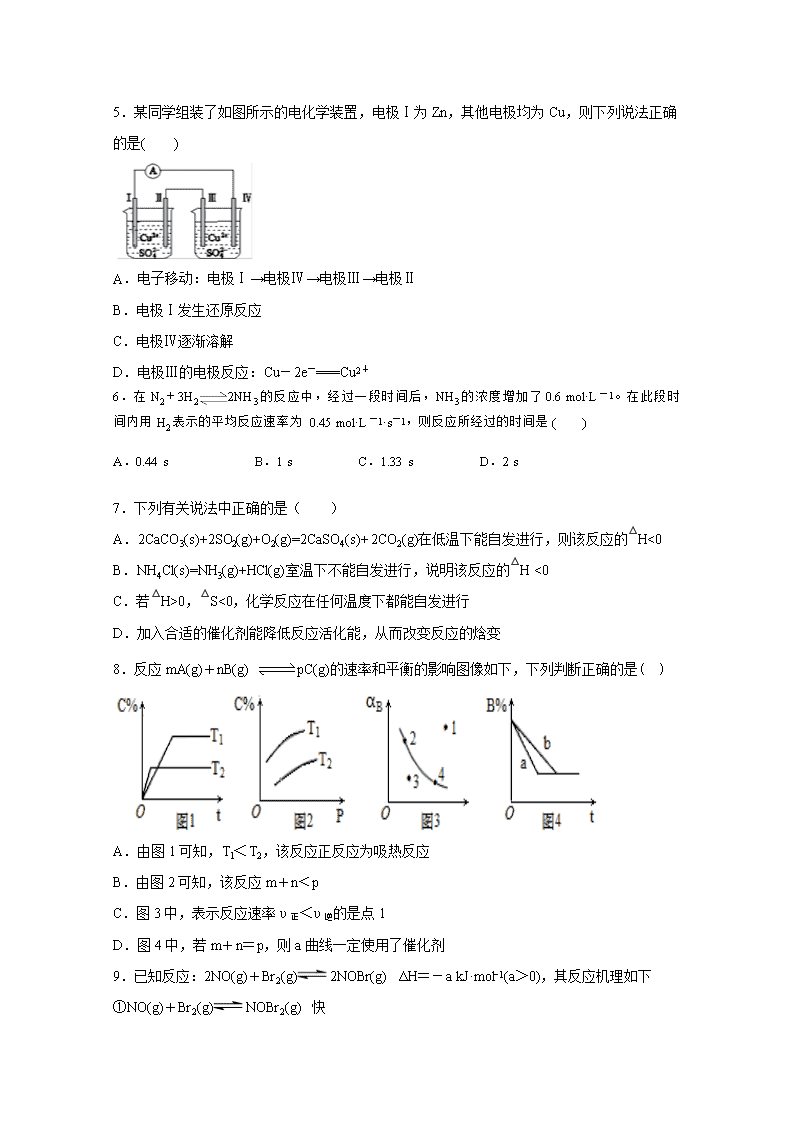
永安三中2019-2020学年第二学期高二化学期初综合检测试卷 班级 姓名 可能用到的相对原子质量:H-1 O-16 Na-23 第I卷(选择题) 一、单选题(共16小题,每小题3分,共48分) 1.下列对核外电子运动状态的描述正确的是( ) A.电子的运动与行星的运动相似,围绕原子核在固定的轨道上高速旋转 B.能层数为3时,有3s、3p、3d、3f四个轨道 C.氢原子中只有一个电子,故只有一个轨道,不能发生跃迁而产生光谱 D.在同一能级上运动的电子,其运动状态肯定不同 2.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( ) A.He B. C. D. 1s2 3.以下有关元素性质的说法不正确的是( ) A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4原子半径最大的是① B.具有下列最外层电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4第一电离能最大的是③ C.①Na、K、Rb ②N、O、S ③Si、P、As ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ D.某元素基态原子的逐级电离能分别为578、1817、2745、11575、14830、18376、23293,当它与氯气反应时可能生成的阳离子是X2+ 4.某温度下气体反应达到化学平衡,平衡常数。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是( ) A.恒容时,向容器中充入稀有气体,反应速率不变 B.增大c(A)、c(B),K增大 C.该反应的化学方程式为2E(g)+F(s)⇌A(g)+2B(g) D.正反应为放热反应 5.某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,则下列说法正确的是( ) A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ B.电极Ⅰ发生还原反应 C.电极Ⅳ逐渐溶解 D.电极Ⅲ的电极反应:Cu-2e-===Cu2+ 6.在N2+3H22NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol·L-1。在此段时间内用H2表示的平均反应速率为0.45 mol·L-1·s-1,则反应所经过的时间是( ) A.0.44 s B.1 s C.1.33 s D.2 s 7.下列有关说法中正确的是( ) A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+ 2CO2(g)在低温下能自发进行,则该反应的△H<0 B.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H <0 C.若△H>0,△S<0,化学反应在任何温度下都能自发进行 D.加入合适的催化剂能降低反应活化能,从而改变反应的焓变 8.反应mA(g)+nB(g) pC(g)的速率和平衡的影响图像如下,下列判断正确的是( ) A.由图1可知,T1<T2,该反应正反应为吸热反应 B.由图2可知,该反应m+n﹤p C.图3中,表示反应速率υ正<υ逆的是点1 D.图4中,若m+n=p,则a曲线一定使用了催化剂 9.已知反应:2NO(g)+Br2(g)2NOBr(g) ΔH=-a kJ·mol−1(a>0),其反应机理如下 ①NO(g)+Br2(g)NOBr2(g) 快 ②NO(g)+NOBr2(g) 2NOBr(g) 慢 下列有关该反应的说法正确的是( ) A.该反应的速率主要取决于①的快慢 B.NOBr2是该反应的催化剂 C.增大Br2(g)浓度能增大活化分子百分数,加快反应速率 D.正反应的活化能比逆反应的活化能小a kJ·mol−1 10.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( ) ①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中通NH3 ⑤向水中加入明矾晶体 ⑥向水中加入NaHCO3固体 ⑦向水中加NaHSO4固体 A.①③⑥⑦ B.①③⑥ C.⑤⑦ D.⑤ 11.常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( ) A.0.1mol·L−1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+) B.将100mL0.1mol·L−1 Na2CO3溶液逐滴滴加到100mL0.1mol·L−1盐酸中:c(Na+)>c(Cl−)>c(HCO3-)>c(CO32-) C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO−)>c(Na+)>c(H+)>c(OH−) D.0.1mol·L−1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH−)+c(CO32-) 12.下列说法不正确的是( ) A.马口铁镀锡的表面即使破损后也能起到很好的防锈作用 B.FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀 C.反应AgCl+NaBr===AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 D.除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好 13.甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含的离子如下表所示 阳离子 NH4+、Na+、Mg2+ 阴离子 OH-、NO3-、SO42- 取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)>c(乙)>c(丙),下列说法错误的是( ) A.甲中一定含Na+ B.乙中一定含NH4+ C.丙中一定含Mg2+ D.丙中一定含SO42- 14.下列实验操作合理或能达到实验目的的是( ) A.图1:实验目的是定量测定化学反应速率 B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度 C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热 D.图4:模拟铁的腐蚀实验 15.下列依据热化学方程式得出的结论正确的是( ) A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 B.已知C(s)+O2(g)=CO2(g) ΔH1;C(s)+O2(g)=CO(g) ΔH2,则ΔH2>ΔH1 C.已知2H2(g)+O2(g)=2H2O(g) ΔH= -483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol 16.常温下,H2SO3的电离常数:Ka1=1.54×10−2,Ka2=1×10−7。向mmL0.1mol/LH2SO3溶液中滴加0.1mol·L−1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法不正确的是( ) A.m=10 B.c点对应的溶液中存在c(K+)>c(HSO3-)+2c(SO32−) C.b、d两点溶液的pH=7 D.SO32-+H2O⇌HSO3-+OH− 的K=1×10−7 第II卷(非选择题) 二、填空题 17.(4分) 某元素原子的电子排布式为1s22s22p63s23p1。该原子核外共__ 个电子层,有_ _种能量不同的电子。核外电子占有的轨道总数是_ 个,有__ _种不同运动状态的电子。 18.(6分)(1)元素C、N、O、K的电负性从大到小依次为_____ _。 (2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____ __。 (3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是___ ___(填“A”“B”“C”或“D”)。 19.(6分)回答下列问题: (1) 、均为第四周期过渡金属元素,两元素的部分电离能数据列于下表: 元素 电离能/() I1 717 759 I2 1509 1561 I3 3248 2957 锰元素位于第四周期第ⅦB族。请写出基态的价电子轨道排布式:___ ___,比较两元素的I2、I3可知,气态再失去1个电子比气态再失去1个电子难,对此你的解释是__ ____ (2)下表是第三周期部分元素的电离能[单位:[(电子伏特)]数据。 元素 甲 5.7 47.4 71.8 乙 7.7 15.1 80.3 丙 13.0 23.9 40.0 丁 15.7 27.6 40.7 下列说法正确的是_ _____(填序号)。 A.甲的金属性比乙强 B.乙有价 C.丙不可能为非金属元素 D.丁一定为金属元素 20.(14分)A、B、C、D、E代表5种元素。请填空: (1)A 元素基态原子的最外层有2 个未成对电子,次外层有2 个电子,其元素符号为______; (2) B 元素的负一价离子和C元素的正一价离子的电子层结构都与氖相同,B 的基态原子的轨道排布式为______, C元素的离子结构示意图为______。 (3) D 元素的正三价离子的3d能级为半充满,D的元素符号为_____,其基态原子的电子排布式为______,它位于第________周期第______族; (4) E 元素基态原子的M 层能量最高的能级半充满,N 层没有成对电子,只有一个未成对电子,E 的元素符号为_____________, 其基态原子的价电子排布式为_______________。 21.(8分)用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则: (1)电源的F端为_____________极。 (2)A中发生反应的化学方程式为________________。 (3)在B中观察到的现象是___ _,_____ ____,_________ (4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,,B中析出硫酸钠晶体。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则A溶液的pH为______________。 三、实验题 22.(14分)今有①CH3COOH;②HCl;③H2SO4三种溶液,(1)~(3)题请选择填空: A.①>②>③ B.①<②<③ C.①=②=③ E.①>②=③ D.①=③>② F.①<②=③ G.①=②<③ H.①=②>③ (1)当它们pH相同时,其物质的量浓度关系是___________。 (2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为_________________。 (3)当它们pH相同、体积相同时,分别加入足量锌,则开始时反应速率_________,相同状况下产生气体体积关系为____________。 (4)某学生用0.2000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: (A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞 (B)用标准溶液润洗滴定管2-3次 (C)把盛有标准溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液 (D)取标准NaOH溶液注入滴定管至0刻度以上2-3cm (E)调节液面至0或0刻度以下,记下读数 (F)把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度 完成以下填空: ①正确操作的顺序是(用序号字母填写)_____→D→_____→_____→A→_____, ②实验中,眼睛应注视___________________________,直至滴定终点。 ③几次滴定消耗NaOH溶液的体积如下: 实验序号 1 2 3 4 消耗NaOH溶液的体积(mL) 20.05 20.00 18.80 19.95 则该盐酸溶液的准确浓度为_____________。(保留小数点后4位) (5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是____________。 A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质 B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 E. 未用标准液润洗滴定管 永安三中2019-2020学年第二学期高二化学期初综合检测 参考答案 一、单选题(共16小题,每小题3分,共48分) 1.D 2.C 3.D 4. A 5.D 6.D 7.A 8.C 9.D 10.D 11.C 12.A 13.D 14.D 15.B 16.C 17(每空1分,共4分).3 5 7 13 18(每空2分,共6分) 1.O>N>C>K C>H>Si D 19.(每空2分,共6分) (1) 略 由转化为时,能级由较稳定的半充满状态转变为不稳定的状态需要的能量较多;而转化为时,能级由不稳定的状态转变为较稳定的半充满状态需要的能量相对要少 (2) A 20.(共14分)(1)C或O(2分) (2) 略(2分) (2分) (3) Fe (1分) 1s22s22p63s23p63d64s2或[Ar]3d64s2) (2分) 四(1分) VIII (1分) Cr(1分)3d54s1 (2分) 21.(共8分)正 (1分) 4AgNO3+2H2O4Ag+O2 +4HNO3 (2分) 石墨极有气泡产生 Cu极周围变蓝色 溶液中有沉淀生成 (各1分,共3分) 2 (2分) 22.(共14分)A(2分) B (2分) C(1分) E (1分) BDCEAF (2分) 锥形瓶中溶液颜色的变化(2分) 0.2000mol/L (2分) ADE (2分) 查看更多