- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省大庆市第四中学2020届高三4月月考理综-化学试题
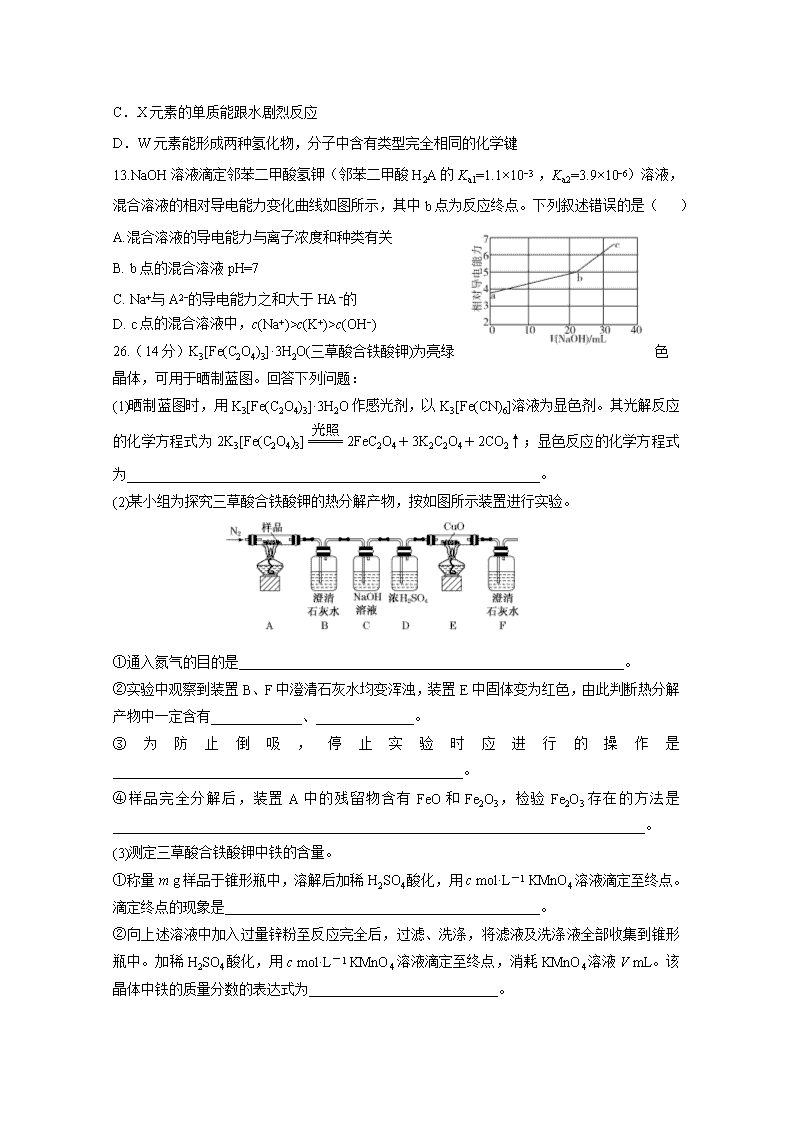
7.化学与生活密切相关。下列说法错误的是( ) A.泡沫灭火器可用于一般的起火,也适用于电器起火 B.疫苗一般应冷藏存放,以避免蛋白质变性 C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 8. NA为阿伏加德罗常数的值。下列说法正确的是( ) A.18 g D2O和18 g H2O中含有的质子数均为10NA B. 2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA 9. 下列实验操作能达到实验目的的是( ) 实验目的 实验操作 A 制备Fe(OH)3胶体 将NaOH浓溶液滴加到饱和FeCl3溶液中 B 由MgCl2溶液制备无水MgCl2 将MgCl2溶液加热蒸干 C 除去Cu粉中混有的CuO 加入稀硝酸溶解,过滤、洗涤、干燥 D 比较水与乙醇中氢的活泼性 分别将少量钠投入到盛有水和乙醇的烧杯中 10. 已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1 H—H、O===O和O—H键的键能分别为436kJ·mol-1、496kJ·mol-1和462 kJ·mol-1,则a为( ) A.-332 B.-118 C.+130 D.+350 11. 某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( ) A.放电时,Li+在电解质中由负极向正极迁移 B.放电时,负极的电极反应式为LixC6-xe-=xLi++C6 C.充电时,若转移1 mol e-,石墨(C6)电极将增重7x g D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+ 12. 短周期元素W、X、Y、Z的原子序数依次增大,分别可以形成简单离子W2-、X+、Y3+、Z2-,下列判断错误的是( ) A.W和Z在同一主族 B.Y3+、Z2-两种离子都能促进水的电离 C.X元素的单质能跟水剧烈反应 D.W元素能形成两种氢化物,分子中含有类型完全相同的化学键 13.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( ) A.混合溶液的导电能力与离子浓度和种类有关 B. b点的混合溶液pH=7 C. Na+与A2−的导电能力之和大于HA−的 D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−) 26.(14分)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题: (1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为2K3[Fe(C2O4)3]2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___________________________________________________________。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。 ①通入氮气的目的是_______________________________________________________。 ②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有_____________、______________。 ③为防止倒吸,停止实验时应进行的操作是__________________________________________________。 ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是____________________________________________________________________________。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是_____________________________________________。 ②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为___________________________。 27. (16分)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题: 相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下: 金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+ 开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9 (1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。 (2)“氧化”中添加适量的MnO2的作用是________________________。 (3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。 (4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。 (5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。 (6)写出“沉锰”的离子方程式______________________________________________。 (7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=时,z=___________。 28.(13分)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题: 对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。 (1)343 K时反应的平衡转化率α=______%。平衡常数K343 K=_______(保留2位小数)。 (2)在343 K下:要提高SiHCl3转化率,可采取的措施是________________________;要缩短反应达到平衡的时间,可采取的措施有_______________、________________。 (3)比较a、b处反应速率大小:va______vb (填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2-k逆xx,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的=________(保留1位小数) 34.[化学—选修3物质结构与性质](15分) 硫及其化合物有许多用途,相关物质的物理常数如下表所示: H2S S8 FeS2 SO2 SO3 H2SO4 熔点/℃ -85.5 115.2 >600 (分解) -75.5 16.8 10.3 沸点/℃ -60.3 444.6 -10.0 45.0 337.0 回答下列问题: (1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________形。 (2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是________。 (3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________________________________________________________________________。 (4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。 (5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________________g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为________nm。 35.[化学—选修5有机化学基础](15分) 以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下: 回答下列问题: (1)葡萄糖的分子式为_____________。 (2)A中含有的官能团的名称为____________________。 (3)由B到C的反应类型为__________________。 (4)C的结构简式为____________________。 (5)由D到E的反应方程式为___________________________________________。 (6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为________________。 理科综合化学试题答案 单项选择题(本题包含7-13共7小题,每小题6分,共42分) 题号 7 8 9 10 11 12 13 选项 A C D C C D B 26.(14分,除第(2)问②每空1分,其余每空2分) (1)3FeC2O4+2K3[Fe(CN)6]===Fe3[Fe(CN)6]2+3K2C2O4 (2)①隔绝空气、使反应产生的气体全部进入后续装置 ②CO2 CO(每空各1分) ③先熄灭装置A、E的酒精灯,冷却后停止通入氮气 ④取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3 (3)①粉红色出现 ②×100% 27.(16分,每空2分) (1)SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4=2MnSO4+S+2H2O (2)将Fe2+氧化为Fe3+ (3)4.7 (4)NiS和ZnS (5)F−与H+结合形成弱电解质HF,MgF2Mg2++2F−平衡向右移动(6)Mn2++2HCO3-=MnCO3↓+CO2↑+H2O (7) 28.(13分,除特殊标识外,其余每空2分)(1)22 0.02 (2)及时移去产物 改进催化剂 提高反应物压强(浓度) (3)大于(1分) 1.3 35.(15分,除特殊标识外,其余每空2分) 答案:(1) 哑铃(纺锤) (1分) (2)H2S (3)S8相对分子质量大,分子间范德华力强 (4)平面三角(1分) 2(1分) sp3 (5)×1021 a 36. (15分,除特殊标识外,其余每空2分) (1)C6H12O6 (2)羟基 (3)取代反应 (4) (5)(3分) (6)9 查看更多