- 2021-08-23 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】福建省莆田第一中学2019-2020学年高二上学期第一次月考试题
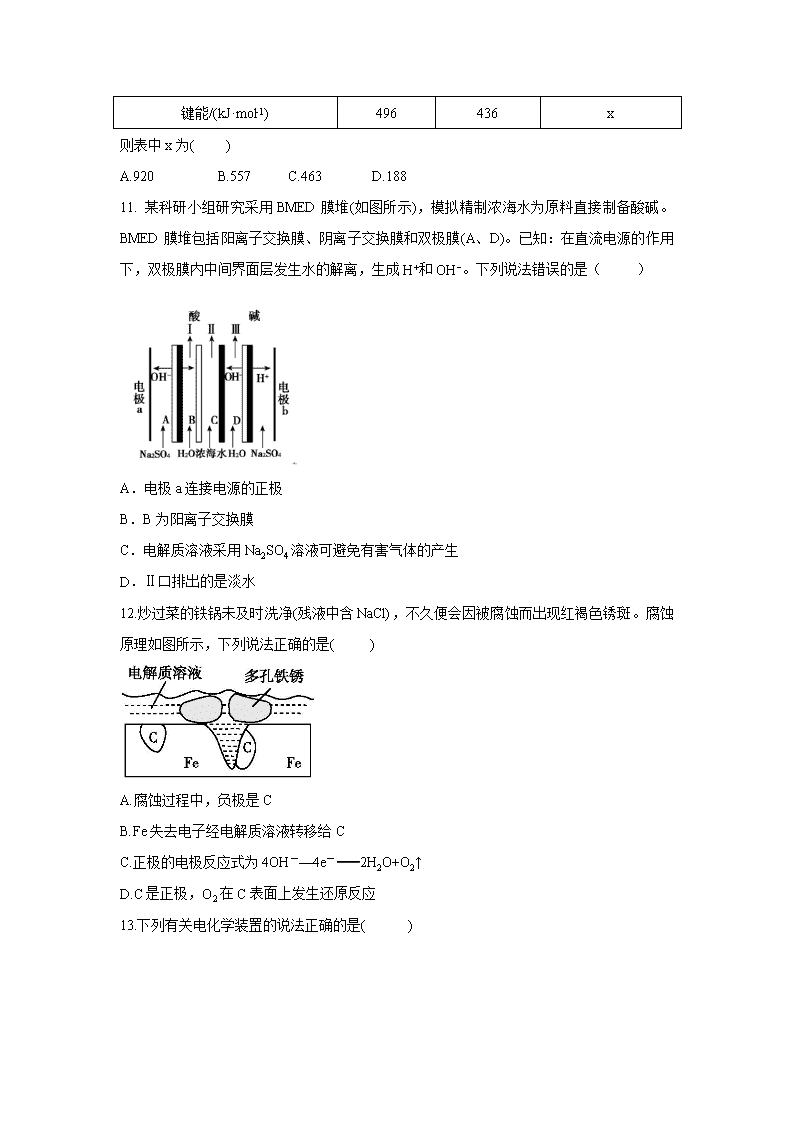
福建省莆田第一中学2019-2020学年高二上学期第一次月考试题 时间:90分钟 满分:100分 可能用到的相对原子质量:H 1 C 12 O 16 Ag 108 一、选择题(每小题只有一个选项符合题意,每小题3分, 共18道题,共54分) 1.下列说法不正确的是( ) A.CO2、甲烷都属于温室气体 B.用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体 C.太阳能、风能和生物质能属于新能源 D.太阳能电池可将太阳能直接转化为电能 2.下列说法正确的是( ) A.反应条件是加热的反应都是吸热反应 B.化学反应除了生成新的物质外,不一定伴随着能量的变化 C.物质燃烧一定是放热反应 D.放热的化学反应不需要加热就能发生 3.某同学利用苹果制作了水果原电池,下列说法正确的是 ( ) A.电池中失去电子的电极为阴极 B.水果原电池产生电流时,发生的是氧化还原反应 C.两个电极的材料可以相同 D.水果电池工作时氧化反应和还原反应在同一处进行 4.在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立平衡2SO2(g)+O2(g)2SO3(g) ΔH=-QkJ·mol-1,测得SO2的转化率为90%,则在此条件下,反应放出的热量为( ) A. 1.8QkJ B.2QkJ C.QkJ D. 0.9QkJ 5.下列叙述不正确的是( ) A.在镀件上电镀铜时,可用金属铜作阳极 B.镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 C.工业上电解饱和食盐水制烧碱,NaOH在阴极产生 D.钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 6.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( ) A.电解时以精铜作阳极 B.电解时阴极发生氧化反应 C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e- D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 7.纸电池是一种有广泛应用的“软电池”,碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池的说法不合理的是( ) A.Zn为负极,发生氧化反应 B.电池工作时,电子由MnO2流向Zn C.正极反应:MnO2+H2O+e-===MnO(OH)+OH- D.电池总反应:Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH) 8.电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的( ) A.HCl B.NaOH C.NaCl D.CuSO4 9. 如表所列的“依据”能推导出后面的“结论”的是( ) 依据 结论 A CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-801.3 kJ· mol-1 CH4的标准燃烧热ΔH为-801.3 kJ· mol-1 B Sn(灰,s)Sn(白,s) ΔH=+2.1 kJ· mol-1 锡制品在寒冷的冬天因易转化为灰状锡而损坏 C 稀溶液中:H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ· mol-1 中和热ΔH为 57.3 kJ· mol-1 D C(石墨,s)+O2(g)CO2(g) ΔH=-393.5 kJ· mol-1 C(金刚石,s)+O2(g)CO2(g) ΔH= -395 kJ· mol-1 石墨转化为金刚石会放出热量 10.已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表: H—H H—O(g) 键能/(kJ·mol-1) 496 436 x 则表中x为( ) A.920 B.557 C.463 D.188 11. 某科研小组研究采用BMED膜堆(如图所示),模拟精制浓海水为原料直接制备酸碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知:在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH−。下列说法错误的是( ) A.电极a连接电源的正极 B.B为阳离子交换膜 C.电解质溶液采用Na2SO4溶液可避免有害气体的产生 D.Ⅱ口排出的是淡水 12.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是( ) A.腐蚀过程中,负极是C B.Fe失去电子经电解质溶液转移给C C.正极的电极反应式为4OH-—4e-2H2O+O2↑ D.C是正极,O2在C表面上发生还原反应 13.下列有关电化学装置的说法正确的是( ) A.用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-2Ag+S2- B.用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 C.图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼 D.图4装置中若M是铜,则该装置能防止铁被腐蚀 14.当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下 下列关于该“消除”过程的叙述不正确的是( ) A.部分光能转变为化学能 B.消除总变化为NOx+O2+H2OHNO3 C.消除反应能全天候发生 D.使用纳米TiO2的消除效率更高 15.我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为Pb+PbO2+2H2SO42PbSO4+2H2O,下列有关说法正确的是( ) A.图中涉及的能量转化方式只有3种 B.该发电工艺可实现零排放 C.蓄电池供电时,负极的电极反应为Pb-2e-P D.储能时若充电时间过长,阳极流向阴极的气体可能是H2 16.锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O2Cu+2Li++2OH-。下列说法不正确的是( ) A.放电时,Li+透过固体电解质向Cu极移动 B.通空气时,铜被腐蚀,产生Cu2O C放电时,正极的电极反应式为Cu2O+2H++2e-2Cu+H2O D.整个反应过程中,氧化剂为O2 17.利用如图电解装置从海水中提取CO2,同时获得副产品H2。下列说法错误的是( ) A.a室的电极接电源的负极 B.该装置将电能转化为化学能 C.c室排出的碱液中含NaOH D.a室的电极反应式为:4OH-—4e-2H2O+O2↑ 18.用图示装置(熔融CaF2CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是( ) A.电解过程中,Ca2+向阳极移动 B.阳极的电极反应式为C+2O2——4e-CO2↑ C.在制备金属钛前后,整套装置中CaO的总量减少 D.若用铅蓄电池作该装置的供电电源,“+”接线柱是Pb电极 二、非选择题(本题包括5小题,共46分) 19.(7分) 碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题: (1)有机物M经过太阳光光照可转化成N,转化过程如下: ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是_____。 (2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。 (3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。 (4)煤气化制合成气(CO和H2) 已知:①C(s)+H2O(g)CO(g)+H2(g) ΔH1=+131.3 kJ· mol-1 ②C(s)+2H2O(g)CO2(g)+2H2(g) ΔH2=+90 kJ· mol-1 则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。 20.(12分)按要求答题 (1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、 101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是 。 (2)已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,请参考题中图表,按要求填空: ①图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是 (填“增大”“减小”或“不变”,下同),ΔH的变化是 。NO2和CO反应的热化学方程式为 。 ②下表所示是部分化学键的键能参数: 化学键 P—P P—O 键能/(kJ·mol-1) a b C x 已知P4(g)+5O2(g)P4O10(g) ΔH=-d kJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x= (用含a、b、c、d的代数式表示)。 (3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在 101 kPa、298 K时,1 mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624 kJ,该反应的热化学方程式是 。 又知:H2O(g)H2O(l) ΔH=-44 kJ·mol-1,若 1 mol 液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为 kJ。 21.(8分)如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到 336 mL(标准状况)气体。回答: (1)直流电源中,M为 极。 (2)Pt电极上生成的物质是 ,其质量为 g。 (3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶ ∶ ∶ 。 (4)AgNO3溶液的浓度 (填“增大”“减小”或“不变”,下同),硫酸的浓度 。 22.(9分)(1)一种甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下: 请回答下列问题: (1) Pt(a)电极反应为 ; 如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有 mol。 (2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。 E为该燃料电池的 (填“正”或“负”)极。F电极上的电极反应式 。 (3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛(OHC—CHO)与M电极的产物反应生成乙醛酸。 ①N电极上的电极反应式为 。 ②若2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸 为 mol 。 23.(10分)对金属制品进行抗腐蚀处理,可延长其使用寿命。 (1)以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 (填字母序号)。 a.NH3 b.CO2 c.NaOH d.HNO3 ②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜(氧化铝),阳极的电极反应式为 。 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。 (3)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于 (填“M”或“N”)处。 若X为锌,开关K置于M处,该电化学防护法称为 。 【参考答案】 一、 选择题(每小题3分,共54分) 题号 1 2 3 4 5 6 7 8 9 答案 B C B A B D B B B 题号 10 11 12 13 14 15 16 17 18 答案 C B D A C B C A B 一、 非选择题(包含5小题,共46分) 19.(7分) (1)M (1分) (2)< (1分) (3)98kJ(2分) (4)CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1。(3分) 20.(12分) (1)4CuCl(s)+O2(g)2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1(2分) (2)①减小(1分) 不变(1分) NO2(g)+CO(g)CO2(g)+NO(g) ΔH=-234 kJ· mol-1 (2分) ②(2分) (3)N2H4(l)+O2(g)N2(g)+2H2O(g) ΔH=-624 kJ· mol-1(2分) 712 (2分) 21.(8分) (1)正(1分) (2)Ag(1分) 2.16(2分) (3)2 1(2分) (4)不变(1分) 增大(1分) 22. (9分) (1)CH3OH+H2O-6e-CO2↑+6H+ (2分) (1分) (2)负(1分) ClO-+2e-+H2OCl-+2OH- (2分) (3)HOOC—COOH+2e-+2H+HOOC—CHO+H2O(2分) 2 (1分) 23. (10分) (1)①2Al+2OH-+2H2O2Al+3H2↑(3分) b(1分) ②2Al+3H2O-6e-Al2O3+6H+ (3分) (2)补充溶液中的Cu2+,保持溶液中Cu2+的浓度恒定(1分) (3)N(1分) 牺牲阳极的阴极保护法(1分)查看更多