- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年海南省儋州一中高一上学期第一次月考化学试卷
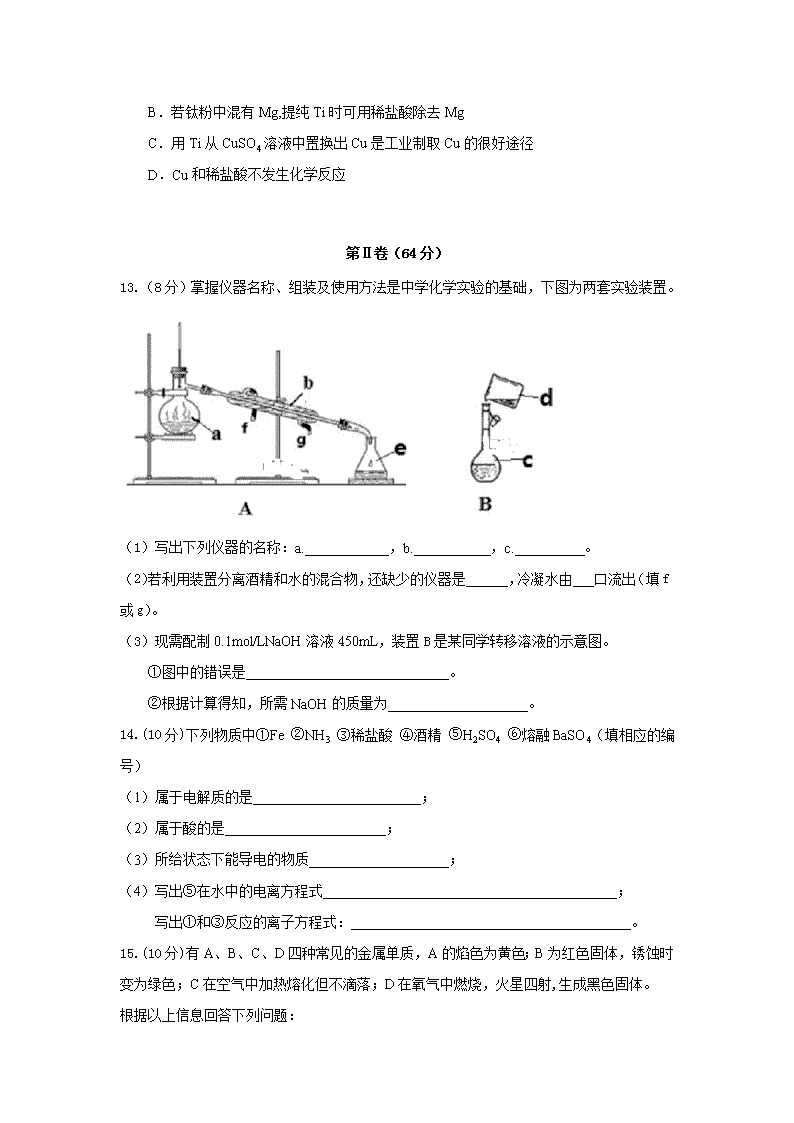
2018-2019学年海南省儋州一中高一上学期第一次月考化学试卷 可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Na:23 Mg:24 Al:27 Cl:35.5 第I卷(36分) 一、 选择题:(本题共6小题。每小题2分,共12分。在每小题给出的四个选项中,只有一项是符合题目要求的) 1.下列分散系最稳定的是( ) A. 溶液 B. 乳浊液 C. 胶体 D.悬浊液 2.金属钠着火时,可采用的灭火物质是( ) A.泡沫灭火器 B.沙子 C.水 D.干粉灭火器 3.下列金属元素的单质或化合物在火焰上灼烧时,通过蓝色钴玻璃观察到焰色为紫色的是( ) A. KNO3 B.NaCl C.MgCl2 D.Cu 4.1 L 0.1 mol/L K2CO3溶液中含有的K+的数目为( ) A.0.1 B.0.2 C.6.02×1023 D.1.204×1023 5.下列关于合金的叙述,不正确的是( ) A. 合金的熔点一般比它的成分金属熔点低 B. 合金的硬度一般比它的成分金属的大 C. 合金的性质一般是各成分金属性质的总和 D. 青铜是我国最早使用的合金 6.根据3NO2+H2O===2HNO3+NO,下列说法正确的是( ) A.H2O发生氧化反应 B.HNO3为还原产物 C.当反应消耗2mol NO2时,电子转移1mol. D.氧化剂与还原剂物质的量之比为1:2 二、 选择题:(本题共6小题。每小题4分,共24分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2 分,选两个且都正确得4分,但只要选错一个就得0分) 7.将一粒钠投入下列稀溶液中,能产生气体和沉淀的是( ) A. MgCl2 B. NaCl C.CuCl2 D. H2SO4 8.下列物质间的反应能用离子方程式H++OH-== H2O 表示的是( ) A. 稀H2SO4和Ba(OH)2溶液 B. 澄清石灰水和稀HNO3 C. 稀HNO3和Cu(OH)2 D. 醋酸和KOH溶液 9.下列关于Na2CO3和NaHCO3性质的说法错误的是( ) A. 热稳定性Na2CO3>NaHCO3 B. 相同温度时,在水中的溶解性:Na2CO3>NaHCO3 C. 与盐酸反应生成CO2速率:Na2CO3>NaHCO3 D. 等物质的量浓度溶液的碱性:Na2CO3>NaHCO3 10.NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.常温下,在16gO2中含有NA个氧原子 B.将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL·L-1 C.标准状况下,22.4L H2O的分子数为NA个 D.1mol Na2O2中含有的阴离子数目为2NA个 11.在下列各溶液中,离子一定能大量共存的是( ) A.强碱性溶液中:K+、Fe3+、Cl-、SO B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、Cl-、NO C.含有0.1 mol·L-1 Ca2+的溶液中:Na+、K+、CO、Cl- D.室温下,pH=1的溶液中:Na+、Fe3+、NO、SO 12.Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组在实验室中探究Ti、Mg、Cu的活动性顺序。在相同温度下,他们取大小相同的三种金属薄片,分别投入等体积等物质的量浓度的足量稀盐酸中,观察到的现象如下: 金属 Ti Mg Cu 金属表面现象 放出气泡速率缓慢 放出气泡速率快 无变化 下列有关三种金属的说法正确的是( ) A.三种金属的金属活动性由强到弱的顺序是Mg、Ti、Cu B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径 D.Cu和稀盐酸不发生化学反应 第Ⅱ卷(64分) 13.(8分)掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。 (1)写出下列仪器的名称:a.____________,b.___________,c.__________。 (2)若利用装置分离酒精和水的混合物,还缺少的仪器是______,冷凝水由___口流出(填f或g)。 (3)现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。 ①图中的错误是_____________________________。 ②根据计算得知,所需NaOH的质量为____________________。 14.(10分)下列物质中①Fe ②NH3 ③稀盐酸 ④酒精 ⑤H2SO4 ⑥熔融BaSO4(填相应的编号) (1)属于电解质的是________________________; (2)属于酸的是_______________________; (3)所给状态下能导电的物质____________________; (4)写出⑤在水中的电离方程式__________________________________________; 写出①和③反应的离子方程式:________________________________________。 15.(10分)有A、B、C、D四种常见的金属单质,A的焰色为黄色;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射,生成黑色固体。 根据以上信息回答下列问题: (1)写出对应化学式:A________,B________,C________,D________。 (2)写出下列化学方程式: ①A在空气中燃烧 ; ②B与AgNO3 溶液:_________________________________; ③C与氢氧化钠溶液:___________________________________________。 16.(12分)Na2O2是常见的供氧剂,可作为防毒面具或潜水艇的氧气来源,请回答下列问题: (1)Na2O2是________色固体; (2)请写出Na2O2与CO2反应的化学方程式:__________________________________________, 该反应中还原剂是__________,还原产物是_______________, (3)Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,若该反应消耗7.8g Na2O2 ,则反应转移电子数为__________,标准状况下生成O2的体积________L。 17.(12分)用如图所示装置探究铁粉在高温下与水蒸气反应的实验。 (1)A装置加热作用是___________________________; (2)B中反应的化学方程式:_________________________________________, 标准状况下,若该反应生成22.4L气体,则反应转移的电子数为______________。 (3)装置D 中的现象是__________________________________________, 写出D中反应方程式:___________________________________________________________; (4)A 、B两处酒精灯点燃顺序:____________________________。 18.(12分)为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。 (1)往A溶液中分别滴入几滴KSCN溶液,溶液的颜色__________, (2)根据上述过程写出有关反应的离子方程式: Fe3O4→A ______________________________________________ A→B ______________________________________________。 (3)向B溶液中加入NaOH溶液,可看到的现象是___________________________________________,此过程中发生的氧化还原反应化学方程式为 。 (4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。 2018-2019学年(1)高一年级第一次月考试题 化学答案 题号 1 2 3 4 5 6 7 8 9 10 11 12 答案 A B A D C D AC B C A BD AD 第Ⅱ卷(64分) 13.(8分)(1)蒸馏烧瓶 冷凝管 容量瓶(每空1分) (2)酒精灯 f (各1分) (3)①移液时未用玻璃棒引流 (1分) ②2g(2分) 14.(10分)(1)⑤⑥ (2)⑤ (3)①③⑥ (4)H2SO4 = 2H+ + SO42- 2H+ + Fe = H2 + Fe2+ (每空2分) 15.(10分) ∆ (1)Na Cu Al Fe(每空1分) 2Na+O2 = Na2O2 高温 (2)① ②Cu+2AgNO3=Cu(NO3)2+2Ag ③2Al+2NaOH+2H2O = 2NaAlO2+3H2(每空2分) 16.(12分)(每空2分) (1) 淡黄 (2)2Na2O2+2CO2=2Na2CO3+O2 Na2O2 Na2CO3 0.1 NA 1.12 17.(12分)(每空2分) 高温 (1)产生水蒸气 ∆ CuO + H2 = Cu + H2O 3Fe+4H2O(g) === Fe3O4+4H2 (2) 2NA (3)有黑色变为红色, 管内有水珠 (4) 先点A处,再点燃B处。 18.(12分) (1)变为血红色(2分) (2)Fe3O4+8H+= 2Fe3+ + Fe2+ + 4H2O 2Fe3+ + Fe = 3Fe2+ (每空2分) (3)白色沉淀转变为灰绿色又转变为红褐色 4 Fe(OH)2 + O2 +2H2O = 4Fe(OH)3 (每空2分) (4)Fe(OH)3 丁达尔 (每空1分)查看更多