- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省棠湖中学2019-2020学年高二下学期第一次在线月考试题
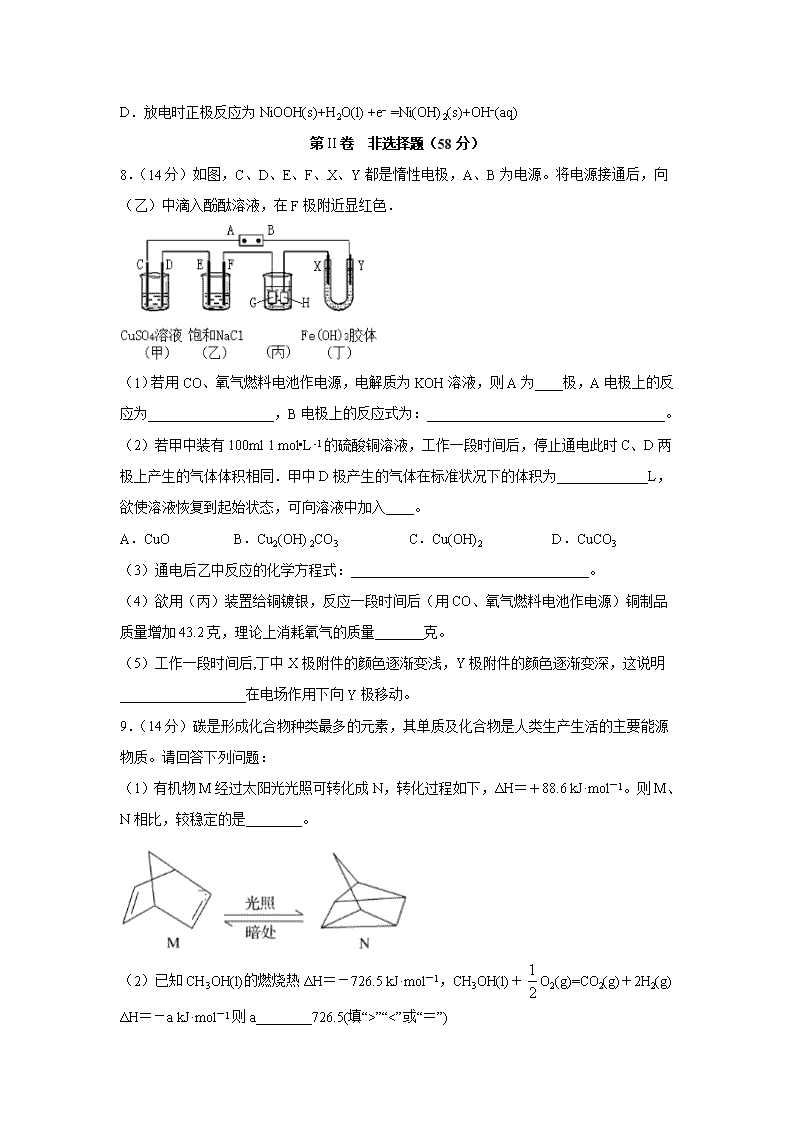
四川省棠湖中学2019-2020学年高二下学期第一次在线月考试题 注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。 2.答题时请按要求用笔。 3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。 4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 6.考试时间:150分钟;物理化学生物同堂分卷考试,物理110分,化学100分,生物分90分,共300分 7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64 第I卷 选择题(42分) 一、选择题(每小题6分,共7个小题,共42分;其中每题都为单选题。) 1.化学与生产、生活、社会密切相关,下列说法不正确的是( ) A.中国天眼FAST用到的碳化硅是一种新型无机非金属材料 B.氯水放置数天后,漂白性和酸性均减弱 C.由石油的裂解可以得到乙烯、丙烯等主要化工基本原料 D.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因水中生成了硫酸 2.水垢的主要成分包括CaCO3、CaSO4等,下列说法错误的是( ) A.容易产生水垢的水-般是硬水 B.盐酸去除水垢的能力比醋酸更好 C.可用小苏打去除电水壶中的水垢,因为小苏打溶液显酸性 D.水垢中的CaSO4可先用Na2CO3溶液浸泡,再用酸去除 3.能正确表达下列反应的离子方程式为( ) A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O B.Na2S2O3溶液中滴入稀硫酸:S2O32-+2H+=S↓+SO2↑+H2O C.向足量的稀硝酸中加入少量铁粉:2NO3-+8H++3Fe=3Fe2++2NO↑+4H2O D.Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O 4.配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是( ) A.较浓盐酸可有效抑制Fe3+水解 B.稀释过程中FeCl3水解程度增大,c(H+)增大 C.FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+ D.FeCl3溶液显黄色,没有Fe(OH)3存在 5.已知Ksp(AgCl)=1.8×10-10。向盛有0.1 mol/L AgNO3溶液的试管中滴加等体积0.1 mol/L NaCl溶液,静置沉降,取上层清液和下层悬浊液分别进行实验。下列判断正确的是( ) A.上层清液为AgCl的饱和溶液 B.向清液中滴加0.1 mol/L AgNO3溶液,c(Cl-)不变 C.向悬浊液中滴加0.1 mol/L KI溶液,不会有明显变化 D.向悬浊液中加入适量浓氨水,混合液变澄清,说明AgCl可溶于强碱 6.反应N2O4(g)2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( ) A.A、C两点的反应速率:A>C B.A、C两点气体的颜色:A深,C浅 C.A、B两点气体的平均相对分子质量:A>B D.B、C两点化学平衡常数:B<C 7.为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( ) A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高 B.放电过程中OH−通过隔膜从负极区移向正极区 C.充电时阴极反应为ZnO(s)+H2O(l) +2e−= Zn(s)+2OH−(aq) D.放电时正极反应为NiOOH(s)+H2O(l) +e− =Ni(OH)2(s)+OH−(aq) 第II卷 非选择题(58分) 8.(14分)如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色. (1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则A为____极,A电极上的反应为__________________,B电极上的反应式为:__________________________________。 (2)若甲中装有100ml 1 mol•L-1的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同.甲中D极产生的气体在标准状况下的体积为_____________L,欲使溶液恢复到起始状态,可向溶液中加入____。 A.CuO B.Cu2(OH) 2CO3 C.Cu(OH)2 D.CuCO3 (3)通电后乙中反应的化学方程式:__________________________________。 (4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,理论上消耗氧气的质量_______克。 (5)工作一段时间后,丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明__________________在电场作用下向Y极移动。 9.(14分)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题: (1)有机物M经过太阳光光照可转化成N,转化过程如下,ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。 (2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”) (3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:________________________________________。 (4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_______。 (5) 已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1 ③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1 则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH=__________________。 (6)已知拆开1 mol H—H键,1 mol N—H键,1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:________ ________。 10.(15分)某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废物综合利用,方案如图所示: 已知:各离子开始沉淀及完全沉淀时的pH如表所示。 离子 开始沉淀时的pH 完全沉淀时的pH Fe2+ 6.34 9.7 Fe3+ 1.48 3.2 Zn2+ 6.2 8.0 请回答下列问题: (1)加入A物质的目的是___,物质A可使用下列物质中的___。 A.KMnO4 B.O2 C.H2O2 D.Cl2 (2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4 的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)___Ksp(ZnS)(选填“>”“<”或“=”)。 (3)反应生成海绵铜的离子方程式:___。 (4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在___范围之间。 (5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式:___。 (6)物质B可用作生产化肥,其化学式是___。 11.(15分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验: 实验一:焦亚硫酸钠的制取 采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2Na2S2O5。 (1)加试剂前要进行的操作是_______________。装置Ⅰ中产生气体的化学方程式为____________。 (2)浓硫酸_______________ (填“能”或“不能”)用稀硫酸代替,原因是_______________。 (3)从装置Ⅱ中分离出产品可采取的分离方法是_______________________。 (4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。 实验二:葡萄酒中抗氧化剂残留量的测定 (5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下: (已知:滴定时反应的化学方程式为SO2+I2+2H2OH2SO4+2HI) ①按上述方案实验,消耗标准I2溶液30.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。 ②在上述实验过程中,若有部分HI被空气氧化,则测定结果______________(填“偏高”、“偏低”或“不变”)。 【参考答案】 1.B 2.C 3.B 4. A 5.A 6.D 7.B 8.正 O2+4e-+2H2O=4OH- CO-2e-+4OH-=CO32-+2H2O 2.24 C 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 3.2 氢氧化铁胶体粒子带正电荷 9.M < 2Cl2(g)+2H2O(g)+C(s)=4HCl (g)+CO2(g) ΔH=-290.0 kJ·mol-1 98.0 kJ —80 kJ·mol-1 N2(g)+3H2(g) 2NH3(g) ΔH=-92.0 kJ·mol-1 10.将Fe2+氧化成Fe3+,方便后续沉淀时除去 BC < Fe+Cu2+=Fe2++Cu 3.2≤pH<6.2或3.2~6.2 2Zn2++4HCO3-=Zn2(OH)2CO3↓+H2O +3CO2↑ (NH4)2SO4 11. 检查装置的气密性 Na2SO3+H2SO4(浓)== Na2SO4+SO2↑+H2O 不能 如用稀硫酸,则生成的二氧化硫会溶解在溶液中而难以逸出 过滤 d 0.192 偏低查看更多