- 2021-08-23 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年辽宁葫芦岛协作校高一上学期第二次月考试题 化学 解析版
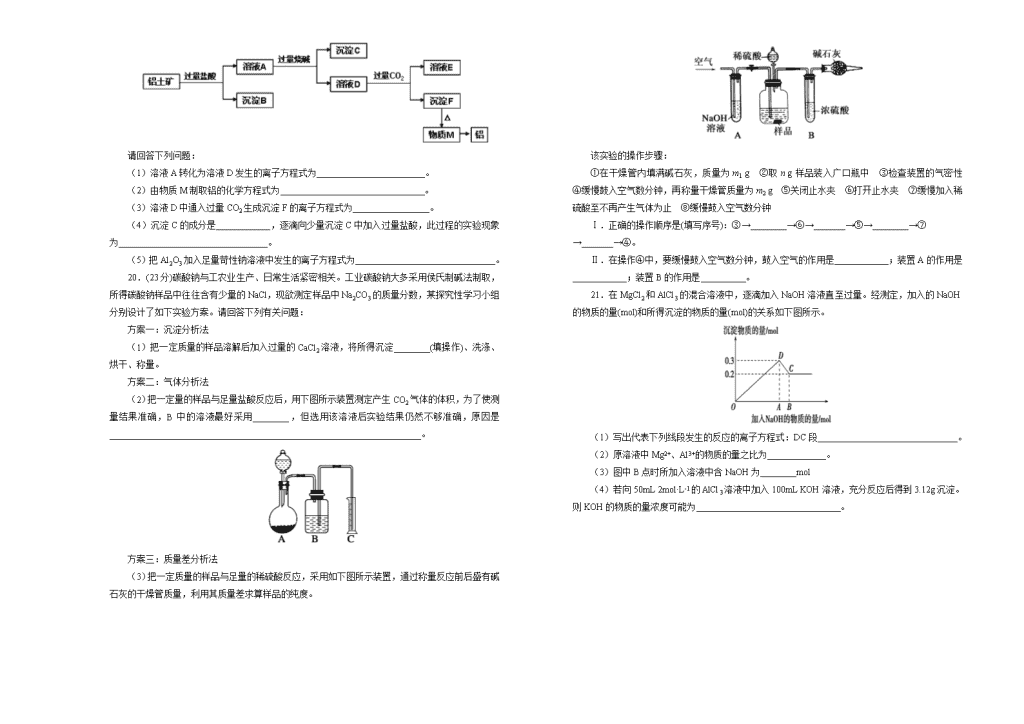
2018-2019学年辽宁葫芦岛协作校高一上学期第二次月考试题 化学 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4.考试结束后,请将本试题卷和答题卡一并上交。 相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32 Cl∶35.5 K∶39 Fe∶56 Mn∶55 Ba∶137 第I卷(选择题,共48分) 一、选择题(每小题3分,共48分,每小题只有一个选项符合题意) 1.下列说法不正确的是 A.《黄白第十大》中“曾青涂铁,铁赤如铜”主要发生了置换反应 B.唐代《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手、面及屋舍者”,描述了硫磺熏制过程 C.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,利用到蒸馏 D.“所在山洋,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”过程包括了溶解、蒸发、结晶等操作 2.钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中对现象描述正确的是 A.①②③④⑤ B.全部 C.①②③⑤⑥ D.①③④⑤⑥ 3.下列实验操作完全正确的是 编号 实验 操作 A 钠与水反应 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 B 配制一定浓度的氯化钾溶液1000mL 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 C 鉴别KCl、AICl3和MgCl2溶液 分别向三种溶液中滴加NaOH溶液至过量 D 取出分液漏斗中所需的上层液体 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 4.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是 ①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2 ②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中 ③化合物KCl的焰色为紫色;K2CO3的焰色也为紫色 ④钠钾合金的熔点应介于Na和K熔点之间 A.①② B.①④ C.①②③④ D.①②④ 5.下列离子方程式书写正确的是 A.钠投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu B.AlCl3溶液中加入足量氨水:Al3++3OH−===Al(OH)3↓ C.三氯化铁溶液中加入铁粉:Fe3++Fe===2Fe2+ D.FeCl2溶液与Cl2反应:2Fe2++Cl2===2Fe3++2Cl− 6.质量相同的两份铝粉,第一份中加入足量的NaOH溶液,第二份中加入足量的盐酸,在同温同压下放出气体的体积比是 A.1∶2 B.2∶1 C.1∶4 D.1∶1 7.一种无色溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,则该溶液中含有的离子是 A.一定溶有SO B.一定溶有CO C.一定有Ag+ D.可能有SO 8.FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是 A.加入KSCN溶液一定不变红色 B.溶液中一定含Fe2+ C.溶液中一定含Cu2+ D.剩余固体中一定含铜 9.向100mL 1.0mol·L−1的AlCl3溶液中逐滴加入0.5mol·L−1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线关系正确的是 10.对实验Ⅰ~Ⅳ的实验操作现象判断正确的是 A.实验Ⅰ:产生红褐色沉淀 B.实验Ⅱ:溶液颜色变红 C.实验Ⅲ :放出大量气体 D.实验Ⅳ:先出现白色沉淀,后溶解 11.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是 选项 陈述Ⅰ 陈述Ⅱ 判断 A 小苏打可用于治疗胃病 NaHCO3可与盐酸反应 Ⅰ对;Ⅱ对;有关系 B 滴有酚酞溶液的水溶液中加Na2O2,溶液变红 Na2O2与水反应生成氢氧化钠 Ⅰ对;Ⅱ错;无关系 C 金属钠具有强还原性 高压钠灯发出透雾性强的黄光 Ⅰ对;Ⅱ对;有关系 D 过氧化钠可用作航天员的供氧剂 Na2O2能和CO2、H2O反应生成O2 Ⅰ对;Ⅱ对;无关系 12.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y)的关系示意图中正确的是 13.现加热5g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为 A.3.38g B.4.58g C.4.16g D.4.41g 14.常温下,在溶液中可以发生以下反应: ①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2; 由此判断下列说法错误的是 A.铁元素在反应①和③中均被氧化 B.反应②中当有1mol Cl2被还原时,有2mol Br-被氧化 C.氧化性强弱顺序为Cl2>Br2>Fe3+>I2 D.还原性强弱顺序为I->Fe2+>Br->Cl- 15.如图所示,A、B是两个完全相同的装置,分别装有10mL相同浓度的盐酸,某学生分别在A、B的侧管中装入1.06g Na2CO3和0.84g NaHCO3,然后将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是 A.A装置的气球膨胀得快 B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol·L−1 C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol·L−1 D.最终两试管中Na+、Cl−的物质的量分别相等 16.将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为 A.3∶2 B.2∶1 C.3∶4 D.4∶3 第Ⅱ卷(共52分) 二、非选择题 17.(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl−、H+中,具有氧化性的是____________,其中氧化性最强的是____________。 (2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用: ①Zn+2HCl===ZnCl2+H2↑____________________; ②NaOH+HCl===NaCl+H2O__________________; ③2HClH2↑+Cl2↑________________________。 (3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液FeCl2;向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、MnO中,__________________氧化性最强。 (4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。 18.A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系: (1)推断各符号所代表的物质的化学式: A____________,B____________,C____________,D____________,E____________。 (2)分别写出反应②、⑤的化学方程式: ②______________________________________, ⑤__________________________________________。 (3)写出反应③的离子方程式____________________________________________。 19.已知铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程: 请回答下列问题: (1)溶液A转化为溶液D发生的离子方程式为________________________。 (2)由物质M制取铝的化学方程式为________________________________。 (3)溶液D中通入过量CO2生成沉淀F的离子方程式为_________________。 (4)沉淀C的成分是____________,逐滴向少量沉淀C中加入过量盐酸,此过程的实验现象为_________________________________。 (5)把Al2O3加入足量苛性钠溶液中发生的离子方程式为_______________________________。 20.(23分)碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量的NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题: 方案一:沉淀分析法 (1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗涤、烘干、称量。 方案二:气体分析法 (2)把一定量的样品与足量盐酸反应后,用下图所示装置测定产生CO2气体的体积,为了使测量结果准确,B中的溶液最好采用________,但选用该溶液后实验结果仍然不够准确,原因是_____________________________________________________________________。 方案三:质量差分析法 (3)把一定质量的样品与足量的稀硫酸反应,采用如下图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度。 该实验的操作步骤: ①在干燥管内填满碱石灰,质量为m1 g ②取n g样品装入广口瓶中 ③检查装置的气密性 ④缓慢鼓入空气数分钟,再称量干燥管质量为m2 g ⑤关闭止水夹 ⑥打开止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟 Ⅰ.正确的操作顺序是(填写序号):③→________→⑥→_______→⑤→________→⑦→_______→④。 Ⅱ.在操作④中,要缓慢鼓入空气数分钟,鼓入空气的作用是____________;装置A的作用是____________;装置B的作用是__________。 21.在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。 (1)写出代表下列线段发生的反应的离子方程式:DC段_______________________________。 (2)原溶液中Mg2+、Al3+的物质的量之比为_____________。 (3)图中B点时所加入溶液中含NaOH为________mol (4)若向50mL 2mol·L-1的AlCl3溶液中加入100mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为________________________________。 2018-2019学年上学期高一 第二次月考 化 学答 案 第I卷(选择题,共48分) 一、选择题(每小题3分,共48分,每小题只有一个选项符合题意) 1.【答案】B 【解析】A.曾青除铁,铁赤如铜,发生反应离子方程式铁与铜离子反应生成二价铁离子,属于置换反应,故A正确;B.黑火药是由木炭粉(C)、硫磺(S)和硝石(KNO3)按一定比例配制而成,由题意可知,题中描述的是制备黑火药的过程,故B错误;C.蒸令气上,则利用互溶混合物的沸点差异分离,则该法为蒸馏,故C正确;D.KNO3溶解度随温度变化大,提纯的方法是利用溶解后,煎炼得之主要利用蒸发结晶,故D正确;故选D。 2.【答案】D 【解析】①钠的密度小于水的密度,所以钠会浮在水面上,故①正确,②错误;③钠的熔点较 低,钠和水生成强碱氢氧化钠和氢气,且放出大量的热,放出是热量导致钠熔化成小球,故③正确;④放出的气体导致钠受力不均而迅速游动,最后钠和水完全反应而消失,故④正确;⑤钠和水反应迅速,且有气体生成,所以发出嘶嘶的声音,故⑤正确;⑥钠和水反应生成强碱而使溶液呈碱性,无色酚酞试液遇碱变红色,故⑥正确,故选D。 3.【答案】C 【解析】A实验没有用滤纸将钠块表面的煤油擦净,同时钠与水反应,烧杯中不能装满水,否则,钠粒游动,导致溶液溅出, A错误,配制KCl溶液时应先将KCl晶体溶解在小烧杯中,恢复到室温再转移到容量瓶中,B错误,分液漏斗中上层液体应从分液漏斗的上口倒出,D错误。 4.【答案】D 【解析】①钠是活泼金属,与水反应生成NaOH和H2,但铁需要在高温下与水蒸气反应生成Fe3O4和H2,所以①错误;②铁因含有杂质,露置在空气中由于发生化学反应而生锈,但性质更活泼的铝由于易被氧化,在表面形成致密的氧化膜而得到保护,所以铝具有较强的抗腐蚀能力,可稳定存在于空气中,即②错误;③焰色反应是用来检验某些金属元素的,所以只要含有钾元素,焰色都是紫色的,即③正确;④合金的熔点比构成合金的成分金属熔点都低,所以④错误。 5.【答案】D 【解析】A.将钠投入CuSO4溶液,Na先与水反应生成NaOH和H2,OH−与Cu2+反应,生成Cu(OH)2,离子方程式为:2Na+2H2O+Cu2+===H2↑+2Na++Cu(OH)2↓,故A错误; B.NH3·H2O为弱碱,离子方程式中不可拆开,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH,故B错误;C.电荷不守恒,正确的离子方程式为:2Fe3++Fe===3Fe2+,故C错误;D.产物正确,拆分正确,电荷守恒,D正确。故选D。 6.【答案】D 【解析】由2Al+6HCl===2AlCl3+3H2↑和2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知Al与H2的数量关系相同,质量相同的铝与足量的酸碱反应生成的H2相同。 7.【答案】D 【解析】与氯化钡能生成白色沉淀的有很多,但不溶于硝酸的只有氯化银和硫酸钡,所以溶液中可能是SO或是Ag+。 8.【答案】C 【解析】反应后剩余固体有两种可能,一是固体为单质铜,此时溶液中一定无Fe3+,一定有Fe2+,Cu2+可能有也可能没有。二是固体为铁和铜的混合物,此时溶液中一定无Fe3+和Cu2+,一定有Fe2+,故应选C。 9.【答案】D 【解析】向AlCl3溶液中逐滴加入NaOH溶液至过量,发生的离子反应依次是Al3++3OH−===Al(OH)3↓、Al(OH)3+OH−===AlO+2H2O,其现象是先产生白色胶状沉淀,后沉淀逐渐减少,直到全部消失。沉淀最多和沉淀恰好完全消失时消耗的NaOH的物质的量之比为3∶1。 10.【答案】C 【解析】A.实验Ⅰ中向沸水中滴加少量的氯化铁饱和溶液,可以产生红褐色的氢氧化铁胶体,A错误;B.实验Ⅱ中,KSCN溶液滴加到氯化亚铁溶液后,溶液不变色,B错误;C.实验Ⅲ中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,C正确;D.实验Ⅳ中,氨水滴入氯化铝溶液后,生成白色沉淀氢氧化铝,氨水碱性较弱,不能溶解氢氧化铝,D错误;答案选C。 11.【答案】A 【解析】B项向滴有酚酞溶液的溶液中加Na2O2,先变红,后马上褪色,陈述Ⅰ错,陈述Ⅱ正确;C项高压钠灯发黄光是物理变化,与金属钠具有还原性没有因果关系;D项陈述Ⅰ和Ⅱ有因果关系。 12.【答案】C 【解析】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,会生成氢氧化铝和氢氧化镁的白色沉淀,随着氢氧化钠的加入,沉淀量会逐渐增加,当达到最大沉淀量后,继续滴加氢氧 化钠溶液,则生成的氢氧化铝会与过量的氢氧化钠反应(表现出氢氧化铝的两性),使沉淀量逐渐减少,当氢氧化铝全部溶解后,沉淀量不再变化。 13.【答案】C 【解析】碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,设混合物中含有x g NaHCO3,则 2NaHCO3Na2CO3+CO2↑+H2O Δm 2×84g 62g x g 0.31g 解之得:x=0.84,所以m(Na2CO3)=5g-m(NaHCO3)=5g-0.84g=4.16g。 14.【答案】A 【解析】选项A,反应①中Fe2+作还原剂,在反应中被氧化,反应③中Fe3+作氧化剂,在反应中被还原,A不正确;反应②中Cl2作氧化剂,当1mol Cl2被还原时,有2mol Br-被氧化,B正确;由反应①可知,氧化性Br2>Fe3+,还原性Fe2+>Br-;由反应②可知,氧化性:Cl2>Br2,还原性Br->Cl-,由反应③可知,氧化性Fe3+>I2,还原性,I->Fe2+,故C、D正确。 15.【答案】B 【解析】Na2CO3和NaHCO3分别与等浓度的盐酸反应,后者反应更剧烈,放出气体的速率更大, 故B装置的气球膨胀得快,A错误。Na2CO3和NaHCO3的物质的量相同,当盐酸足量,即盐酸的浓度大于或等于2mol·L−1时,最终两气球体积相同;当盐酸不足,即盐酸的浓度小于2mol·L−1时,A装置气球的体积小于B装置气球的体积,故B正确,C错误。A装置试管中Na+的物质的量是B装置试管中Na+的物质的量的2倍,但两试管中Cl−的物质的量相等,D错误。 16.【答案】C 【解析】设每份铁铝合金样品中含铁、铝的物质的量分别为x、y,则由FeH2↑、AlH2↑、AlH2↑三个关系式得知(x+)∶(y)=3∶2,解得x∶y=3∶4 17.【答案】(1)Cl2、H+;Cl2 (2)①氧化性、酸性;②酸性;③既有氧化性又有还原性 (3)MnO (4)HBr;40.5;还原性、酸性 【解析】被氧化的HBr占总的参加反应的HBr的,反应中有MnBr2、KBr(盐)生成,HBr表现出了酸性。 18.【答案】(1)Na Na2O2 NaOH Na2CO3 NaHCO3 (2)②2Na+2H2O===2NaOH+H2↑;⑤CO2+H2O+Na2CO3===2NaHCO3 (3)CO2+2OH− ===CO+H2O 【解析】由B为淡黄色固体可知:B为过氧化钠,前后联系可判断A为钠、C为氢氧化钠、D为碳酸钠、E为碳酸氢钠。 19.【答案】(1)Al3++4OH−===AlO+2H2O、H++OH−===H2O (2)2Al2O34Al+3O2↑ (3)AlO+CO2+2H2O=Al(OH)3↓+HCO (4)Fe(OH)3和Mg(OH)2;沉淀全部溶解,溶液变为黄色 (5)Al2O3+2OH−===2AlO+H2O 【解析】向铝土矿中加入过量盐酸,Al2O3、Fe2O3、MgO完全溶解得到溶液A,溶液A中含有AlCl3、FeCl3、MgCl2和HCl,SiO2不溶于盐酸,所以沉淀B为SiO2,溶液A中加入过量烧碱,得到沉淀C为Fe(OH)3和Mg(OH)2,溶液D中含有NaCl、NaAlO2、NaOH,向溶液D中通入过量CO2,生成沉淀F为Al(OH)3,溶液E中含有NaCl、NaHCO3,Al(OH)3受热分解生成Al2O3,电解熔融的Al2O3制得金属Al。(1)向溶液A中加入过量的烧碱转化为溶液D,Al3+和过量的NaOH反应生成AlO和H2O、H+和OH−反应H2O,反应的离子方程式为:Al3++4OH−===AlO+2H2O、H++OH−===H2O,(2)电解熔融的Al2O3可制得金属Al,化学方程式为:2Al2O34Al+3O2↑,(3)向溶液D中通 入过量CO2,与AlO反应生成Al(OH)3沉淀和HCO,离子方程式为:AlO+CO2+2H2O===Al(OH)3↓ +HCO;(4)根据上述分析可知,沉淀C的成分是Fe(OH)3和Mg(OH)2,逐滴向少量沉淀C中加入过量盐酸,沉淀全部溶解,得到FeCl3和MgCl2溶液,溶液变为黄色,(5)把Al2O3加入足量苛性钠溶液中,Al2O3与NaOH溶液反应生成偏铝酸钠和水,离子方程式为:Al2O3+2OH−===2AlO+H2O。 20.【答案】(1)过滤 (2)饱和NaHCO3溶液 CO2气体中混有的HCl气体与NaHCO3溶液作用生成CO2 (3)Ⅰ.② ⑧ ① ⑥ Ⅱ.使广口瓶中产生的CO2气体全部排出 吸收空气中的CO2气体 吸收CO2中的水蒸气 【解析】(1)沉淀应先过滤出来,然后洗涤、烘干、称量。(2)应保证CO2气体不溶于B瓶液体,瓶中液体应盛饱和NaHCO3溶液以降低CO2的溶解度;但A中所用盐酸具有挥发性,HCl会与NaHCO3溶液作用生成CO2,从而导致CO2的体积要比实际的大。(3)依据实验目的,结合各装置中试剂的性质,不难确定各装置的作用和操作顺序。 21.【答案】(1)Al(OH)3+OH−===AlO+2H2O (2)2∶1;(3)0.8mol (3)1.2mol·L−1;(4)3.6mol·L−1 【解析】本题考查与Al(OH)3有关的图像的计算,Al3+与强碱反应的计算。在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液,图像中OD段发生的反应为MgCl2+2NaOH===Mg(OH)2↓+2NaCl、AlCl3+3NaOH===Al(OH)3↓+3NaCl;Mg(OH)2不溶于NaOH溶液,Al(OH)3溶于NaOH溶液,DC段 发生的反应为Al(OH)3+NaOH===NaAlO2+2H2O。(1)DC段为Al(OH)3溶于NaOH生成NaAlO2和H2O,反应的离子方程式为Al(OH)3+OH−===AlO+2H2O。(2)根据纵坐标,Mg(OH)2物质的量为0.2mol,n(Mg2+)=n[Mg(OH)2]=0.2mol,Al(OH)3物质的量为0.3mol-0.2mol=0.1mol,n(Al3+)=n[Al(OH)3]= 0.1mol,原溶液中Mg2+、Al3+物质的量之比为0.2mol∶0.1mol=2∶1。(3)根据反应Mg2++2OH−===Mg(OH)2↓,Mg2+消耗的NaOH物质的量为0.2mol2=0.4mol;B点时Al3+完全转化为AlO,根据反应Al3++4OH−===AlO+2H2O,到B点时Al3+消耗的NaOH物质的量为0.1mol4=0.4mol;图中B点所加溶液中含NaOH物质的量为0.4mol+0.4mol=0.8mol。(4)n(AlCl3)=2mol·L−10.05L=0.1mol,n[Al(OH)3]==0.04mol0.1mol。可能存在两种情况,①若加入的KOH溶液较少使部分AlCl3反应生成Al(OH)3沉淀,根据反应AlCl3+3KOH===3KCl+Al(OH)3↓,消耗的KOH物质的量n(KOH)=3n[Al(OH)3]=30.04mol=0.12mol,c(KOH)==1.2mol·L−1; ②若加入的KOH使AlCl3完全沉淀,KOH又溶解了部分Al(OH)3,AlCl3完全沉淀消耗KOH物质的量为0.1mol3=0.3mol,生成Al(OH)3沉淀的最大值为0.1mol,则溶解的Al(OH)3物质的量为0.1mol-0.04mol=0.06mol,根据反应Al(OH)3+KOH===KAlO2+2H2O,溶解Al(OH)3消耗的KOH物质的量为0.06mol,加入的KOH物质的量为0.3mol+0.06mol=0.36mol,c(KOH)==3.6 mol·L−1;KOH物质的量浓度可能为1.2mol·L−1或3.6mol·L−1。查看更多